颗粒酶B通过SRGN/NF-kappaB信号通路调节类风湿关节炎成纤维细胞样滑膜细胞的增殖和炎症反应
2022-02-02詹宇威林书典黄艳艳
詹宇威,林书典,詹 锋,黄艳艳,杨 舟
0 引 言
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的慢性全身炎症性疾病,其特点是关节疼痛和肿胀,是致残的主要原因,严重威胁着人们的生命健康和生活质量[1-2]。该疾病的发病出现在任何年龄,但40~60岁是风险最大的年龄组[3]。目前,对RA的治疗主要是为了缓解疼痛以及炎症反应,以提高RA患者的生活质量[4]。研究显示,靶向免疫疗法和积极的治疗策略极大地改善了临床结果[5],但目前仍无治愈方法。因此,阐明其潜在的分子机制对于开发新的RA治疗策略至关重要。
颗粒酶B(Granzyme B,GZMB)是一种丝氨酸蛋白酶, 在NK细胞或细胞毒性T淋巴细胞表达[6]。目前,GZMB已被证明参与多种病理过程,包括抗肿瘤免疫以及病毒感染等[7-8]。例如,先前的研究表明,GZMB能够通过直接水解致病所必需的病毒蛋白而抑制病毒复制,从而促进抗病毒免疫[9]。更重要的是,多项研究报道GZMB在类风湿关节炎中高表达,并且其表达水平和RA的发生进展相关[10-11]。但其在类风湿关节炎中发挥作用的机制尚不完全清楚。
丝甘蛋白聚糖(serglycin,SRGN)作为一种造血细胞颗粒蛋白聚糖,是细胞内唯一具有与多种生物分子相互作用能力的蛋白多糖,主要表达于血细胞、内皮细胞、肿瘤细胞和胚胎干细胞[12-13]。SRGN参与多种造血或非造血细胞中炎症介质的储存和分泌[14-15],因此,SRGN过量产生与炎症机制的扩大和进展有关,例如,在人类造血和非造血肿瘤中,SRGN增强炎症反应,促进肿瘤生长和转移,其增加与预后不良相关[16]。此外,有研究发现在非小细胞肺癌中SRGN通过CD44/NF-kappaB/CLDN1轴促进上皮间质转化和肿瘤的侵袭转移[17];SRGN直接参与调节非感染性软骨细胞损害的机制,SRGN敲低细胞中,特异性炎症标志物和NF-kappaB激活显著降低[18],而NF-kappaB作为炎症相关的重要通路能够促进GZMB表达[19]。因此,我们推测GZMB可能通过SRGN/NF-kappaB信号通路类风湿关节炎中发挥作用。综上所述,本研究旨在探究GZMB对RA-FLSs的增殖和炎症反应的影响以及其潜在的分子机制,为炎症性关节炎的治疗提供新的靶点和策略。
1 材料与方法
1.1 主要仪器与试剂白细胞介素-6(IL-6)ELISA试剂盒(批号:PI330),IL-1β ELISA试剂盒(批号:PI305)以及IL-8 ELISA试剂盒(批号:PI640),均购自碧云天生物科技有限公司。DMEM培养基、胰蛋白酶、胎牛血清购自Thermo Fisher(中国)。TRIzol试剂(美国Invitrogen公司),BCA蛋白定量检测试剂盒(中国Thermo Fisher公司),cDNA合成试剂盒(日本TaKaRa公司),LipofectamineTM 2000 (美国Invitrogen公司)。RIPA裂解缓冲液(中国Beyotime公司),EdU检测试剂盒(中国Beyotime公司)。GZMB兔单克隆抗体(abcam,批号:ab108531),SRGN兔多克隆抗体(AtaGenix,批号:ATA37978),P65兔单克隆抗体(abcam,批号:ab32536)。p-p65兔单克隆抗体(abcam,批号:ab183559),P50兔多克隆抗体(abcam,批号:ab209795), GAPDH兔多克隆抗体(abcam,批号:ab9485)以及辣根过氧化物酶(HRP)标记的山羊抗兔lgG二抗(abcam,批号:ab6721)。
1.2细胞培养正常人的滑膜细胞(NC-FLSs)以及类风湿关节炎成纤维细胞样滑膜细胞(RA-FLSs),均购自Jennio生物技术公司(中国广州)。上述细胞置于含有20%胎牛血清(fetal bovine serum, FBS)以及1%的青霉素链霉素的DMEM培养基中,在37 ℃、5% CO2的培养箱中培养。取对数生长期的细胞用作后续实验。
1.3细胞转染为了使GAMB和SRGN过表达以及敲低GAMB的表达,GAMB过表达(Oe-TSHR)以及SRGN过表达(Oe-SRGN)和过表达阴性对照(Oe-NC)由上海吉凯基因科技有限公司合成,si-GAMB干扰序列及其阴性对照(si-NC)购自广州锐博生物,并按照脂质体转染试剂LipofectamineTM2000说明书分别转染至对应细胞分组中。qRT-PCR和Western blot检测转染效率。
1.4CCK-8检测细胞活力将处理后的各组细胞接种于96孔板中,细胞密度为5×103/孔。培养24 h、48 h以及72 h后,向每孔细胞中加入10 μL CCK-8溶液,37 ℃孵育4 h后,使用VarioskanTMLUX多功能酶标仪检测波长450 nm处的细胞光密度值(A值)评估细胞活力。该实验独立重复3次。
1.5EdU检测细胞增殖使用BeyoClickTMEdU-488细胞增殖检测试剂盒 (C0071S, 碧云天生物科技有限公司),通过5-乙基-2'-脱氧尿苷(EdU)掺入检测RA-FLSs细胞的增殖。在荧光显微镜下随机选取5个视野拍摄图像,并独立重复进行3次。
1.6免疫共沉淀实验(COIP)使用RIPA裂解缓冲液分离细胞总蛋白,并使用BCA试剂盒进行蛋白定量。400 μg蛋白与2 μg SRGN抗体在4 ℃孵育过夜。随后,加入30 μL Protein G/A琼脂糖珠孵育细胞4 ℃下孵育1h。PBS洗涤3次后,将沉淀蛋白在5 × SDS-PAGE上样缓冲液中重悬。最后,使用免疫印迹法(Western blot)进行检测。实验重复3次。
1.7逆转录定量PCR(RT-qPCR)使用Trizol(Invitrogen)按照制造商的方案从细胞中提取总RNA。使用反转录系统试剂盒(Invitrogen)合成cDNA。按照制造商的方案使用miScript SYBR Green PCR Kit(Qiagen,Germany)进行RT-qPCR。以GAPDH为内参进行归一化处理,结果用2-ΔΔCt值来比较对照组和实验组的目的基因相对表达量的差异。独立重复3次。实验所用引物见表1。

表 1 PCR引物序列信息
1.8蛋白质免疫印迹(Western blot)收集各个处理组细胞用预冷的RIPA细胞裂解缓冰上裂解10 min后,将等量蛋白于100V进行SDS-PAGE。电泳结束后,以60 V、120 min将蛋白迁移至PVDF膜,一抗4 ℃过夜孵育,TBST缓冲液洗膜3次,每次15 min后,加辣根过氧化酶标记的二抗山羊抗兔IgG,室温下孵育120 min,之后用ECL试剂盒(Solarbio,Beijing,China)进行发光反应,拍照观察蛋白印记。以GAPDH为内参照,用ImageJ软件分析条带的灰度值,实验重复进行3次。
1.9酶联免疫吸附试验(ELISA)检测IL-1β、IL-6以及IL-8水平将处于对数生长期的RA-FLSs细胞接种于24孔板中,收集各组细胞上清培养液,随后按照试剂盒说明书检测促炎因子IL-1β、IL-6以及IL-8的水平,多功能酶标仪于450 nm处测定吸光度,实验重复进行3次。
1.10统计学分析采用GraphPad Prism8.0进行统计学分析,定量资料以均数±标准差表示,两组间比较采用独立t检验;多组间比较采用单因素方差分析,并使用Tukey检验方法。以P≤0.05被认为差异具有统计学意义。
2 结 果
2.1 GZMB在RA-FLSs 细胞中表达上调首先,通过GEO数据库的检索,获取RA患者滑膜组织芯片数据(GSE153015),以OA synovium large joint为对照,RA患者synovium large joint为实验组进行GEO2R差异分析,获得差异表达基因;随后对差异表达基因导入进行PPI网络分析筛选出HUB基因(CXXL10、GZMB、CCL5、CD27、CCR2、CD38、CD274、IRF4、CXCL9和CXCL11);此外,采用RT-qPCR和Western blot检测RA-FLSs 细胞中GZMB的表达(图1c-d),结果发现,与正常人的滑膜细胞(NC-FLSs)相比,GZMB在RA-FLSs 细胞中高表达(P<0.01)。见图1。
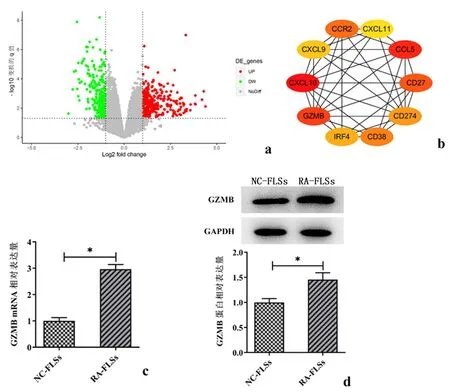
a:GEO2R分析获得差异表达基因;b:PPI网络分析筛选HUB基因;c:蛋白质免疫印迹检测GZMB蛋白表达;d:逆转录定量PCR检测GZMB mRNA表达
2.2GZMB调节RA-FLSs的增殖和炎症反应构建GZMB过表达和干扰质粒转染至RA-FLSs细胞,采用Western blot和RT-qPCR检测过表达或干扰效率,结果显示,与对照组相比,GZMB在过表达后蛋白和mRNA水平显著上调,反之,在干扰后,GZMB的表达显著下调(P<0.01)。CCK-8以及EdU实验检测细胞增殖的结果显示,与对照组相比,过表达GZMB显著地促进了细胞增殖,而干扰GZMB的表达后,细胞增殖受到抑制(P<0.01)。随后,采用ELISA实验检测炎症相关因子的表达,结果发现与对照组相比,过表达GZMB显著地上调了IL-1β、IL-6以及IL-8的水平(P<0.01),同样地,GZMB的敲除降低了上述炎症因子的表达(P<0.05)。见图2。
2.3GZMB与SRGN相结合通过GeneMANIA网站的分析获得与GZMB相关基因。将其相关基因与deRNA取交集得到6个交集基因(GZMA、SRGN、HOPX、GZMH、BIRC3、GNLY。我们选择SRGN进行下一步研究。string数据库的分析结果显示GZMB和SRGN可能相结合。采用和Western blot和RT-qPCR检测RA-FLSs 细胞中SRGN的表达,结果显示与NC-FLSs组相比,在RA-FLSs 细胞中高表达(P<0.01)。Western blot实验验证GZMB和SRGN之间的关系,结果如图3f所示,与对照组相比,GZMB过表达增加了细胞中SRGN的表达,而在GZMB敲除的细胞中,SRGN的表达被明显抑制(P<0.01)。免疫共沉淀的结果显示,在利用IgG进行沉淀实验时,SRGN与GZMB蛋白并未出现明显沉淀,表明蛋白SRGN或GZMB不能与IgG结合,但使用GZMB或SRGN诱导沉淀时,对应蛋白均出现了明显的沉淀印迹,由此表明GZMB能够与SRGN相结合。见图3。
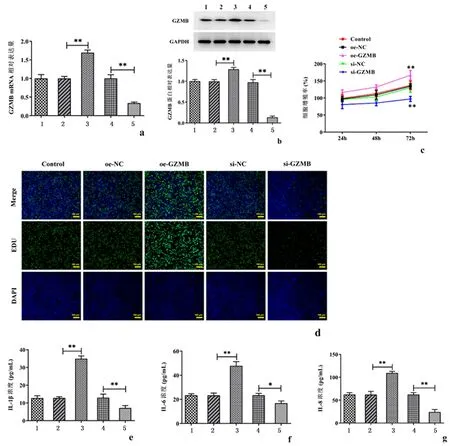
a:蛋白质免疫印迹检测GZMB蛋白表达水平;b:逆转录定量PCR检测GZMB的mRNA表达;c:CCK-8用于检测细胞活力;d:EdU检测细胞增殖;e:IL-1β表达水平;f:IL-6表达水平;g:IL-8表达水平
2.4GZMB调控SRGN参与NF-kappaB信号通路Western Blot检测结果见图4,与si-NC + oe-NC组相比,干扰GZMB显著降低了GZMB、SRGN、P65、p-p65和p50蛋白的表达水平(P<0.01),然而,进一步过表达SRGN也逆转了GZMB敲除对NF-kappaB信号通路相关蛋白(GZMB、SRGN、p65、p-p65和p50)的抑制作用(P<0.01)。见图4。上述结果表明GZMB与SRGN互相作用并通过NF-kappaB信号通路调节RA-FLSs的增殖和炎症反应。
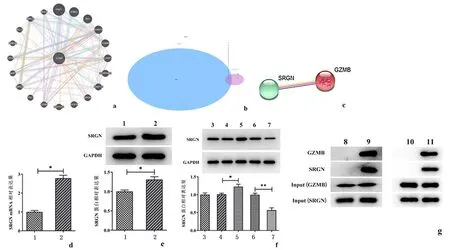
a:GeneMANIA网站中GZMB相关基因的分析;b:GZMB相关基因与deRNA的交集;c:String数据库检索GZMB和SRGN相关性;d:蛋白质免疫印迹检测SRGN蛋白表达水平;e:逆转录定量PCR检测SRGND mRNA表达水平;f:过表达或干扰GZMB时,SRGN蛋白表达水平;g:免疫共沉淀实验检测GZMB和SRGN之间的相关性
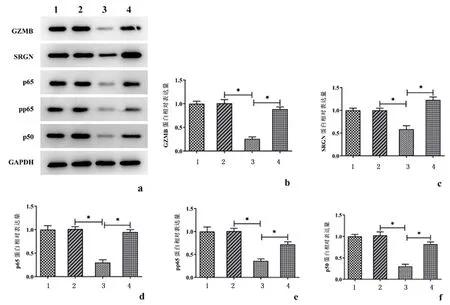
a:蛋白质免疫印迹检测NF-kappaB信号代表条带;b:GZMB表达水平;c:SRGN表达水平;d:p65表达水平;e:p-p65表达水平;f:p50表达水平
2.5SRGN过表达逆转GZMB敲除对RA-FLSs增殖和炎症反应的促进作用构建SRGN过表达载体,Western blot和RT-qPCR分别检测SRGN的过表达效率,与Oe-NC组相比,SRGN在Oe-SRGN组显著上调(P<0.001)。CCK-8以及EdU实验的结果显示,与si-NC +oe-NC组相比,干扰GZMB有效地抑制了细胞增殖(P<0.01),而过表达SRGN后逆转了GZMB敲除对细胞增殖的抑制作用(P<0.01)。同样地,ELISA的结果也显示SRGN过表达逆转了GZMB敲除对IL-1β、IL-6以及IL-8的表达的抑制作用(P<0.01)。见图5。
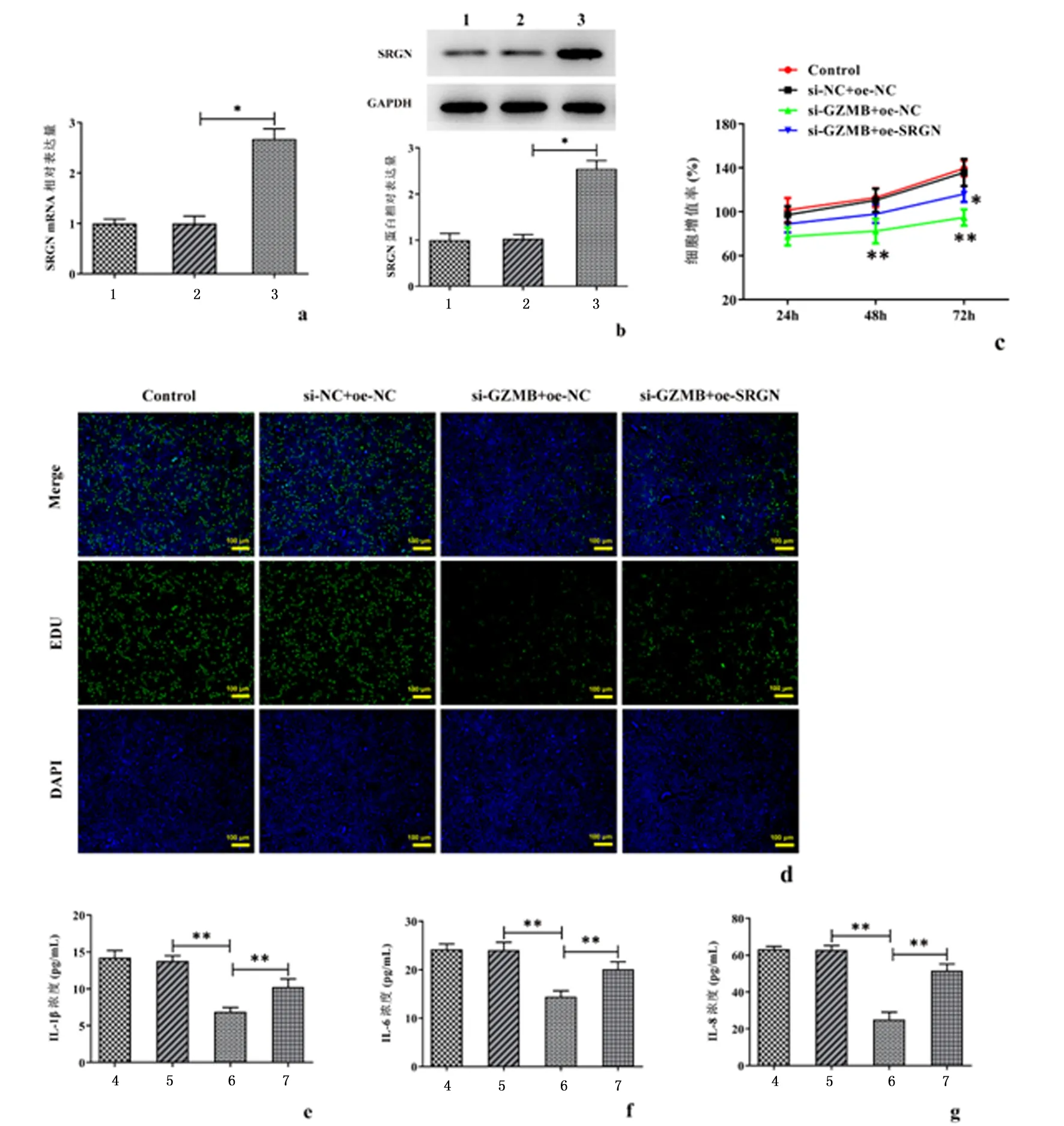
a:蛋白质免疫印迹检测SRGN蛋白表达水平;b:逆转录定量PCR检测SRGN mRNA表达;c:CCK-8法检测细胞活力;d:通过EdU测定检查细胞增殖;e:IL-1β表达水平;f:IL-6表达水平;g:IL-8表达水平
3 讨 论
目前RA仍是一种病因未明的慢性系统性疾病,主要伴有关节软骨及周围组织的破坏,以滑膜增生以及炎性滑膜炎为特征[20-21]。在本研究中,我们利用GEO数据库获取RA患者滑膜组织芯片数据并进行GEO2R差异分析,将获得的差异表达基因导入String数据库进行PPI网络分析,发现GZMB与类风湿关节炎的发病显著相关。随后,我们检测GZMB在RA-FLSs细胞中的表达发现GZMB在RA-FLSs 细胞中表达上调。通过构建GZMB过表达和干扰质粒,发现过表达GZMB显著地促进了RA-FLSs细胞增殖和炎症反应,而GZMB基因沉默有效地降低了RA-FLSs细胞中炎症因子IL-6、IL-1β和IL-8水平,抑制RA-FLSs细胞异常增殖,我们的结果提示GZMB基因沉默可能在RA滑膜增生和关节软骨损伤中发挥重要作用,这与Bao等[6]研究GZMB基因沉默对RA的影响的结果一致。
为进一步探索GZMB在类风湿关节炎中发挥作用的机制,通过GeneMANIA在线分析(http://genemania.org/),发现SRGN是GZMB相关基因,String数据库的进一步验证显示GZMB和SRGN之间存在相互作用,随后的免疫共沉淀实验结果也验证了这一点。SRGN是一种低分子量糖蛋白,主要在造血细胞中表达,分泌并整合到细胞外基质中[22]。SRGN在许多细胞因子、趋化因子和蛋白酶的储存和分泌中发挥重要作用,因此参与许多生理和病理过程[23]。研究证实,SRGN在结直肠癌、非小细胞肺癌、多发性骨髓瘤、鼻咽癌和乳腺癌中促进肿瘤侵袭和转移[17,24-25]。SRGN还通过调节TNF-α等多种炎症介质并激活NF-kappaB信号通路参与炎症过程[18]。众所周知,NF-kappaB是一个典型的炎症信号通路,主要基于促炎细胞因子如白细胞介素和肿瘤坏死因子对NF-kappaB的激活[26],重要的是,NF-kappaB同时也是促进GZMB的表达的转录因子[19]。在本研究中,我们的结果显示,SRGN在RA-FLSs 细胞中高表达,进一步过表达SRGN逆转了GZMB干扰对RA-FLSs细胞增殖,炎症反应以及NF-kappaB信号通路相关蛋白的抑制作用,表明GZMB通过SRGN/NF-kappaB信号通路调节类风湿关节炎成纤维细胞样滑膜细胞的增殖和炎症反应。
综上所述,本研究首次揭示了GZMB与SRGN在类风湿关节炎中的相互作用关系,阐明了GZMB通过SRGN/NF-kappaB信号通路调节类风湿关节炎成纤维细胞样滑膜细胞的增殖和炎症反应的作用机制,该研究为类风湿关节炎的临床治疗药物提供了新的治疗靶点和策略。
