比索洛尔通过调节线粒体自噬保护H9c2细胞缺氧/复氧损伤
2022-02-02刘书宇李贺娟宫剑滨
刘书宇,汤 沂,李贺娟,刘 晶,宫剑滨
0 引 言
近年来,随着人们生活质量的提高,急性冠脉综合征(acute coronary syndrome,ACS)发病率逐年升高,成为导致全球死亡率和致残率升高的主要疾病之一。在美国,每年有超过78万人患有ACS[1]。ACS包括冠状动脉粥样硬化斑块破裂或糜烂引起的急性心肌梗死和不稳定性心绞痛。经皮冠状动脉介入治疗(percutaneous coronary intervention ,PCI)结合溶栓治疗可恢复冠状动脉血流,减少急性心肌缺血损伤。而心肌再灌注本身可引起心肌细胞坏死,称为缺血/再灌注损伤(ischemia/reperfusion, I/R)[2-4]。I/R损伤的机制包括代谢损伤、大量氧自由基和非氧自由基的形成、细胞内钙超载、交感神经系统兴奋、炎症系统和补体系统激活以及斑块破裂引起的微血管栓塞[5-8]。
越来越多的研究表明,线粒体自噬在心肌I/R损伤中起着重要作用[9]。线粒体通过影响活性氧(ROS)、Ca2+和NAD+/NADH等细胞信号通路调控细胞的生存和死亡[10-12]。为了应对各种应激因素,细胞内的线粒体会产生相应机制(包括线粒体融合、裂变、线粒体自噬和线粒体生物合成等),以维持线粒体的正常功能。目前研究表明,在哺乳动物细胞中,线粒体分裂和融合是由视神经萎缩蛋白(Opal)、线粒体分裂蛋白(Drp1)、线粒体融合蛋白(Mfn)等蛋白共同调节以维持线粒体正常的功能;细胞内泛素连接酶Parkin与线粒体外膜蛋白激酶Pink1共同调控线粒体自噬。一项研究表明,在Drp1缺乏的小鼠心肌细胞中,线粒体自噬可能被过度激活[13-17]。已有研究表明,Drp1/Pink1/Parkin通路通过调节线粒体自噬,参与多种心血管疾病如急性心肌梗死、心功能不全、心肌病等心肌细胞线粒体损伤的选择性清除[18]。然而,该通路是否影响心肌I/R损伤尚不清楚。
另外,大量的临床证据显示比索洛尔可以显著减少ACS患者的心血管不良事件,包括复发性心肌梗死、心力衰竭、心源性死亡和住院时间等[19]。我们课题组前期研究发现比索洛尔通过减轻未折叠蛋白反应保护大鼠心肌细胞缺血/再灌注损伤[20]。但是尚未对其机制进行深入探究,为此,通过本研究旨在探讨比索洛尔是否可以通过Drp1/Pink1/Parkin通路保护H9c2心肌细胞I/R损伤。
1 材料与方法
1.1 细胞及试剂①细胞来源:H9c2心肌细胞(美国ATCC细胞库)。②试剂:Dulbecco改良的Eagle培养基DMEM(美国Gibco公司),胎牛血清(美国Gibco公司),胰蛋白酶( 美国Gibco公司),BCA蛋白测定试剂盒(碧云天),SDS-PAGE电泳液(碧云天),SDS裂解液 (碧云天),比索洛尔(大连美仑生物技术公司),多功能酶标仪(SpectraMax M5,Molecular Devices;California),MTT(南京萌邦生物),流式细胞仪(BD Biosciences, Franklin Lakes, NJ, USA),Annerxin V FITC细胞凋亡检测试剂盒(Biouniquer公司),苯甲磺酰氟(PMSF, 碧云天),一抗:p-Drp1(1:1000, #3455; Cell Signaling Technology), Drp1(1:1000, 8570; Cell Signaling Technology), Pink1 (1:1000, ab23707; Abcam), Parkin (1:1000, ab23707; Abcam), LC3 (1:1000, ab192890; Abcam), Beclin1(1:1000, ab210498; Abcam), GAPDH (1:10,000, ab8245; Abcam)。
1.2H9c2细胞培养用含10%胎牛血清的DMEM 培养基将H9c2细胞接种于细胞培养瓶中,于37 ℃、5% CO2培养箱中培养,待细胞生长融合至70%~80%左右,用0.25%的胰酶进行消化、传代,待细胞生长状态良好时,接种于不同培养板中,取对数生长期的细胞进行实验。
1.3细胞缺氧/复氧(Hypoxia/Reoxygenation,H/R)模型的构建待复苏后的细胞在37 ℃,含5%CO2,95%空气的培养箱中生长至对数期时,参照实验室前期研究[21],将细胞培养瓶中10%完全培养基换成等量的缺氧液(NaHCO326.2 mmol/L、CaCl21.8 mmol/L、MgSO40.8 mmol/L、NaH2PO42.6 mmol/L、HEPES 20.1 mmol/L、NaCl 116.4 mmol/L、KCl 5.4 mmol/L),然后放入37℃,含5%CO2、94%N2、1%O2的三气培养箱中进行缺氧6 h,最后再将缺氧液换成含10%胎牛血清的DMEM培养液,在正常培养箱中复氧12 h。
1.4实验分组将生长状态良好的H9c2细胞随机分为4 组:比索洛尔组:在无血清培养基中加入终浓度为2 μmol/L的比索洛尔,正常条件培养,不进行缺氧/复氧处理;对照组:在37 ℃、5% CO2条件下的培养箱中培养;缺氧/复氧组:根据1.3方法构建缺氧/复氧模型;缺氧/复氧+比索洛尔组:缺氧前1 h在无血清培养基中加入终浓度为2 μmol/L的比索洛尔构建模型。
1.5MTT法检测细胞活力将H9c2细胞接种于96孔培养板中,密度为5 × 103细胞/孔。待细胞生长融合至70%左右,根据实验需求随机分组给药处理,给药一定时间后,每孔加入20 μL MTT继续培养 4 h,轻轻弃去上层液体,每孔加入150 μL DMSO。摇床振荡10 min,最后用酶标仪在570 nm处测量吸光度A值。
1.6流式细胞仪检测细胞凋亡用0.25%胰蛋白酶收集不同处理组的细胞,提前准备预冷的PBS,轻轻洗涤细胞2次,再用195 μL Annexin V-FITC结合液重悬细胞。各样品分别加入5 μL Annexin V-FITC,轻轻混匀,再加入5 μL PI,室温避光反应15 min进行检测。
1.7Western blot检测蛋白表达水平先用预冷的PBS洗涤各处理组的H9c2细胞3次,再用含有1% PMSF的RIPA裂解缓冲液裂解,4 °C,12000 xg离心10 min后,收集细胞,使用BCA试剂盒测定蛋白浓度。 加入上样缓冲液,放入100 ℃水浴中煮沸5 min,使蛋白变性。进行上样,电泳,转膜,封闭,一抗孵育过夜,TBST缓冲液洗涤3次,每次5 min;然后与二抗室温孵育,再用TBST洗涤3次。最后用ECL发光液进行曝光。
1.8构建Drp1慢病毒低表达载体(Drp1-siRNA)先将H9c2细胞接种于6孔板中,然后分别加入Drp1慢病毒低表达载体(Drp1-siRNA)及空载体病毒(scramble)。转染72 h后,于荧光显微镜下观察到90%以上的细胞表达绿色荧光蛋白(Green Fluorescent Protein,GFP),证明细胞感染成功;收集Drp1-siRNA和scramble分别转染的心肌细胞,通过Western blot检测目的基因Drp1表达变化,若显示Drp1呈极低表达,则表明转染成功。

2 结 果
2.1 比索洛尔对H9c2细胞存活的影响与对照组相比,缺氧/复氧组细胞存活率下降至59.34%±2.6%(P<0.05);但经比索洛尔处理后细胞存活率上升至83.25%±2.3%(P<0.05)。流式结果表明,与对照组凋亡率(7.1 %±1.4%)相比,缺氧/复氧组(27.5%±1.7%)明显升高(P<0.05);与缺氧/复氧组相比,缺氧/复氧+比索洛尔组的凋亡率为15.5%±1.5%(P<0.05),见图1。
2.2比索洛尔抑制线粒体裂变,增加线粒体自噬Western blot结果显示,与对照组相比,缺氧/复氧组p-Drp1水平升高(P<0.05),而LC3II/LC3I、Beclin1、Pink1和Parkin的表达降低(P<0.05)。与缺氧/复氧组相比,缺氧/复氧+比索洛尔组p-Drp1水平降低(P<0.05),而LC3II/LC3I、Beclin1、Pink1和Parkin的表达升高(P<0.05)。以上结果表明,比索洛尔可降低p-Drp1的表达,增加LC3II/LC3I、Beclin1、Pink1、Parkin的表达,见图2。
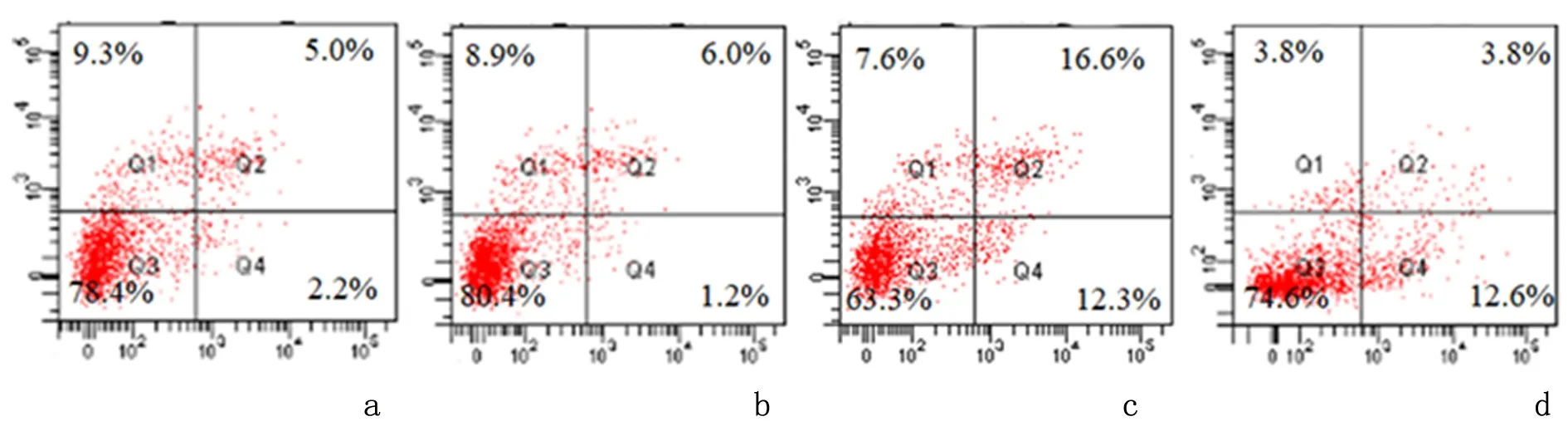
a:比索洛尔组;b:对照组;c:缺氧/复氧组;d:缺氧/复氧+比索洛尔组

1:比索洛尔组;2:对照组;3:缺氧/复氧组;4:缺氧/复氧+比索洛尔组
2.3下调Drp1对细胞活力和凋亡的影响通过Drp1慢病毒低表达载体感染H9c2细胞,结果发现,在缺氧/复氧诱导的H9c2细胞损伤中,与scramble相比,Drp1-siRNA处理后使H9c2细胞活力由60%提高至87%,差异有统计学意义(P<0.05);流式结果也表明,Drp1-siRNA处理后可明显抑制H9c2细胞的凋亡,见图3。以上结果表明,比索洛尔可能通过抑制线粒体Drp1的表达和活性来保护H9c2细胞免受H/ R诱导的损伤。
2.4Drp1敲低对LC3、Beclin1、Pink1、Parkin表达的影响与scramble相比,转染Drp1-siRNA的心肌细胞中Drp1的表达显著降低(P<0.05),表明Drp1-siRNA成功转染心肌细胞。在缺氧/复氧中,与scramble处理相比,Drp1-siRNA处理的细胞LC3II/LC3I比值以及Beclin1、Parkin和Pink1表达水平显著升高(P<0.05)。比索洛尔的使用进一步上调了这些自噬相关蛋白的表达,见图4。
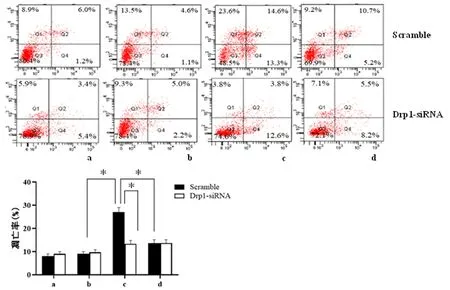
a:比索洛尔组;b:对照组;c:缺氧/复氧组;d:缺氧/复氧+比索洛尔组
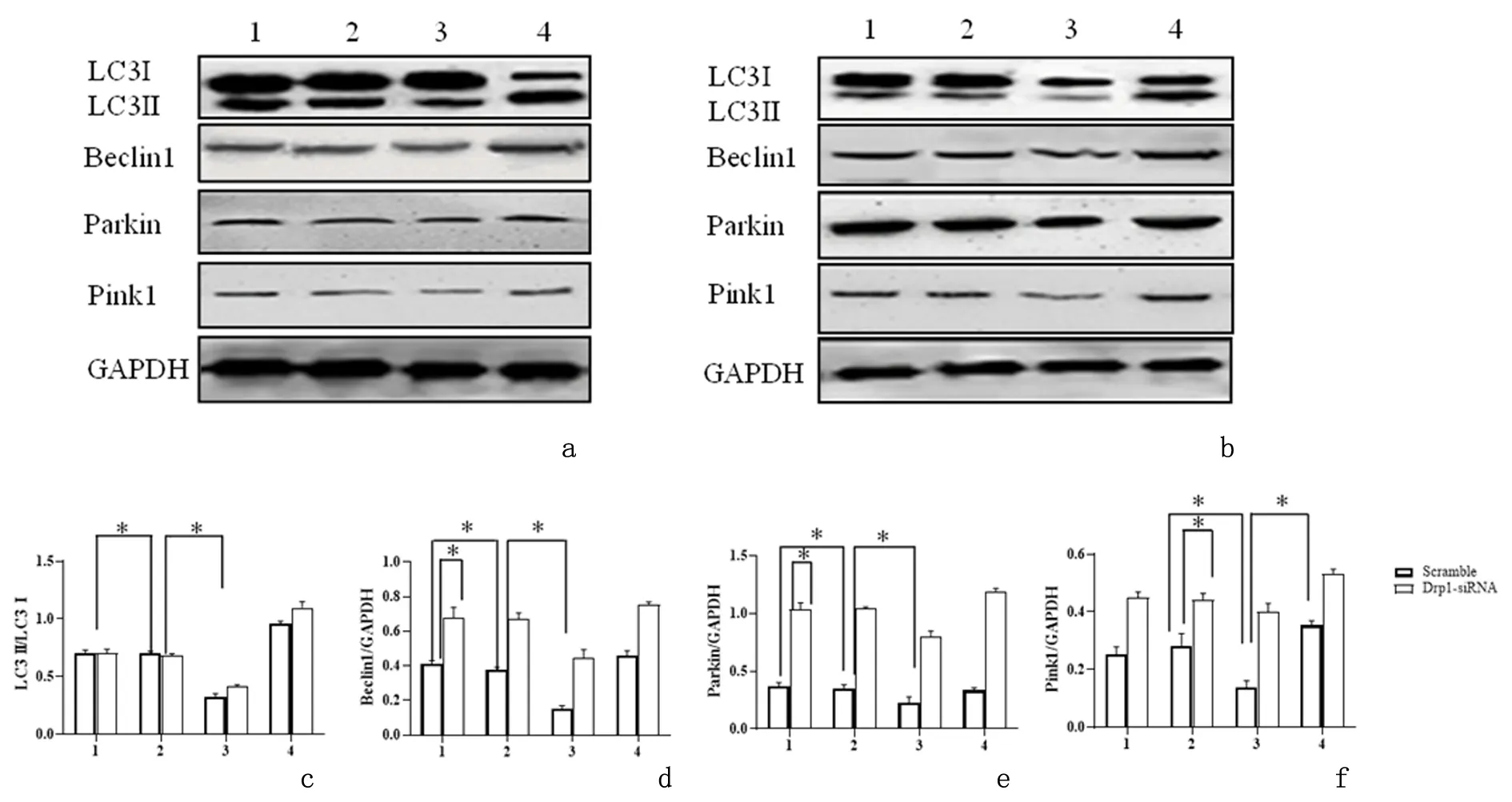
1:比索洛尔组;2:对照组;3:缺氧/复氧组;4:缺氧/复氧+比索洛尔组
3 讨 论
急性心肌梗死是现阶段发病率和死亡率最高的重大疾病之一,给医疗保健带来了沉重的负担,同时,也使得患者的生命健康难以得到保障。目前,临床上治疗该疾病最有效的方法是PCI或溶栓治疗。然而,这些治疗均可引起心肌缺血/再灌注(I/R)损伤[22]。本实验利用H9c2细胞缺氧/复氧模型,诱导心肌细胞凋亡,模拟机体心肌组织细胞I/R的病理生理本质。
近年来,越来越多的研究表明自噬在I/R损伤中扮演着十分重要的作用。有学者认为,在心肌缺血阶段,自噬的激活对心肌发挥着保护作用,再灌注阶段自噬被进一步激活,但其发挥的作用还有待研究[23-24]。因此,越来越多的学者对自噬在I/R损伤过程中的作用和机制进行了研究。
众所周知,线粒体参与多种关键的细胞过程,如细胞凋亡、钙稳态等[25]。在缺氧/复氧损伤条件下,线粒体裂变、融合和自噬对心肌细胞活性很重要[26-28]。Drp1 /Pink 1/Parkin介导的线粒体自噬是清除线粒体的途径之一,Pink1被认为是一种丝氨酸/苏氨酸激酶,可促进Parkin转运到线粒体,增加线粒体蛋白的泛素化。线粒体蛋白的泛素化导致泛素结合蛋白的招募,如p62/SQSTM[29],它介导受损线粒体进入自噬体。此外,Drp1易位也可介导线粒体异常裂变,继而引起线粒体自噬[30]。
本实验通过研究,我们发现比索洛尔在缺氧/复氧处理中增加了细胞活力,同时减少了细胞凋亡。我们还观察到缺氧/复氧处理的细胞表现出线粒体中Pink1和Parkin的水平降低,并伴有LC3-II/LC3-I的降低,这表明缺氧/复氧抑制了自噬相关通路,这与其他研究一致[31-33]。 比索洛尔显著提高缺氧/复氧处理的细胞中LC3II/LC3I比值和线粒体自噬相关蛋白Beclin1、Pink1、Parkin的表达。经siRNA干扰Drp1低表达后,与scramble处理相比,Drp1-siRNA处理的细胞自噬相关蛋白表达水平显著升高,比索洛尔的使用进一步上调了这些自噬相关蛋白的表达;但Drp1-siRNA组比索洛尔对I/ R诱导的细胞活性和细胞凋亡的保护作用并不明显,有可能与作用的时间和给药的剂量有一定的关联,其具体机制还有待进一步研究。
以上结果表明,比索洛尔可能通过Drp1/Parkin/Pink1通路激活线粒体自噬,减少心肌细胞凋亡,进而保护心肌细胞。这为临床上研究和治疗缺血再灌注损伤提供了理论依据。但本研究也存在一些不足需要改进,仅在细胞水平上对自噬在I/R损伤过程中的作用和机制进行了研究,而没有在动物和临床上进行深入研究,后期将进一步对其进行深入探索。
