4种蚯蚓肠道微生物对砷毒性的响应差异研究
2022-01-28王洪涛邵元虎张卫信傅声雷
王洪涛,丁 晶,邵元虎,张卫信,傅声雷,*
1 黄河中下游数字地理技术教育部重点实验室;河南大学地理与环境学院,开封 475004 2 烟台大学环境与材料工程学院,烟台 264005
土壤动物广泛分布在世界各地,是土壤生态系统的重要组成部分。它们参与了众多土壤生态过程,如土壤有机质分解及营养元素生物地球化学循环等,在土壤健康和生物多样性中发挥了关键作用[1—3]。其中蚯蚓是土壤中最大的无脊椎动物,被称为土壤的“生态系统工程师”和“基石物种”。蚯蚓不仅可以改善土壤结构和肥力,还可以影响土壤有机质分解和养分循环,并促进植物生长[4—5]。此外,越来越多的研究表明,大量微生物定植在蚯蚓肠道内,这些肠道菌群直接参与了碳氮元素代谢转化,在促进宿主健康方面也起着至关重要的作用[6—8]。然而,我们对土壤动物肠道微生物菌群的研究才刚刚开始,对于蚯蚓肠道菌群的组成多样性和生态功能的了解还很缺乏。
砷是环境中广泛存在的天然有毒类金属元素。由于矿山开采、金属冶炼等工业活动,以及畜粪、含砷农药等农业活动将大量砷排放入土壤中,从而引起土壤砷污染问题。当前土壤砷污染已引起全球公众的广泛关注[9]。土壤中的砷元素可对植物、动物产生不利影响,还可通过食物链在人体富集,对人类健康构成严重威胁。同时,砷在土壤环境中的行为归宿和生物毒性均与其化学形态有密切关系[10]。而环境中微生物在和砷的长期共存过程中,进化出多种砷代谢转化机制,能够调节砷的形态和迁移转化,在砷的地球化学循环中起到关键作用[11]。此外,进入农田土壤的污染物砷严重影响蚯蚓的生长和繁殖,砷对蚯蚓生态毒理危害的研究已引起了广泛关注[12—13]。微生物介导的砷转化影响着砷的生物毒性,对于砷的迁移转化过程具有重要作用。然而蚯蚓肠道内微生物介导下砷的生物转化过程还不清楚。因此,研究蚯蚓肠道微生物群落介导下的砷生物转化过程,对于了解蚯蚓肠道在砷的土壤地球化学循环中所起的作用具有重要意义。
蚯蚓种类丰富,目前发现已达6000多种。不同类型的蚯蚓拥有大量的生物多样性,共同维持着土壤生态系统的稳定[14]。根据蚯蚓的生活习性及生态功能间的差异,研究者将蚯蚓分为3种生态型种类,即表栖类,内栖类和深栖类[15]。不同种类的蚯蚓,它们的生理构造和代谢能力存在差异,而且这些差异有助于在蚯蚓生态群落中建立各自独特的细菌群落,维持着土壤动物的生物多样性。因此,我们推测不同蚯蚓肠道微生物也存在显著差异,且对砷毒性的响应机制也存在一定差异,肠道内的砷形态和生物转化关键基因也存在不同。Button等[16]发现砷污染土壤中,蚯蚓Lumbricusrubellus和Dendrodrillusrubidus组织和肠道内砷形态主要有三价砷(As(III)),五价砷(As(V))以及有机砷等多种形态。Wang等[17]研究了高浓度砷污染对单一蚯蚓Metaphiresieboldin肠道微生物的影响。然而该研究仅局限于单一生物物种,且砷浓度设置较高,与土壤环境中普遍存在砷浓度不相符合。因此, 开展广泛砷浓度条件下对不同蚯蚓肠道微生物影响的差异性研究, 对于完善砷在地下动物的生物化学循环多样性等方面的知识具有重要意义。因此,本研究设定了一个较低浓度砷的土壤环境,且选取土壤系统中常见的4种蚯蚓为目标物种,测定蚯蚓组织内砷的含量,肠道微生物与砷转化基因,并分析它们之间的联系。研究结果将有助于我们理解砷在地下土壤动物肠道内生物多样性的转化过程。
1 材料与方法
1.1 材料准备与实验设计
土壤采自浙江宁波某块废弃菜地,同时在该地附近农田采集蚯蚓。采集完成后,将土壤和蚯蚓一并运回实验室。野外采集土壤风干过筛后备用,蚯蚓则进行实验室内驯化及种类鉴定[17]。最后从中选取4种常见蚯蚓种类,分别是安德爱胜蚓(Eiseniaandrei),湖北远盲蚓(Amynthashupeiensis),加州腔蚓(Metaphirecalifornica)和通俗腔蚓(Metaphirevulgaris)。
称取过10目筛的风干土样加到聚乙烯塑料保鲜盒中,充分混匀,用超纯水配置As(V)母液(溶解固体含砷化合物Na3AsO4·12H2O),分别将对应浓度As(V)溶液,均匀加入到保鲜盒中,溶液充分淹没土壤并混匀,放在实验室老化半个月,从而得到一系列处理土壤样品。本次实验共设四个处理,即空白(砷的背景浓度为5 mg/kg)无蚯蚓,空白(砷的背景浓度为5 mg/kg)有蚯蚓,砷浓度分别为15 mg/kg和25 mg/kg的蚯蚓处理组,每个处理设置5个重复,其中空白无蚯蚓处理是为了探讨蚯蚓活动对土壤背景值下砷生物转化行为的影响。同时每个保鲜盒容器内放入10条大小和重量相似的同一种蚯蚓,即每个保险盒内一共40条蚯蚓。最后保鲜盒放入培养箱内(光照/黑暗循环时间各一半,相对湿度75%,温度20—22℃)培养28 d。实验期间,定期向土壤中加入无菌超纯水,保证土壤含水率保持在30%左右。
1.2 样品分析方法
1.2.1样品DNA提取
每份土壤样品充分混匀,装入无菌自封袋中,多余土壤样品风干测理化性质。用无菌镊子将蚯蚓从土壤样品取出,同时去除体表土壤残余物,并在无菌超纯水中漂洗五次,然后在无菌操作台上使用无菌镊子和无菌剪刀将蚯蚓解剖,取出其肠道内含物。提DNA的土样和蚯蚓肠道样品,均放在-20 ℃冰箱备用。测砷形态的土壤、肠道和蚯蚓组织样品,存于-80 ℃冰箱备用。本实验使用Fast DNA® Spin Kit for Soil(MP Biomedical, 美国)规格提取试剂盒提取土样和肠道样品DNA。使用紫外分光光度计 ND- 1000测定所提DNA浓度,最后将DNA样品储存于-20 ℃冰箱备用。
1.2.2细菌16S rRNA基因扩增,高通量测序和微生物群落生物分析
以提取DNA为模板,并对细菌16S rRNA基因的可变V4区进行扩增。上游引物为515F(5′-GTGCCAGCMGCCGCGGTAA- 3′),而下游引物为806R(5′-GGACTACHVGGGTWTCTAAT- 3′),其下游引物含有6 个碱基片段的barcode。PCR的扩增条件如下:95 ℃预变性2 min;然后30个循环扩增,每个循环含95 ℃变性20 s,55 ℃退火15 s,72 ℃延伸1 min;最终72 ℃延伸10 min。PCR产物经过纯化回收并混库后,送测序公司(诺禾致源,中国)进行Illumina测序。使用服务器QIIME 1对测序数据进行下游分析[18]。其中,原始序列需要进行分类,然后去除低质量或模糊序列,从而得到高品质目标序列。随后用Uclust聚类法(97%的相似度水平)将高质量序列进一步聚类为操作分类单元(Operational Taxonomic Units, OTUs)[19—20]。接着通过稀有化分析获得样品序列的多样性,其中通过不同测序深度下细菌群落多样性可得到每个样品内在多样性(即Alpha多样性,如Chao1指数和香农(Shannon)指数等),通过计算相同测序深度来比较不同样品间的多样性(即Beta多样性,如基于Bray-Curtis距离的主坐标分析)。
1.2.3高通量定量PCR
我们采用SmartChip Real-time PCR Systems(WaferGen,美国)高通量荧光定量系统对所有样品中砷生物转化基因进行定量测序。引物一共有80对,包含79对砷转化基因和16S rRNA gene,引物具体信息以及定量PCR体系温度时间条件设定参数参考Zhao等[21]的研究。根据砷转化基因的功能特征,将其分为四类,即五价砷还原(As(V) reduction),三价砷氧化(As(III) oxidation),砷(去)甲基化(As (de)methylation),和砷转运(As transport)。一个基因检测阈值(CT,31)被用来作为有效扩增基因的主要依据,同时每个样品包含3 个技术重复(三次技术重复都扩增出来时,才认定该样品检测出来)。此外,通过公式(1)计算每个样品的基因拷贝数, 当CT值超出31或为0时,认定该基因没有检测出来,其对应的CT值被替换为31。为降低样品间DNA提取效率差异,使用公式(2)将公式(1)转换为归一化的基因丰度,即每个细菌细胞基因的拷贝数,在这里计为其相对丰度。
(1)
Relative abundance=4.1× (Relative ABG Copy Number/Relative 16S rRNA Copy Number)
(2)
1.2.4样品理化分析
土壤pH值采用pH仪进行测定(水土比为2.5∶1),土壤TC和TN使用C/N 分析仪(Vario MAX C/N,德国)燃烧法进行测定,TOC分析仪(Vario TOC cube,德国)测定土壤总有机碳TOC。采用微波消解仪(CEM Microwave Technology Ltd., 英国) 进行土壤重金属预消解,具体消解体系及消解程序参照我们之前的方法[17]。土壤中As、Cd、Cr、Cu、Ni、Pb和Zn含量由电感耦合等离子体质谱(ICP-MS, Agilent 7500 ce, Agilent Technologies, 美国)测定。每批消解样品都有3个空白对照,以及两个样品技术平行,样品平行重复的相对偏差均在10%以内,其中使用标准物质黄棕壤GBW07403和扇贝GBW07403来进行校准验证,回收率均在91.1%—109.3%之间,达到要求。此外,土壤,蚯蚓肠道及组织样品砷形态的提取方法同样参照之前方法,后续使用高效液相色谱(HPLC, Agilent 1200, Agilent Technologies, 美国)和ICP-MS联用测定样品的砷形态[17]。
1.3 数据分析
本研究中均值,百分比,变异系数,标准差和热图等均采用Excel 2016(Microsoft,美国)完成。各个样品间显著性分析采用SPSS V18.0(IBM,美国),其中本文使用单因素方差分析(one-way analysis of variance,one-way ANOVA)比较数据在0.05水平上的显著性,显著性检验的方法用Tukey HSD进行检验包括数据前期正态分布检验。微生物数据分析主要基于R(version 3.4.3)软件绘制,如使用R vegan2.3- 1工具进行了主坐标分析,Adonis test算法检验不同样品间的微生物群落分布显著性。柱状图和箱线图等由Origin Pro8.5(OriginLab,美国)完成。
2 结果与分析
2.1 不同蚯蚓间体重,存活率,砷总量和形态的响应差异
经28天污染土壤暴露后,3个处理组间所有蚯蚓的体重(湿重)和数目(存活率)均无显著差异变化(ANOVA,P>0.05;表1),土壤中低浓度砷对蚯蚓存活数及生长影响不大。此外,这4种蚯蚓的体重之间存在较大差异,如通俗腔蚓的体重为4.67 g,是安德爱胜蚓体重的12.4倍(P<0.05)。
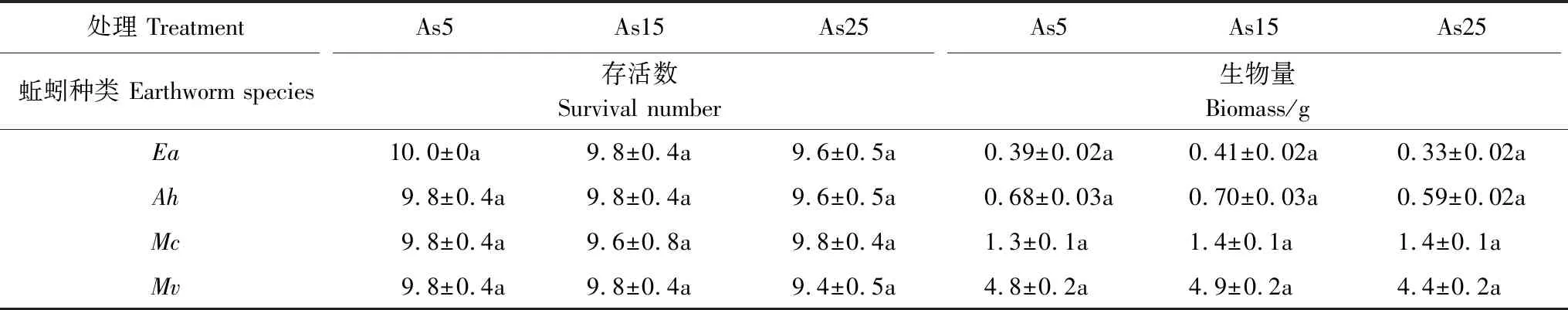
表1 蚯蚓体重和数量变化特征
数据以“均值±标准差”(n=5)表示;相同字母(a)表示不同处理间的数据不存在显著差异(在0.05水平上,ANOVA);As5:砷浓度为5 mg/kg的处理组 Treatment with arsenic concentration of 5 mg/kg;As15:砷浓度为15 mg/kg的处理组 Treatment with arsenic concentration of 15 mg/kg;As25:砷浓度为25 mg/kg的处理组 Treatment with arsenic concentration of 25 mg/kg;Ea:安德爱胜蚓Eiseniaandrei;Ah:湖北远盲蚓Amynthashupeiensis;Mc:加州腔蚓Metaphirecalifornica;Mv:通俗腔蚓Metaphirevulgaris
随着土壤中砷浓度的增加,所有蚯蚓肠道和组织中砷含量均呈现一个增加的趋势(P<0.05;图1)。如As5处理中安德爱胜蚓组织砷浓度为11.8 mg/kg,但在As25处理中其砷浓度富集至38.1 mg/kg。加州腔蚓肠道在As25处理中砷含量(28.9 mg/kg)是其As5处理中(7.01 mg/kg)的4.1倍。同时,不同蚯蚓在同一土壤处理组中的砷富集浓度存在较大差异。4种蚯蚓富集系数由高到低依次为:安德爱胜蚓(1.93)> 安德爱胜蚓(0.80)> 通俗腔蚓(0.78)> 湖北远盲蚓(0.52)。如处理As25中加州腔蚓组织砷含量为21.3 mg/kg,而相同处理下湖北远盲蚓砷浓度仅为10.8 mg/kg。从图1中,我们可以看到土壤中砷形态主要以As(V)为主,As(III)仅占17.0%。而在各个蚯蚓肠道或组织内,砷形态均以As(III)为主,占总砷含量高达80.7%。同时在安德爱胜蚓肠道组织中,检测到部分有机砷,主要以砷甜菜碱(Arsenobetaine, AsB)为主,占比11.7%。湖北远盲蚓仅组织内发现了部分有机砷AsB。
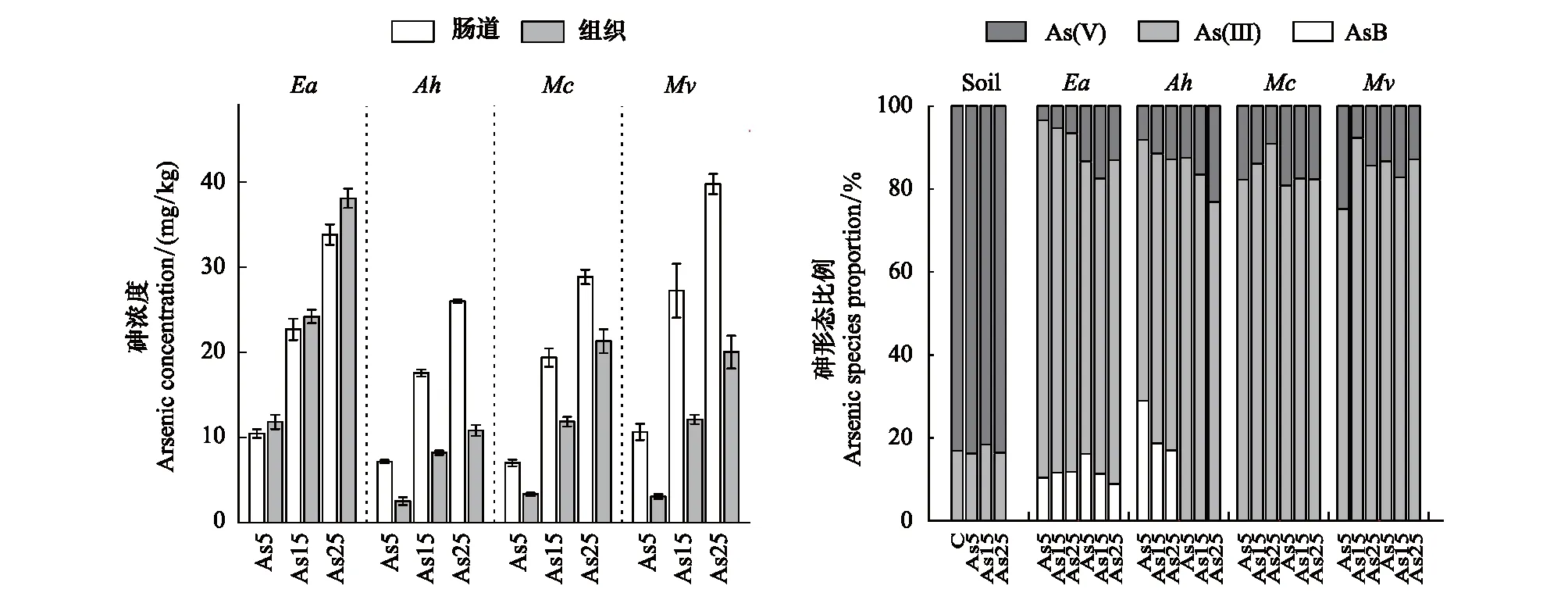
图1 蚯蚓组织和肠道内砷富集浓度和砷形态所占百分比Fig.1 Arsenic concentrations and proportion of arsenic species in the soil, earthworm body tissues and gut图中右侧C:对照无蚯蚓组;As(V):五价砷 Pentavalent arsenic;As(III):三价砷 Trivalent arsenic;AsB:砷甜菜碱 Arsenobetaine;数据以“均值±标准差”(n=5)表示;Ea:安德爱胜蚓 Eisenia andrei;Ah:湖北远盲蚓 Amynthas hupeiensis;Mc:加州腔蚓 Metaphire californica;Mv:通俗腔蚓 Metaphire vulgaris
2.2 土壤和各种蚯蚓肠道细菌群落结构差异
从基本理化性质来看,土壤和蚯蚓肠道之间存在较大差异(表2)。蚯蚓肠道pH值为6.74,较高于周围土壤的pH值(6.11)。蚯蚓肠道内总碳(125 mg/g)和总可溶性碳(56.2 mg/g)含量显著高于土壤中含量(分别为33.3 mg/g和0.48 mg/g,P<0.01)。此外,蚯蚓肠道内重金属镉(Cd)含量(2.73 mg/kg)显著高于土壤中镉含量(0.2 mg/kg,P<0.01)。
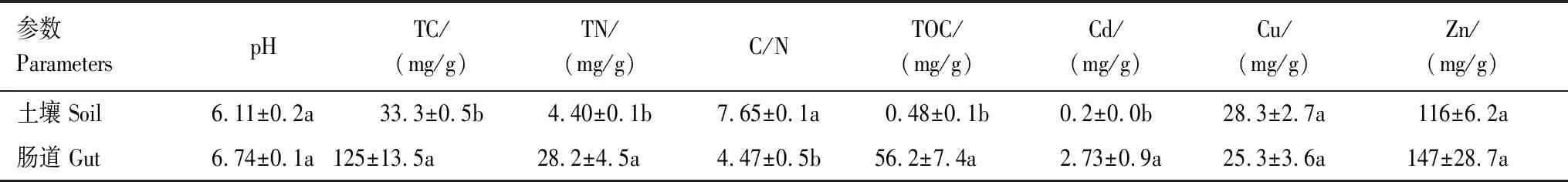
表2 本研究中土壤和蚯蚓肠道原位性质
所有样品经过微生物群落高通量测序和下游分析后,一共获得高质量9 903 591个高质量序列,这些序列根据97%的相似性原则进行OTUs聚类,共得到95 900个OTUs。其中土壤的OTUs数目(36 294)显著高于蚯蚓肠道OTUs数目(P<0.01)。同时,土壤和蚯蚓肠道细菌群落组成成分间存在差异。变形菌门(Proteobacteria),厚壁菌门(Firmicutes),绿弯菌门(Chloroflexi),放线菌门(Actinobacteria),和酸杆菌门(Acidobacteria)是土壤中的优势菌群,它们在总菌群中占据的比例高达73.4%。而各个蚯蚓肠道内的优势菌基本一致,主要是放线菌,厚壁菌和变形菌等,它们的相对丰度总和比例为76.6%(图2)。其中土壤酸杆菌门(9.3%)的丰度显著高于各个蚯蚓肠道内(0.7%)的丰度(P<0.01),而土壤放线菌门(11.0%)丰度显著低于各个蚯蚓肠道内(28.0%)的丰度(P<0.01)。
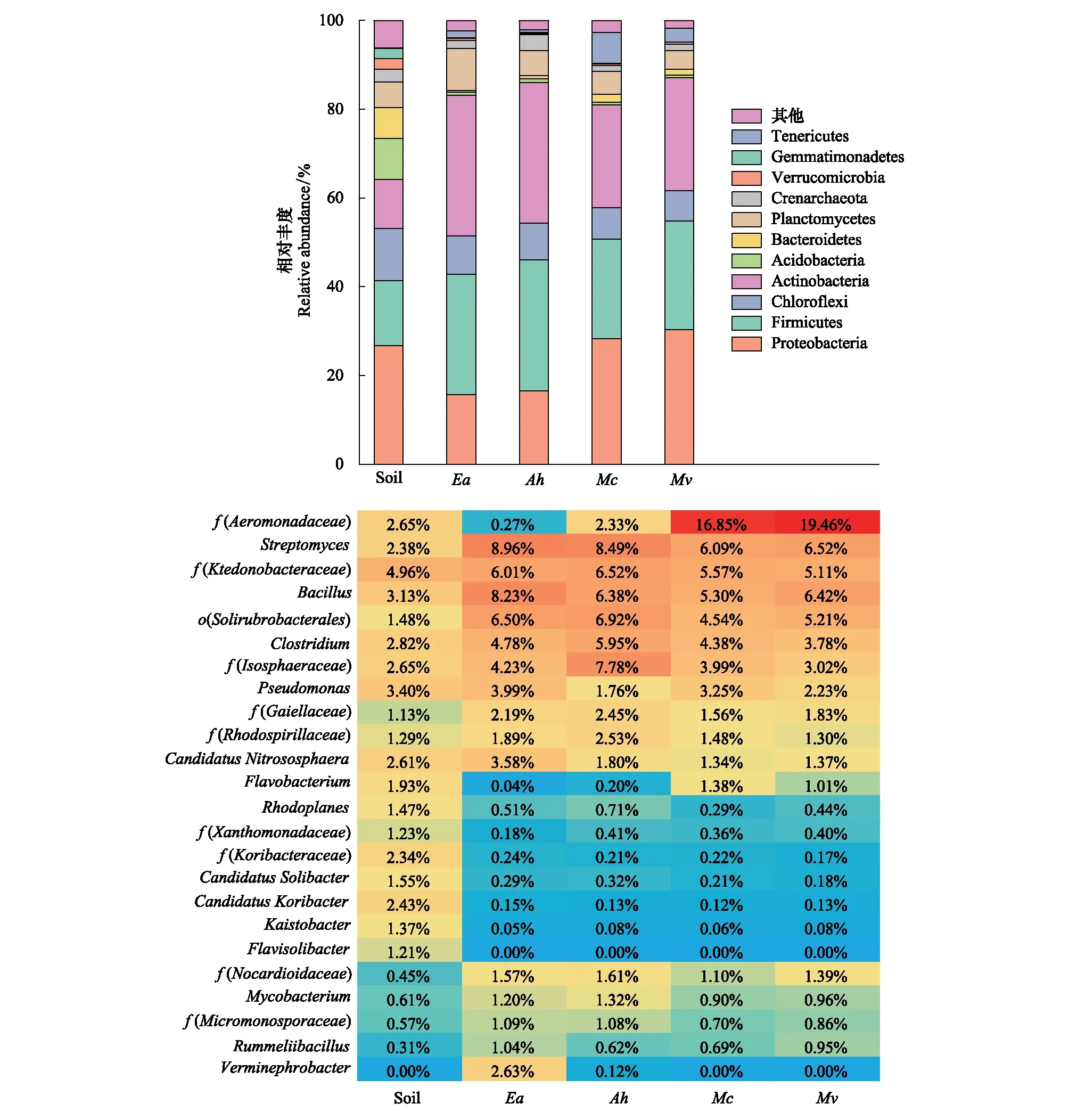
图2 土壤和蚯蚓肠道细菌群落在门和属水平上的物种组成和相对丰度Fig.2 Composition and abundance of bacterial community of soil and gut at the phylum and genus level图中仅显示了前11个高丰度的细菌组成,其他均归为“Other”类别;图例中文注释,变形菌门:Proteobacteria;厚壁菌门:Firmicutes;绿弯菌门:Chloroflexi;放线菌门:Actinobacteria;酸杆菌门:Acidobacteria;拟杆菌门:Bacteroidetes;浮霉菌门:Planctomycetes;泉古菌门:Crenarchaeota;疣微菌门:Verrucomicrobia;芽单胞菌门:Gemmatimonadetes;软壁菌门:Tenericutes。热图显示了丰度最高的前24种属水平上的物种组成。如属水平上物种不确定,则使用该水平上一级(科或目水平)的物种组成,颜色越红表示丰度越高,颜色越蓝表示丰度越低。图例中文注释,鲁梅尔芽胞杆菌属:Rummeliibacillus;微单孢菌科:Micromonosporaceae;分支杆菌属:Mycobacterium;类诺卡氏菌科:Nocardioidaceae;黄色土源菌:Flavisolibacter;凯氏杆菌属:Kaistobacter;科里氏菌科:Koribacteraceae;黄单胞菌科:Xanthomonadaceae;红游动菌属:Rhodoplanes;黄杆菌属:Flavobacterium;红螺菌科:Rhodospirillaceae;假单胞菌属:Pseudomonas;伊索菌科:Isosphaeraceae;梭菌属:Clostridium;红杆菌目:Solirubrobacterales;芽孢杆菌属:Bacillus;纤线杆菌科:Ktedonobacteraceae;链霉菌属:Streptomyces;气单胞菌科:Aeromonadaceae
热图(图2)显示了土壤和各个蚯蚓肠道间在属水平上细菌群落组成差异。土壤各组成成分丰度变化不大,丰度最高细菌Ktedonobacteraceae所占序列也仅为5.0%,而肠道内微生物群落组成则较集中,如加州腔蚓和通俗腔蚓肠道内Aeromonadaceae丰度分别高达16.9%和19.5%。此外,土壤中CandidatusKoribacter的丰度为2.4%,远远高于其在蚯蚓肠道内的丰度(0.1%,P<0.05)。
除了微生物组成成分存在差异以外,土壤和各个蚯蚓肠道细菌群落分布模式也存在显著差异。图3中主坐标分析结果显示,土壤菌群模式聚集在一起,分布在坐标轴右侧,沿着第一轴与分布在左侧的各个蚯蚓肠道细菌群落模式显著隔开(Adonis test, R=0.94,P<0.005)。同时安德爱胜蚓和湖北远盲蚓肠道细菌群落聚集在左侧下方,而加州腔蚓和通俗腔蚓聚集在左侧上方,这两类肠道菌群主要沿第二轴显著分开(Adonis test,P=0.001)。此外,土壤细菌多样性显著高于各个蚯蚓肠道内多样性(P<0.01,图3)。其中Shannon指数表明加州腔蚓肠道细菌多样性显著低于安德爱胜蚓和湖北远盲蚓。
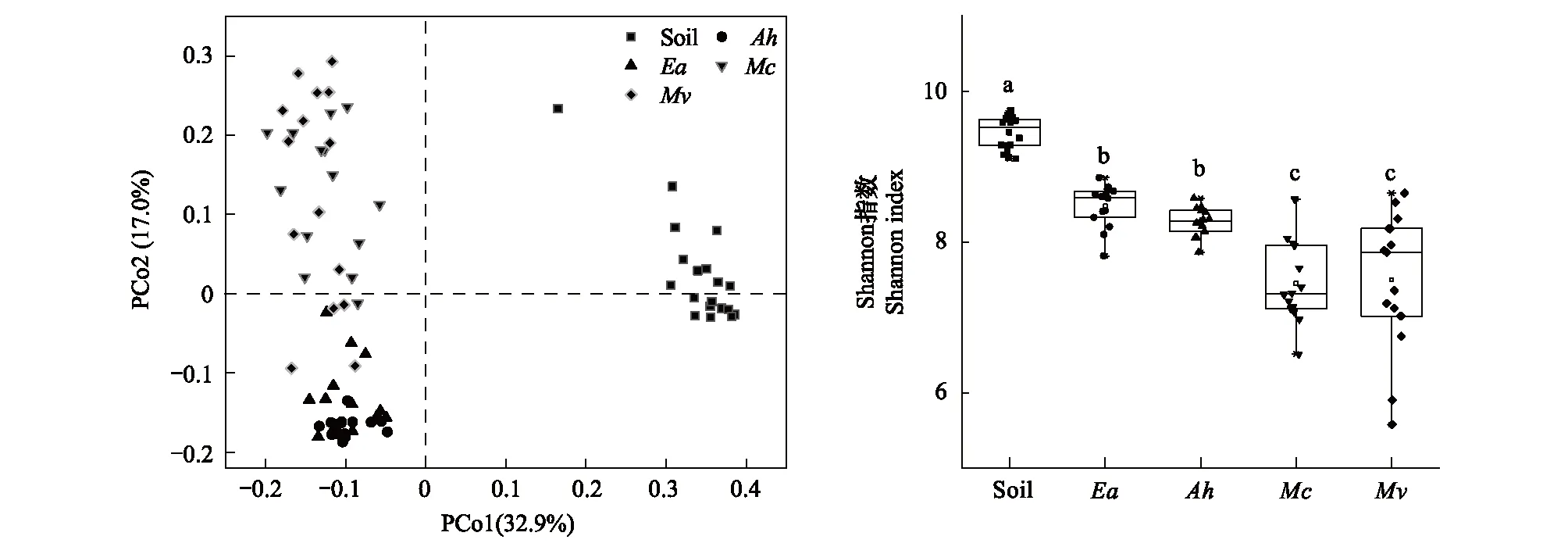
图3 土壤和蚯蚓肠道细菌群落beta多样性和alpha多样性Fig.3 Beta diversity and alpha diversity of bacterial communities in soil and earthworm gut图中土壤和蚯蚓肠道细菌群落beta多样性分布图是基于Bray-Curtis距离的主坐标分析绘制的;箱线图显示土壤和肠道细菌群落Shannon指数的差异。不同字母(abc)显示土壤和各个蚯蚓间的细菌多样性在0.05水平上存在显著差异(ANOVA)
2.3 各种蚯蚓肠道微生物对砷污染的不同响应
土壤中低浓度砷改变4种蚯蚓肠道内群落组成,且各种蚯蚓肠道微生物对砷响应存在较大差异。如对照组中安德爱胜蚓肠道变形菌门丰度为22.7%,而As25处理中其肠道内变形菌门的丰度下降到13.7%(P<0.05)。图4展示了4种蚯蚓肠道内科水平细菌群落主要组成成分的变化。所有蚯蚓肠道内假单胞菌科(Pseudomonadaceae)的丰度随着土壤砷浓度的增加而显著减少(P<0.05),芽胞杆菌科(Bacillaceae),动性球菌科(Planococcaceae)在湖北远盲蚓,安德爱胜蚓和加州腔蚓肠道内呈现相反的趋势,即显著增加(P<0.05)。相对于其他3种蚯蚓,通俗腔蚓内细菌群落变化较少。此外,低浓度砷暴露还能改变肠道细菌群落多样性。如As25处理组湖北远盲蚓肠道内细菌多样性Chao1指数显著高于对照处理组,而As25处理组通俗腔蚓肠道内细菌多样性Chao1指数显著低于对照处理组(P<0.05)。通过Adonis test统计分析,发现低浓度砷显著改变4种蚯蚓肠道微生物结构模式(P<0.05,图3)。

图4 各个蚯蚓肠道内砷处理下科水平细菌的差异性变化Fig.4 Different changes of bacterial families among arsenic treatments in different earthworm gutBacillaceae:芽胞杆菌科;Streptomycetaceae:链霉菌科;Planococcaceae:动性球菌科;Pseudomonadaceae:假单胞菌科;图中不同字母表示肠道细菌群落多样性在3个处理间存在显著差异(在0.05水平上,ANOVA)
2.4 砷生物转化基因多样性与丰度分布特征
土壤和蚯蚓肠道样品内一共检测到17种砷的生物转化基因(图5),并且土壤中的砷转化基因数目显著高于肠道内基因数目(P<0.05)。其中土壤中检测到的砷转化基因数目最多为17个,在湖北远盲蚓肠道内检测到的基因数目最少为7个。外源砷的添加没有显著改变土壤或肠道内砷转化基因的数量(P>0.05)。此外样品中砷转化基因相对丰度的检测范围为0.56—0.63 拷贝数/每细胞,外源砷的添加也没有明显改变土壤中砷转化基因的丰度,但蚯蚓肠道内基因的丰度变化范围较大,最低为0.05 拷贝数/每细胞(As25处理-湖北远盲蚓肠道内),最高丰度则达到0.47 拷贝数/每细胞(As15处理-通俗腔蚓肠道内)。土壤中砷转化基因的丰度显著高于各个蚯蚓肠道(P<0.05,图5)。4种蚯蚓肠道内砷基因随着外源砷的增加,其丰度均呈现一个先增加后减少的趋势。如空白处理下湖北远盲蚓肠道内砷丰度为0.11 拷贝数/每细胞,As15处理下其丰度增加到0.13 拷贝数/每细胞,最后在As25处理中丰度显著下降到0.05 拷贝数/每细胞(P<0.05)。根据砷生物转化基因的功能分类,土壤中砷转化基因主要以As(III)氧化和As(V)还原为主,而在肠道内主要以As(V)还原和砷转运基因为主(图5)。
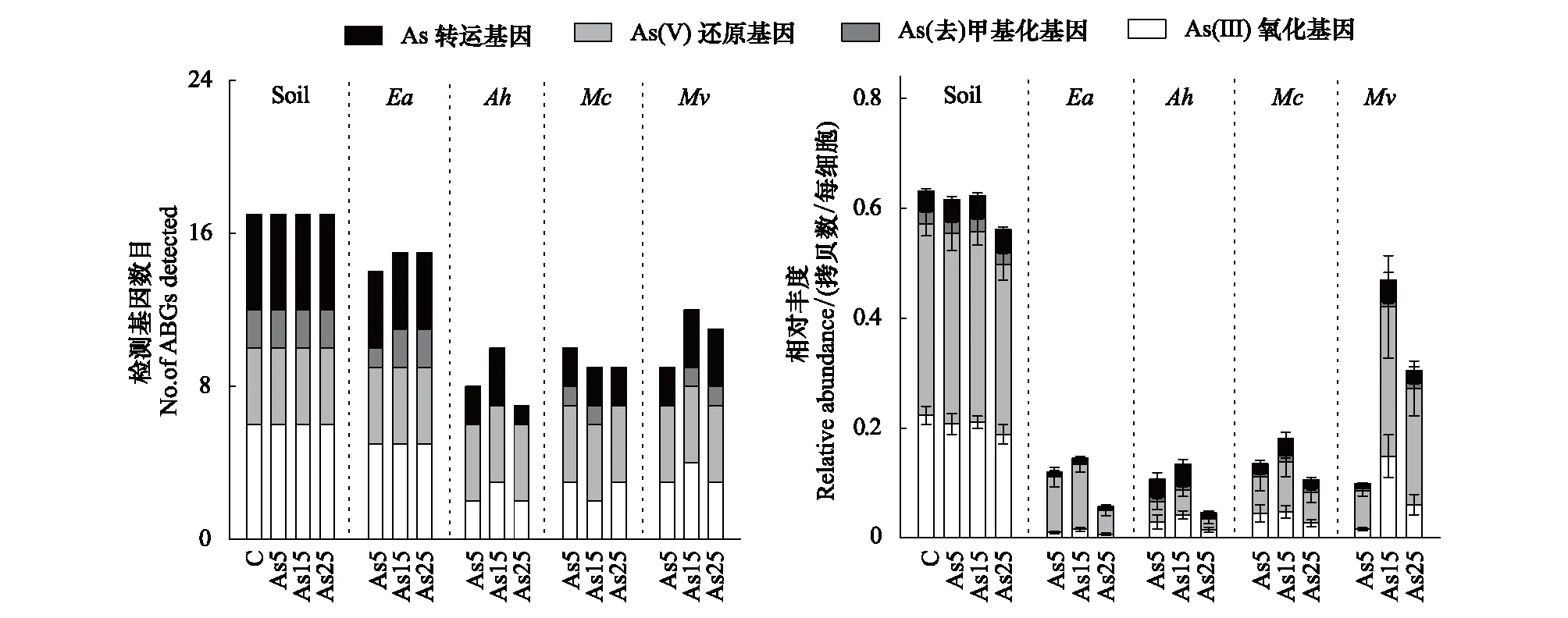
图5 土壤和蚯蚓肠道内砷转化基因的检测数目和相对丰度Fig.5 The detected number and relative abundance of arsenic biotransformation genes (ABGs) in microbiome of soil and earthworm gutAs (III) oxidation:三价砷氧化基因;As (V) reduction:五价砷还原基因;As (de)methylation:砷(去)甲基化基因;As Transport:砷转运基因;图中数据为平均值±标准差(n=5)
3 讨论
本研究发现低浓度砷对蚯蚓体重和生长变化无显著影响,但能显著改变蚯蚓肠道微生物群落。土壤砷浓度最高仅为25 mg/kg,明显低于很多研究报道的蚯蚓半致死浓度[22—23]。同时rut等[24]发现微生物对污染物响应较敏感,蚯蚓肠道微生物可用来作为重金属污染的生物指示物。因此我们可以推测蚯蚓肠道微生物群落的扰动可作为对土壤污染物前期监测的重要生物指标。同时4种蚯蚓组织内砷浓度会随着土壤中砷浓度的增加而增加,即砷污染会引起蚯蚓体内砷的生物富集。这是容易理解的,蚯蚓长期生活在土壤圈内,砷元素可通过皮肤接触或蚯蚓摄食行为,进入蚯蚓体内从而不断富集[25]。但不同种类蚯蚓的富集系数存在较大差异,这与各种蚯蚓的生态习性有很大联系[26]。其中安德爱胜蚓属表栖类,主要以枯枝碎屑为食。而其它种蚯蚓属内栖类,主要以矿质土壤为食。食物来源不同,其进入各种蚯蚓体内的砷含量自然存在较大差异。此外,这也和蚯蚓自身生理结构和肠道微生物也有一点关系[8]。如加州腔蚓和通俗腔蚓属同种生态型和同种分属,且它们个体大小,肠道构造和肠道微生物群落组成最为相似,因此这两种蚯蚓砷富集系数也基本相同。
本研究表明土壤中砷形态以As(V)为主,而蚯蚓肠道主要以As(III)为主。土壤为好氧条件,其氧化还原电位为正。而蚯蚓肠道是一个厌氧环境,包括厌氧菌在内的大量微生物参与了砷的生物化学形态转化,As(V)将被还原为As(III),当然肠道内高有机质和中性pH等独特微环境可能也是引起砷形态转化的重要因素[6—7,17]。此外,各种蚯蚓肠道内砷转化基因以As(V)还原基因为主,这与肠道内砷形态结果相一致。As(V)被还原为As(III)是微生物代谢最为关键的一个过程,As(III)将进行甲基化反应生成甲基砷等低毒有机砷,这些毒性较小的砷形态经砷转运基因外排出体外,从而达到解毒目的[16—17,27]。我们在蚯蚓肠道微生物内均检测到砷甲基化的关键转化酶AsM和部分有机砷 AsB,这和大部分研究结果一致[16,27],也验证了关于蚯蚓肠道内微生物参与下砷形态转化的猜想。同时,4种蚯蚓体内砷转化基因丰度会随着土壤中砷浓度增加,呈现出一个先增加后减少的趋势。研究表明土壤中金属浓度较低时能刺激微生物的生长,增加微生物活性。但当金属浓度升高时,会出现明显抑制效应,使微生物生物量出现一个减少趋势[28]。据此推测,低浓度砷可以刺激并提高肠道内微生物的活性,而较高浓度砷则抑制其肠道内微生物的活性,从而影响肠道内生物代谢速率,进而间接影响到微生物介导下的砷生物转化基因的丰度。
本研究结果进一步显示4种蚯蚓肠道微生物均与土壤微生物群落存在显著差异,这与土壤和肠道所处微环境有直接关系[7,17,29—30]。从表2看出蚯蚓肠道缺氧,pH偏中性,可溶性碳氮含量远高于好氧的土壤。同时各种蚯蚓肠道微生物群落间也存在很大差异。可能原因主要有两个,第一不同生态型的蚯蚓自身生理构造存在差异,特别是肠道内的结构存在不同。当然各个蚯蚓摄食习惯的不同也会引起肠道菌群的差异。Knapp等[31]发现蚯蚓肠道微生物组对所摄取的食物来源有很强的依赖性。加州腔蚓和通俗腔蚓肠道内气单胞菌科(Aeromonadaceae)的相对丰度高达16%,而在安德爱胜蚓肠道内仅为0.3%。该菌在水体和淤泥中被大量发现,是动物体内常见的致病菌[32—33]。加州腔蚓和通俗腔蚓可能吞食大量含砷土壤,且长期生活在土壤内部,可能会接触较多的致病菌,从而引发蚯蚓肠道微生物出现紊乱。而安德爱胜蚓主要生活在土壤表层,主要以富含有机质枯枝落叶为食。第二,进入蚯蚓肠道内的砷以毒性更高的As(III)存在,同时蚯蚓肠道细菌群落较土壤菌群敏感,因此进入蚯蚓组织肠道内砷对肠道菌群产生不同差异毒害。如假单胞菌科(Pseudomonadaceae)内很多细菌具有分解营养元素的能力[34]。和空白处理组相比,As25处理中4种蚯蚓肠道内假单胞菌科的丰度均显著降低,这表明污染物砷的添加能够破坏蚯蚓肠道微生物分解蛋白质和脂肪的能力,从而抑制蚯蚓正常代谢。
4 结论
土壤中广泛存在的砷元素对蚯蚓生态毒理无显著影响,但显著改变其肠道微生物群落结构,这表明蚯蚓肠道微生物组的变化可能比蚯蚓毒理指标更适合做土壤污染的指示性指标。同时蚯蚓肠道菌群和土壤群落显著不同,且蚯蚓肠道细菌多样性显著低于土壤。蚯蚓组织和肠道内砷形态主要以As(III)为主,其次是少量As(V)和有机砷,这和肠道内As(V)还原和转运为主的砷转化基因分布特征一致,显示蚯蚓肠道是一个微生物介导下砷形态转化多样性的潜在热区。然而本文关于蚯蚓肠道内砷还原和转运解毒的机制和原理尚不清楚,有待深入发掘。
