芡实分区刈割试验对陈瑶湖后生浮游动物群落结构的影响
2022-01-28刘振中赵文倩郭文莉周忠泽
刘振中,赵文倩,郭文莉,周忠泽
安徽大学资源与环境工作学院,合肥 230601
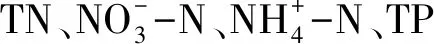
一些研究表明,在浅水湖泊中水生植被与浮游动物丰度和多样性存在显著正相关,因为水生植被能够为后生浮游动物提供避难所以及更加复杂多样的生态位[2—3]。后生浮游动物是水生生态系统的初级消费者,因其具有体型小、数量多、代谢能力强等特点而成为水生态系统中独特的生命形式之一[4],同时后生浮游动物对水环境变化反应灵敏,也是水环境变化的重要指示生物[5]。为探讨刈割试验对后生浮游动物的影响,本研究调查了陈瑶湖刈割期间与刈割结束两个时期三种不同区域下的后生浮游动物群落结构和水质状况,分析环境因子与后生浮游动物群落结构间的关系,确定影响后生浮游动物群落结构的主要因素,以期为陈瑶湖水环境保护及生态恢复提供一定的科学依据。
1 材料与方法
1.1 采样点及采样时间
陈瑶湖位于长江中下游北岸,地处北纬30°51′59″—30°55′49″,东经117°37′50″— 117°42′36″之间。本研究根据陈瑶湖整体水域分布及刈割分区试验情况,共设置3个采样点,分别为刈割区、未刈割区以及河道。其中刈割区为宽20 m的刈割通道;2个刈割通道间之间为宽约200 m的未刈割区,是以芡实为主的水生植被覆盖区;河道水面以莲为优势种,伴生种有野菱、黑藻等水生植物,水生植被盖度约60%,为不受刈割试验影响区域(图1)。采样时间为2019年8月5日、12日、17日以及26日,每次采样间隔一星期,并根据采样时间将刈割区分为刈割初期、前期、中期以及后期4个阶段;其中初期和前期为刈割期间,中期和后期为刈割结束时期。

图1 采样点分布Fig.1 Distribution of sampling points
1.2 样品采集和处理
后生浮游动物的采集包括轮虫、枝角类和桡足类,样品的采集分为定性和定量,轮虫的定性样品用25#(孔径=64 μm)浮游生物网在表层水体呈“∞”字形拖曳3—5 min,并过滤浓缩至50 mL定量瓶中,再现场加入1 mL鲁哥试剂固定。定量样品用1 L样品瓶采集,现场加入l0 mL鲁哥试剂固定,然后带回实验室沉淀浓缩定容至30 mL。甲壳类浮游动物定性样品用13#(孔径=112 μm)浮游生物网在表层水体呈“∞”字形拖曳3—5 min, 然后将样品滤缩至50 mL定量瓶中,现场加入4%甲醛l mL固定。定量样品用有机玻璃采水器采集水样10 L,通过25#浮游生物网过滤,浓缩至50 mL定量瓶中,再现场加入4%甲醛1 mL固定并加以标注[6].轮虫生物量采用体积法计算浮游甲壳类动物生物量采用体长-体质量回归方程计算。浮游动物种类鉴定主要依据伍焯田[7]、沈嘉瑞[8]等人的分类系统进行种类鉴定。
用有机玻璃采水器自湖底向湖面采集混合水样,并使用便携式多参数水质分析仪现场测定指标包括浊度(Turb)、水温、电导率(EC)、酸碱度(pH)、溶解氧(DO)、水深和透明度.实验室测定指标主要有叶绿素a(Chl. a)、总氮(TN)和总磷(TP)等。用丙酮萃取分光光度法测定叶绿素a[9];总氮用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012)[10]:总磷用钼锑氨分光光度法(GB 11893—1989)[11]。
1.3 数据处理
采用Margalef物种丰富度指数(D)、Pielou 均匀度指数(J) 、Shannon-Wiener生物多样性指数(H′)来分析浮游动物多样性结构特征[12—13],以H′指数评价水体污染状况标准:0≤H′≤1,重污染;1
D=(S-1)/log2N
(1)
(2)
J=H′/log2S
(3)
浮游动物优势度计算公式为:
Y=ni/N×fi
(4)
式中,S为总种类数,N为该水域出现的所有浮游动物种类的总个体数;ni为第i种的个体数;为该种在各样点出现的频率;Y≥0.02时,表明该浮游动物为优势种[12]。
水体营养状态参数的计算采用均值、标准差的方法,选取SD、TN、TP和Chl. a 4个指标,用综合营养状态参数进行评价:TLI(∑)<30,贫营养;30≤TLI(∑)≤50,中营养;50
(5)
(6)
式中,TLI(∑)表示综合营养状态参数;Wj为第j种参数的营养状态参数的相关权重;rij为第j种参数与基准参数;m为评价参数的个数;TLI(j)为代表第j种参数的营养状态参数,分别由以下公式计算:
TLI(chl. a)=10(2.5+1.086lnchl. a)
(7)
TLI(TP)=10(9.436+1.624lnTP)
(8)
TLI(TN)=10(5.453+1.694lnTN)
(9)
TLI(SD)=10(5.118-1.94lnSD)
(10)
式中,Chl. a为叶绿素a浓度(μg/L),TP为水中总磷浓度(mg/L),TN 为水中总氮浓度(mg/L),SD为湖水透明度(m)。
采样点的分布图采用ArcGIS 10.2 软件绘制,采用SPSS 19.0软件进行浮游动物种数、密度、生物量与环境因子的Pearson相关性分析,用Canoco 4.5软件对后生浮游动物优势种密度数据进行去趋势分析(DCA),得出第一轴长度小于3(2.64),因此选择RDA分析,并通过蒙特卡罗置换检验对环境因子进行筛选,绘制环境因子与优势种的关系图。
2 结果
2.1 调查期间水质特征
调查期间DO、Turb、TP在时空上均有显著差异(P<0.05),其中DO在空间上波动较大(P<0.01),变化范围在0.86—4.06之间。温度、pH以及WD在时空上均无显著差异(P>0.05),其它水环境因子仅在空间上有显著变化(P<0.05),时间上无显著变化(P>0.05),总体水质由好到坏空间上呈现河道>未刈割区>刈割区的分布特征,时间上总体呈现刈割初期>前期>中期>后期的变化趋势(表1)。TLI均值为62.54±2.31,属于中度富营养水体。

表1 水环境因子时空变化及相关性分析
2.2 后生浮游动物种类组成
调查期间共鉴定出后生浮游动物22属40种,其中轮虫12属26种,枝角类8属11种,桡足类2属3种,群落结构以轮虫为主。其中刈割区共鉴定出后生浮游动物26种;未刈割区9种;河道31种。
2.3 后生浮游动物的优势种
根据物种优势度Y≥0.02的判别,调查期间共鉴定出后生浮游动物优势种类群8属10种,分别为轮虫的萼花臂尾轮虫(Brachionuscalyciflorus)、角突臂尾轮虫(B.angularis)、剪形臂尾轮虫(B.forficula)、螺形龟甲轮虫(Keratellacochlearis)、囊形单趾轮虫(Monostylabulla)、蹄形腔轮虫(Lecaneungulata)、针簇多肢轮虫(Polyarthratrigla)、迈氏三肢轮虫(Filiniamaior);枝角类的长额象鼻溞(Bosminalongirostris)以及桡足类的广布中剑水蚤(Mesocyclopsleuckarti)。对未刈割区、刈割区、河道3个区域以及刈割初期、前期、中期以及后期4个阶段后生浮游动物优势种类群进行分析,结果表明空间上针簇多肢轮虫为3个区域共有优势种;剪形臂尾轮虫和广布中剑水蚤仅在未刈割区占优;囊形单趾轮虫仅在河道占优。 时间上剪形臂尾轮虫与广布中剑水蚤仅在初期占优;螺形龟甲轮虫仅在后期占优,其它优势种在时间分布上均无差异(表2)。
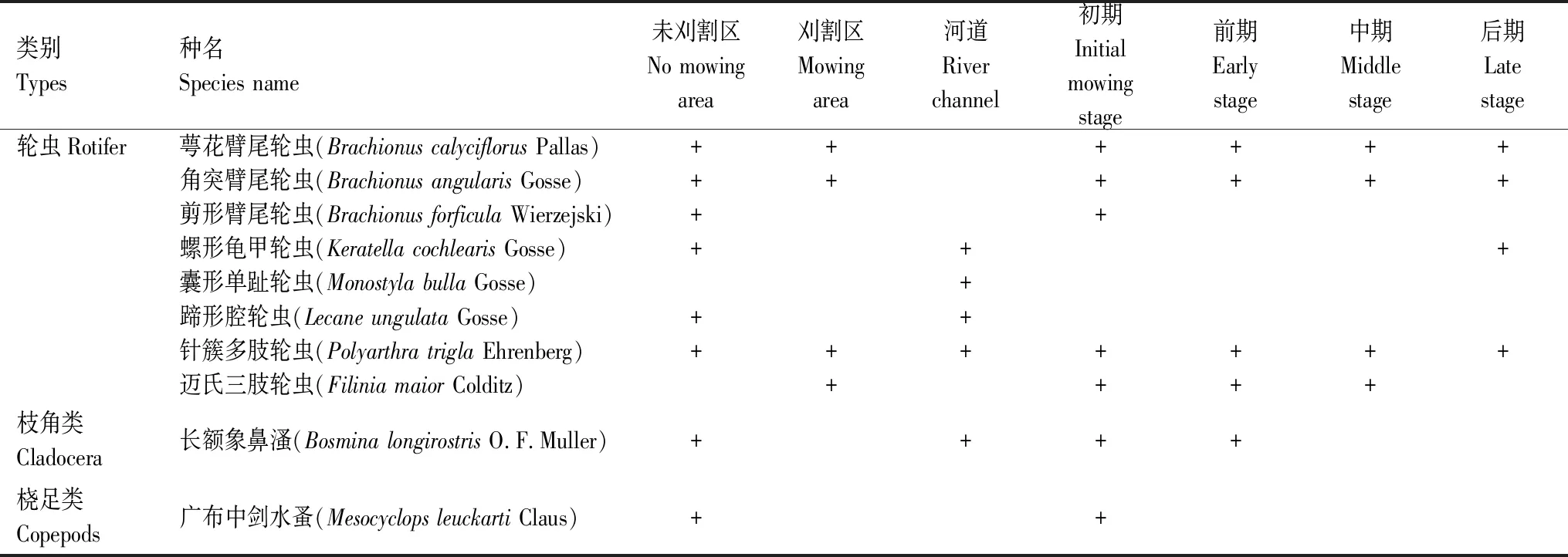
表2 后生浮游动物优势种时空变化
2.4 后生浮游动物密度和生物量
2.4.1时间变化
调查期间后生浮游动物时间上平均密度为(1686.18±231.09)个/L,其中轮虫平均密度最高,为(1414.57±191.31)个/L,占总密度的83.89%,桡足类密度最低,为(72.65±10.34)个/L,仅占总密度的4.31%(图2);后生浮游动物时间上平均生物量为(7.67±1.14) mg/L,其中轮虫平均生物量最低,为(1.35±0.67) mg/L,占总生物量的17.60%,枝角类生物量最高,为(4.23±1.67)mg/L,占总生物量的55.15%(图2)。密度和生物量在时间上总体呈现初期>前期>中期>后期的变化趋势。
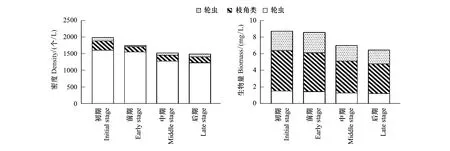
图2 后生浮游动物密度和生物量时间变化Fig.2 Temporal variation of density and biomass of metazooplankton
2.4.2空间变化
调查期间后生浮游动物空间上平均密度为(1676.77±225.74)个/L,其中轮虫平均密度最高,为(1401.86.57±164.33)个/L,占总密度的83.60%,桡足类密度最低,为(83.37±11.07)个/L,仅占总密度的4.97%(图3);后生浮游动物空间上平均生物量为(7.93±1.62) mg/L,其中轮虫平均生物量最低,为(1.32±0.57) mg/L,占总生物量的16.61%,枝角类生物量最高,为(4.53±1.49) mg/L,占总生物量的57.09%(图3)。后生浮游动物的密度和生物量具有显著的空间差异,整体呈未刈割区>刈割区>河道的分布特征。
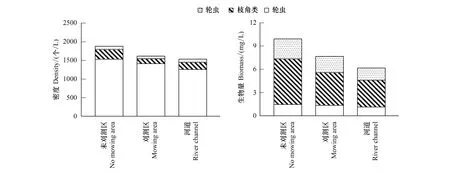
图3 后生浮游动物密度和生物量空间分布Fig.3 Spatial distribution of density and biomass of metazooplankton
2.5 后生浮游动物多样性指数
后生浮游动物D指数时间上分别为2(1.92—2.13),H′指数为1.87(1.58—2.07),J指数为0.66(0.57—0.69)(图4);空间上D指数为2.56(1.64—3.57),H′指数为2.45(1.67—3.42),J指数为0.73(0.41—1.13)(图4)。D、H′、J在时空上变化趋势基本保持一致,空间上呈现河道>未刈割区>刈割区的分布特征,时间上呈初期>前期>中期>后期的变化趋势。
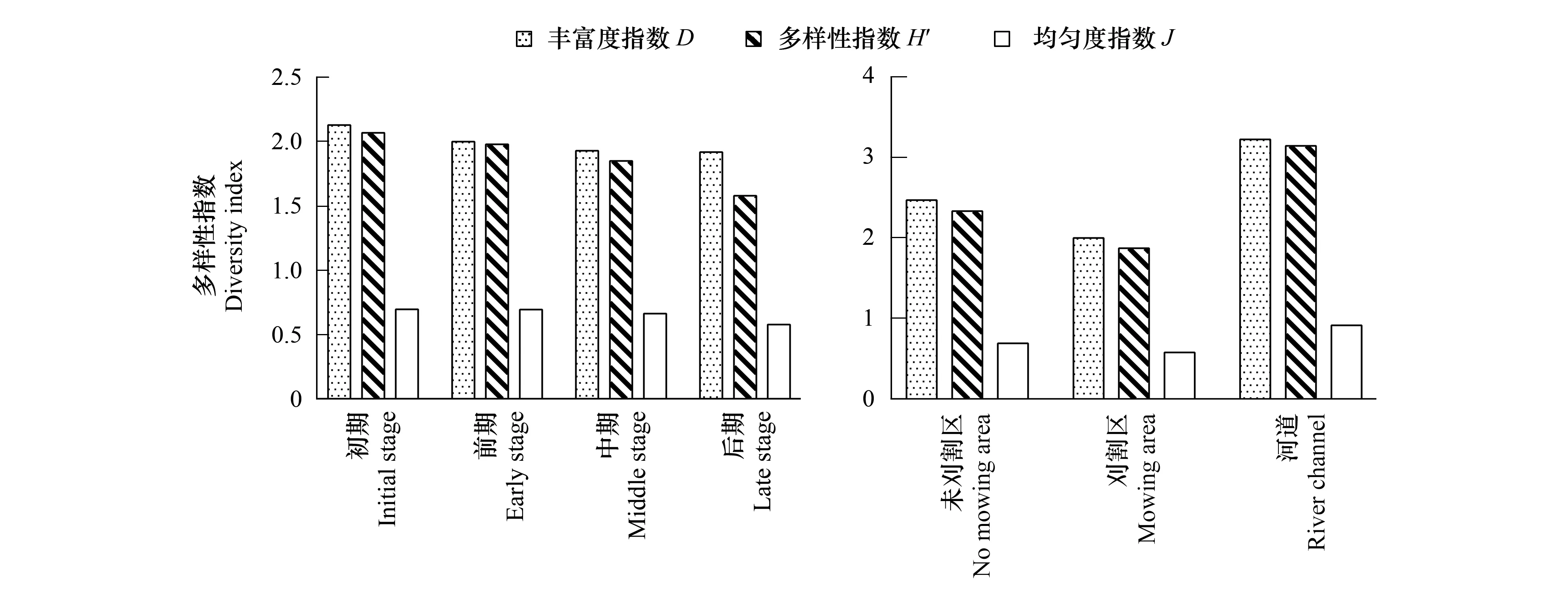
图4 后生浮游动物多样性指数时空变化Fig.4 Spatiotemporal variation of metazooplankton diversity indexD:丰富度指数 Margalef richness index; H′:多样性指数ShannonWiener diversity index;J:均匀度指数 Pielou evenness index
2.6 后生浮游动物与环境因子相关分析

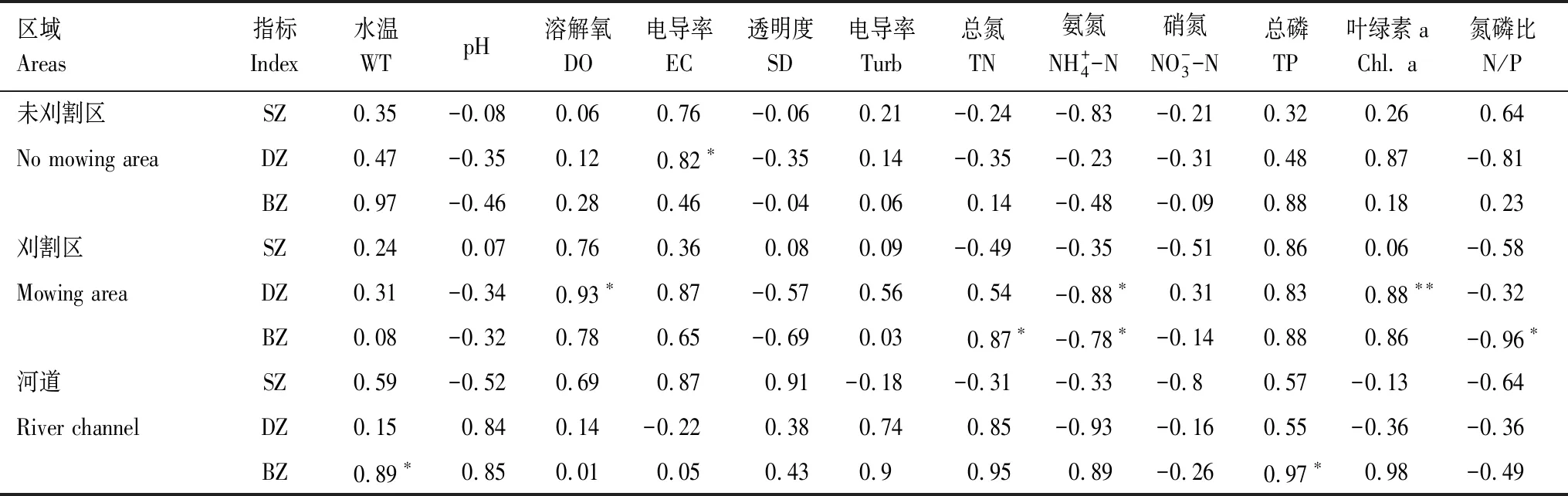
表3 后生浮游动物与环境因子相关性分析
2.7 后生浮游动物优势种密度与环境因子的RDA分析
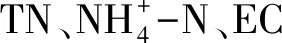
表4 后生浮游动物密度与环境因子的冗余分析

图5 后生浮游动物优势种密度与环境因子的RDA分析排序Fig.5 RDA analysis and ordination of dominant species density and environmental factors of metazooplanktonBc:萼花臂尾轮虫 Brachionus calyciflorus;Ba:角突臂尾轮虫 Brachionus angularis;Bf:剪形臂尾轮虫 Brachionus forficula;Kc:螺形龟甲轮虫 Keratella cochlearis;Mb:囊形单趾轮虫Monostyla bulla;Lu:蹄形腔轮虫 Lecane ungulata;Pt:针簇多肢轮虫 Polyarthra trigla;Fm:迈氏三肢轮虫 Filinia maior;Bl:长额象鼻溞 Bosmina longirostris;Ml:广布中剑水蚤 Mesocyclops leuckarti
3 讨论
3.1 水质总体评价
陈瑶湖地势低洼,周围由农田环绕,化肥、农药、除草剂等的使用,使得大量氮、磷随地表径流流入湖体,此外湖面种植芡实与水产养殖过程中过量施肥也是导致陈瑶湖富营养化的重要因素。根据湖泊富营养化分级标准[18],陈瑶湖总氮浓度均值在1.5 mg/L以上,总磷浓度均值在1 mg/L以上,TLI指数均值在60以上,说明其水体呈中度富营养状态。许多研究结果表明富营养化湖泊中浮游动物存在丰度大,优势种多为耐污种的特点[19—20],陈瑶湖优势种有萼花臂尾轮虫、角突臂尾轮虫、针簇多肢轮虫、长额象鼻溞等,均为富营养水体指示种。多样性指数的大小与水体污染程度呈负相关,多样性指数越大,则水质越好[21],参考通用标准对水质进行初步评价,D指数为2.62(1.64—3.57),表明水体处于中污染,H′指数为2.5(1.58—3.42),表明水体处于β-中污染,J指数为0.77(0.41—1.13),表明水体处于中污染.综合TLI指数、优势种特征及生物多样性指数,表明陈瑶湖水体已处于中度富营养状态,水质处于中污染状态.
3.2 浮游动物群落结构特征
本研究中共鉴定出轮虫12属26种,枝角类8属11种,桡足类2属3种,密度以轮虫占绝对优势,枝角类其次,桡足类最少;生物量以枝角类最高,桡足类其次,轮虫最少;优势种为萼花臂尾轮虫、角突臂尾轮虫、长额象鼻溞这类典型的污染指示种[22]。这一结论与其它富营养化较严重的湖泊相类似[23—24]。优势种时间上无显著变化,但在空间上有显著变化,这种变化的原因可能与不同区域的营养浓度有关,许多研究表明,营养浓度的变化是浮游动物群落结构空间变化的主要驱动因素[25],富营养化的水体中一般是耐污种类形成优势种群,本研究也出现类似结果,在营养程度较高的刈割区与未刈割区,萼花臂尾轮虫与角突臂尾轮虫这类耐污性较强的ɑ-中污染指示种占优,而营养程度相对较低的河道,螺形龟甲轮虫、针簇多肢轮虫以及迈氏三肢轮虫这类耐污性相对弱一点的β-中污染指示种占优。另外可能还与后生浮游动物本身的生长和繁殖特点有关,如萼花臂尾轮虫在生长过程中释放的一些化学物质能够提高自身与角突臂尾轮虫的种群增长率[26]。此外种间竞争[27]、捕食者选择性捕食[28]都是影响群落结构的重要因素。
后生浮游动物物种数空间上呈河道>未刈割区>刈割区的特征.在河道,以莲为优势种,伴生种有四角刻叶菱、黑藻等水生植物,水生植被盖度约60%,为不受刈割试验影响区域,河道水体的透明度最高(0.62±0.01) m,河道处水体的溶解氧最高(3.62±0.44) mg/L。据相关研究表明,水生植物在浅水型湖泊中能够帮助浮游动物维持一个较高的密度和生物量水平,因为水生植被具有改善水质和提供庇护场所的作用[29—30],此外水生植物与浮游动物多样性和丰度也有着显著正相关[31]。这些结论基本与陈瑶湖调查期间后生浮游动物群落结构空间变化趋势一致。 密度和生物量空间分布为未刈割区>刈割区.导致这种空间分布不均的原因可能是刈割期间芡实的打捞,使得附着在上面的浮游动物伴随着芡实被一并带走。芡实宽大的浮叶在拖动过程中会卷走表面水体中的部分浮游动物,这也加剧了刈割区浮游动物数量以及物种多样性的降低.浮游动物密度和生物量时间变化趋势为初期<前期<中期<后期,导致这种变化的原因除了上述芡实刈割的影响之外,可能还与浮游动物本身的生长繁殖特点有关;许多研究表明轮虫具有繁殖速度快、发育时间短、食物转化率高、怀卵量大等特点[32],并且刈割区高浓度的营养盐也十分适合小型浮游动物的生长繁殖[33]。
3.3 刈割试验对浮游动物的影响
分区刈割试验短期内对陈瑶湖不同区域内水环境因子的影响程度不一,从而导致各个区域内水环境因子与浮游动物之间呈现不同程度的相关性。其中刈割区浮游动物受环境因子的影响较大,氨氮、Chl. a、电导率、总氮、总磷和透明度对浮游动物的影响较显著,主要原因可能是因为刈割区受人为活动影响较大,环境因子短期内较大的变幅改变了浮游动物原来相对稳定的生活环境,进而对浮游动物群落结构产生一定的影响。Arauzo[34]的研究表明当水体中氨氮浓度升高时,浮游动物生物量会显著下降.本研究结果与其一致(图2),可能是因为短期内氨氮浓度的升高对一些浮游动物物种具有抑制作用,并影响它们的生长和繁殖[35—36]。Chl. a 是浮游植物进行光合作用的主要色素,反映水体中浮游植物现存量多少[37],电导率可以反映出水体中的离子浓度[38],氮磷含量也是影响浮游植物的重要因素[39],它们的变化都可以直接影响到浮游植物的现存量,并间接影响浮游动物。大量研究表明水体透明度对浮游动物有显著负相关,当透明度高时,浮游动物的被捕食率增加[40]。未刈割区除了电导率与浮游动物密度显著正相关外,河道除了温度与生物量呈显著正相关外,两个区域其余环境因子与浮游动物各指标之间无明显相关性。原因可能是因为刈割期间未刈割区与河道受人为活动影响小,各项水质指标变幅不大,因此浮游动物各指标变化幅度与环境因子的相关性较小。刈割期间, 由于刈割方法是距水面下方30 cm处割断芡实和莲的叶柄,并打捞上岸下部残留的的叶柄和跟会立即腐烂,将使刈割湖区的水体中的理化因素发生较大的变化,特别导致水体的溶解氧、透明度显著下降,会对浮游植物的生长与繁殖造成影响,进而间接影响浮游动物的群落结构。另外,浮游植物种类、现存量在刈割期间的减少也会影响浮游动物的数量变化,食植性浮游动物通过捕食作用浮游植物获取能量来源,浮游植物的减少导致其食物来源不足[41],而且大量泥沙发生裹挟的同时可能会裹挟沉淀游动在水体的浮游动物,对浮游动物生存造成较大影响。
刈割试验短期内对陈瑶湖水质并没有起到改善作用,而且在一定程度上破坏了原有相对稳定的浮游动物群落结构,但是芡实刈割避免了因芡实成熟腐烂后导致水质进一步恶化的结果,并且刈割芡实过程中会带走水中大量氮磷等营养物质,有利于陈瑶湖未来的生态修复。另外刈割芡实还能够为鱼类提供呼吸通道,保护了陈瑶湖的渔业资源,具有一定的生态和经济价值。
