小白菊内酯对葡萄膜黑色素瘤细胞MUM2B增殖、凋亡的影响
2022-01-27智炎伟
智炎伟
葡萄膜黑色素瘤(uveal melanoma,UM)是原发性眼内恶性肿瘤,易转移,预后差且易致死,目前生存率虽有一定改善但还很低[1]。寻找有效的治疗药物具有重要的临床意义。小白菊内酯(parthenolide,PTL)是从菊科植物中提取出来的倍半萜类化合物,具有抗肿瘤的生物活性,PTL可以抑制胰腺癌Panc-1细胞的增殖并促进其凋亡,同时也影响肿瘤细胞的迁移和侵袭能力[2]。研究发现PTL能显著抑制肾癌786-O细胞增殖,诱导786-O细胞发生凋亡[3];PTL通过阻滞G1期并调节线粒体途径抑制UM细胞增殖并诱导其凋亡[4]。但小白菊内酯是否通过核因子-κB(Nuclear factor κB,NF-κB)信号通路影响葡萄膜黑色素瘤细胞的发生发展还尚未清楚,本研究自2019年3―10月研究小白菊内酯是否通过NF-κB调控葡萄膜黑色素瘤细胞的增殖和凋亡。
1 材料与方法
1.1 材料葡萄膜黑色素瘤细胞MUM2B购自中国科学院上海细胞库;小白菊内酯(分子式C15H20O3,纯度>98%,货号X-028)购自成都瑞芬思生物科技有限公司;胎牛血清(货号12003C-500 mL)、RPMI-1640培养基(货号R1145-500 mL)、胰蛋白酶(货号T8802)购自美国Sigma公司;MTT试剂盒(货号C0009)、膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)和碘化丙锭(PI)试剂盒(货号C1065L)、BCA试剂盒(货号P0012S)、RIPA蛋白裂解液(货号P0013B)、SDS-PAGE试剂盒(货号P0012AC)购自上海碧云天生物技术有限公司;吡咯烷二硫代氨基甲酸酯(Pyrrolidine dithiocarbamate,PDTC)(货号5108-96-3)、佛波醇-12-豆蔻酸酯-13-乙酸酯(phorbol12-myristate-13-acetate,PMA)(货号 P1585)购自美国Sigma公司。Bcl-2相关X(Bax)(货号orb146710)、B细胞淋巴瘤-2(Bcl-2)(货号 orb99415)、IkBa(货号abx104016)、NF-κB(货号AOB1331a)一抗均购自上海煊翎生物科技有限公司;p-IkBa(货号bs-18129R-1)抗体购自上海恒斐生物科技有限公司;山羊抗兔IgG-辣根过氧化物酶(horseradish peroxidase,HRP)(货号ANR02-1)购自上海子起生物科技有限公司。
1.2 方法
1.2.1 细胞培养 葡萄膜黑色素瘤细胞MUM2B用含10%胎牛血清的RPMI-1640培养基于37℃、5%二氧化碳饱和湿度条件下培养,隔天换液一次,待细胞融合至70%左右时,加入胰蛋白酶进行消化传代,选取对数生长期的细胞进行实验。
1.2.2 细胞分组 取对数生长期细胞,将其接种至96孔板中,并用不同浓度的小白菊内酯(0、5、10、20 μg/mL)处理MUM2B细胞,记为0 μg/mL组、5 μg/mL组、10 μg/mL组、20 μg/mL组;用1 μmol/L的PMA作用于WM239细胞培养24 h,记为PMA组;用1 μmol/L的PMA作用于MUM2B细胞培养1 h后再加入10 μmol/L的PDTC培养24 h,记为PDTC组;未经任何处理的MUM2B细胞作对照组。10 μg/mL的小白菊内酯和1 μmol/L的PMA共同作用于MUM2B细胞,记为10 μg/mL+PMA组。
1.2.3 MTT检测细胞增殖 在以上各组细胞培养至24、48、72、96 h时分别加入20 μL(5 g/L)的MTT溶液,继续孵育4 h;弃去多余培养基并加入150 μL DMSO振荡反应10 min,酶标仪检测490 nm处吸光度(OD)值。细胞增殖活性(%)=实验组OD值/空白对照组OD值×100%。每组重复3次。
1.2.4 流式细胞术检测细胞凋亡 用不含EDTA的胰酶消化各组细胞,离心收集,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入Annexin V-FITC和PI避光孵育。流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度。实验重复3次。
1.2.5 蛋白质印迹法(Western blotting)检测蛋白表达 提取各组细胞总蛋白,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1 h。分别加入一抗(1∶1 000),4℃孵育过夜,TBST洗膜;加入二抗(1∶2 000)室温孵育 2 h,TBST洗涤 3次,每次 10 min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和βactin条带的比值作为蛋白表达水平。每个蛋白样品重复3次。
1.3 统计学方法采用SPSS 20.00进行统计学分析。计量资料以±s表示,两组比较行t检验,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B增殖的影响与小白菊内酯0 μg/mL组相比,不同浓度小白菊内酯处理后分别在24、48、72、96 h时检测细胞活性,结果显示MUM2B细胞活性显著降低(P<0.05)。可见,小白菊内酯抑制MUM2B细胞的增殖。见表1。
表1 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B增殖的影响/±s
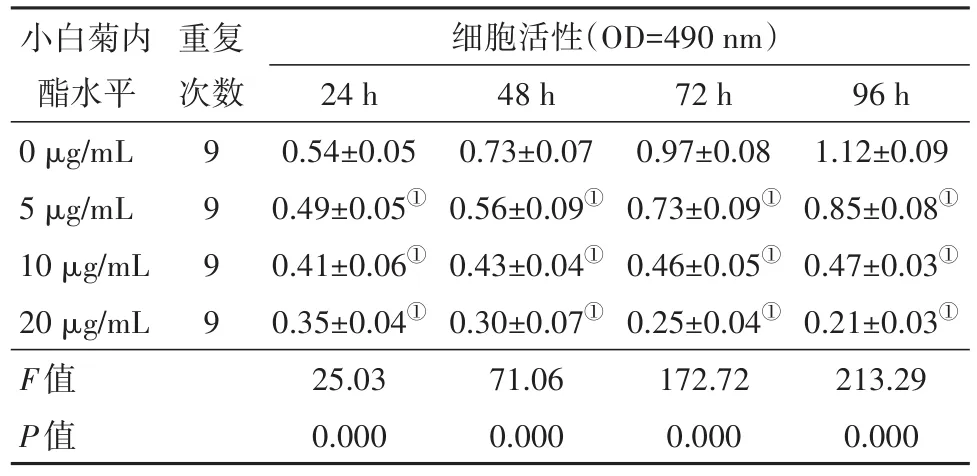
表1 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B增殖的影响/±s
注:①与0 μg/mL组比较,P<0.05。
小白菊内酯水平0 μg/mL 5 μg/mL 10 μg/mL 20 μg/mL F值P值细胞活性(OD=490 nm)96 h 1.12±0.09 0.85±0.08①0.47±0.03①0.21±0.03①213.29 0.000重复次数24 h 0.54±0.05 0.49±0.05①0.41±0.06①0.35±0.04①25.03 0.000 48 h 0.73±0.07 0.56±0.09①0.43±0.04①0.30±0.07①71.06 0.000 9 9 9 9 72 h 0.97±0.08 0.73±0.09①0.46±0.05①0.25±0.04①172.72 0.000
2.2 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B凋亡的影响与小白菊内酯0 μg/mL组相比,不同浓度小白菊内酯组MUM2B细胞凋亡率显著升高(P<0.05);Bax表达水平显著升高,Bcl-2表达水平显著降低(P<0.05)。可见,小白菊内酯促进葡萄膜黑色素瘤细胞MUM2B凋亡。见图1,2和表2。

图1 小白菊内酯对MUM2B细胞凋亡的影响
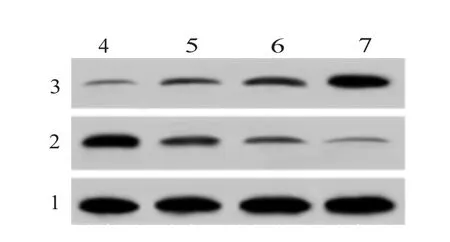
图2 蛋白质印迹法(Western blotting)检测小白菊内酯对MUM2B细胞凋亡相关蛋白表达量的影响
表2 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B凋亡的影响/±s
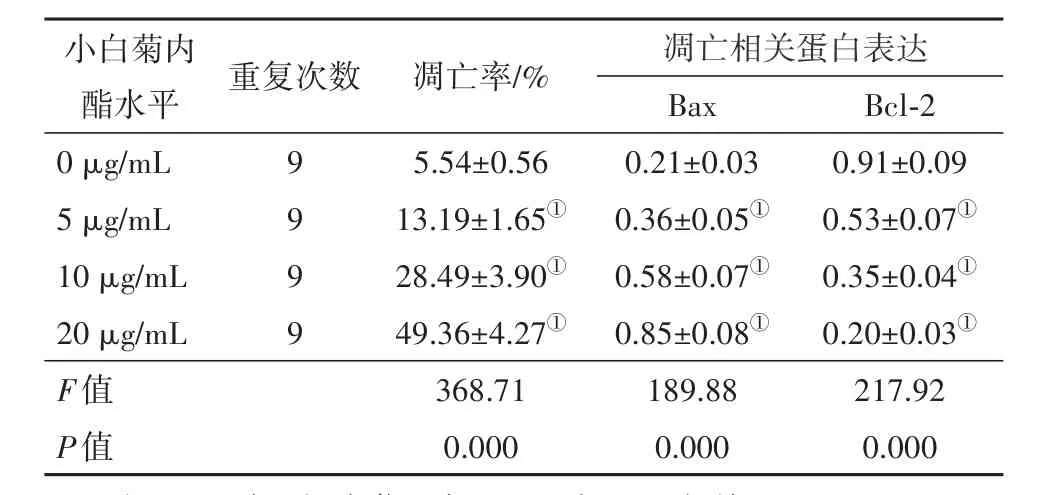
表2 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B凋亡的影响/±s
注:Bcl-2为B细胞淋巴瘤-2;Bax为Bcl-2相关X。①与0 μg/mL组比较,P<0.05。
小白菊内酯水平Bcl-2重复次数 凋亡率/%凋亡相关蛋白表达Bax 0 μg/mL 5 μg/mL 10 μg/mL 20 μg/mL F值P值0.91±0.09 0.53±0.07①0.35±0.04①0.20±0.03①217.92 0.000 9 9 9 9 5.54±0.56 13.19±1.65①28.49±3.90①49.36±4.27①368.71 0.000 0.21±0.03 0.36±0.05①0.58±0.07①0.85±0.08①189.88 0.000
2.3 小白菊内酯对葡萄膜黑色素瘤细胞MUM2B的NF-κB信号通路的影响与小白菊内酯0 μg/mL组相比,小白菊内酯10 μg/mL组p-IkBa、NF-κB p65的表达水平显著降低(P<0.05);IkBa的表达水平差异无统计学意义。可见,小白菊内酯抑制葡萄膜黑色素瘤细胞MUM2B的NF-κB信号通路。见表3,图3。
表3 蛋白质印迹法检测小白菊内酯对MUM2B细胞的核因子-κB(NF-κB)信号通路的影响/±s

表3 蛋白质印迹法检测小白菊内酯对MUM2B细胞的核因子-κB(NF-κB)信号通路的影响/±s
注:①与0 μg/mL组比较,P<0.05。
小白菊内酯水平0 μg/mL 5 μg/mL 10 μg/mL 20 μg/mL F值P值NF-κB p65 0.93±0.12 0.70±0.08①0.33±0.04①0.21±0.03①170.31 0.000重复次数9 9 9 9 IkBa 0.97±0.09 0.96±0.14 0.95±0.12 0.98±0.10 0.12 0.951 p-IkBa 0.81±0.11 0.48±0.06①0.29±0.03①0.17±0.02①165.09 0.000

图3 蛋白质印迹法(Western blotting)检测小白菊内酯对MUM2B细胞的核因子-κB(NF-κB)信号通路的影响
2.4 NF-κB信号通路对葡萄膜黑色素瘤细胞MUM2B增殖、凋亡的影响与Control组相比,PDTC组Bax表达水平显著升高,Bcl-2表达水平显著降低,细胞活性显著降低,凋亡率显著升高(P<0.05);PMA组Bax表达水平显著降低,Bcl-2的表达水平显著升高,细胞活性显著升高,凋亡率显著降低(P<0.05)。可见,抑制NF-κB信号通路可抑制葡萄膜黑色素瘤细胞MUM2B增殖,促进细胞凋亡;而NF-κB信号通路激活MUM2B细胞增殖增加,凋亡减少。见表4,图4。
表4 NF-κB信号通路对MUM2B细胞增殖、凋亡的影响/±s

表4 NF-κB信号通路对MUM2B细胞增殖、凋亡的影响/±s
注:PDTC为吡咯烷二硫代氨基甲酸酯,PMA为佛波醇-12-豆蔻酸酯-13-乙酸酯,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X。与对照组比较,①P<0.05。
组别对照组PDTC PMA F值P值细胞活性(OD=490 nm)重复次数Bcl-2 0.93±0.09 0.31±0.03①1.52±0.12①94.68 0.000 9 9 9 24 h 0.51±0.05 0.40±0.04①0.63±0.09①29.29 0.000 48 h 0.71±0.07 0.49±0.06①0.91±0.07①88.93 0.000 72 h 0.94±0.12 0.56±0.08①1.21±0.13①76.37 0.000 96 h 1.09±0.09 0.61±0.08①1.42±0.11①81.55 0.000凋亡率/%5.16±0.56 17.18±1.65①2.53±0.31①525.86 0.000凋亡相关蛋白表达Bax 0.23±0.05 0.57±0.07①0.12±0.03①145.10 0.000

图4 蛋白质印迹法检测NF-κB信号通路对MUM2B细胞的凋亡相关蛋白表达量的影响
2.5 小白菊内酯通过NF-κB信号通路影响葡萄膜黑色素瘤细胞MUM2B的增殖和凋亡与0 μg/mL组相比,10 μg/mL小白菊内酯组Bax表达水平显著升高,Bcl-2表达水平显著降低,细胞活性显著降低,凋亡率显著升高(P<0.05);与 10 μg/mL组相比,10μg/mL+PMA组Bax表达水平显著降低,Bcl-2表达水平显著升高,细胞活性显著升高,凋亡率显著降低(P<0.05)。
可见,NF-κB信号通路激活能够逆转小白菊内酯对葡萄膜黑色素瘤细胞MUM2B的增殖抑制和凋亡促进的作用。见表5,图5。
表5 小白菊内酯通过NF-κB信号通路对MUM2B细胞增殖、凋亡的影响/±s

表5 小白菊内酯通过NF-κB信号通路对MUM2B细胞增殖、凋亡的影响/±s
注:PMA为佛波醇-12-豆蔻酸酯-13-乙酸酯,Bcl-2为B细胞淋巴瘤-2,Bax为Bcl-2相关X。与0 μg/mL组比较,①P<0.05。 ②与10 μg/mL组相比,P<0.05。
小白菊内酯水平细胞活性(OD=490 nm)重复次数24 h Bcl-2 48 h 72 h 96 h 凋亡率/%凋亡相关蛋白表达Bax 0.52±0.05 0.39±0.07①0.47±0.09②8.77 0.001 0 μg/mL 10 μg/mL 10 μg/mL+PMA F值P值0.91±0.09 0.40±0.05①0.85±0.08②99.56 0.000 9 9 9 0.71±0.07 0.42±0.06①0.63±0.07②73.81 0.000 0.93±0.12 0.45±0.08①0.81±0.13②83.36 0.000 1.08±0.09 0.46±0.08①0.94±0.10②97.28 0.000 5.31±0.52 26.13±3.18①9.53±1.21②276.09 0.000 0.21±0.03 0.97±0.12①0.30±0.40②123.24 0.000

图5 蛋白质印迹法检测MUM2B细胞中凋亡相关蛋白的表达
3 讨论
葡萄膜黑色素瘤具有高度的侵袭性和转移性,对人类健康危害极大[5]。近年来发现部分中药也可抗黑色素瘤,且不良反应轻微[6]。研究发现PTL可诱导细胞凋亡,抑制非小细胞肺癌细胞增殖和侵袭[7]。PTL通过抑制Bcl-2,NF-κB的表达能抑制宫颈癌Hela细胞株生长与迁移能力[8];PTL还能抑制人肝癌、前列腺癌细胞的增殖,诱导细胞凋亡[9-10]。本实验研究结果发现,小白菊内酯可抑制Bcl-2蛋白的表达,促进Bax蛋白的表达;抑制黑色素瘤细胞MUM2B的增殖,促进其凋亡。
NF-κB是真核细胞转录因子家族,该信号通路的激活常与肿瘤的发生密切相关[11]。研究发现NF-κB信号通路的激活与葡萄膜黑色素瘤的不良预后有关[12]。抑制NF-κB活性可抑制胃癌细胞增殖、侵袭,促进细胞凋亡[13]。PMA是蛋白激酶C的激动剂,活化蛋白激酶C时可使IkBa磷酸化,与NF-κB分离,激活NF-κB信号通路;PDTC是一种抗氧化剂,能阻止IkBa磷酸化,阻止NF-κB活化进入细胞核,从而抑制NF-κB信号通路[14]。本研究用PMA和PDTC处理黑色素瘤细胞MUM2B,发现PMA作用后细胞活性升高,细胞凋亡减少;PDTC作用后细胞活性降低,细胞凋亡增多。说明抑制NF-κB信号通路抑制MUM2B细胞增殖,促进细胞凋亡;而激活NF-κB信号通路促进细胞增殖,抑制细胞凋亡。此外,研究发现PTL可抑制缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)信号传导和缺氧诱导的大肠癌上皮-间质转化(epithelial-mesenchymal transition,EMT)[15]。PTL可通过下调雷帕霉素/磷脂酰肌醇3激酶/蛋白激酶B(mammalian target of rapamycin/phosphoinositide 3 kinese/protein kinase B,mTOR/PI3K/AKT)信号通路来激活自噬和凋亡,从而抑制MDA-T32乳头状甲状腺癌细胞[16]。本实验结果表明,PTL能抑制NF-κB信号通路的激活,而激活NF-κB信号通路可逆转PTL对MUM2B细胞的增殖抑制和凋亡促进作用。提示PTL可能通过NF-κB信号通路影响葡萄膜黑色素瘤的进展。
综上所述,小白菊内酯抑制黑色素瘤细胞MUM2B的增殖,促进其凋亡,可能与NF-κB信号通路相关,将可为黑色素瘤的治疗提供新思路和新靶点。
