即食果蔬中金黄色葡萄球菌选择增菌培养基的研究
2022-01-27沈宇飞周海波万佳佳陆兆新孔梁宇胡安妥吕凤霞别小妹
沈宇飞,周海波,万佳佳,陆兆新,孔梁宇,胡安妥,吕凤霞,别小妹
(南京农业大学食品科学技术学院,江苏 南京 210095)
金黄色葡萄球菌在自然界中分布广泛,且适应不同环境的能力较强,在含有150 g·L-1氯化钠的液体培养基中仍可存活[1],在氯化钠质量浓度达到130 g·L-1的TSB琼脂中生长仍不受影响[2]。金黄色葡萄球菌是引发细菌性食物中毒的主要致病菌之一[3-5],对人类及动物生命健康、食品安全和公共卫生造成潜在威胁[6],还可以引起多种人体感染[7-8],主要为皮肤或黏膜感染以及败血性感染[9]。因此对金黄色葡萄球菌进行快速而准确的检测十分重要。
即食果蔬中污染的致病菌细胞可能有3种群体形态,即未受损状态、亚致死状态和死亡状态。在细菌细胞受到较缓和的外界胁迫时,细胞不再正常生长,但也没有受到不可逆的损伤,一旦处于亚致死状态的致病菌重新回到适宜的生长环境,细菌细胞便能迅速进行自我修复与生长[10]。因此,在即食果蔬检测中,使用常规的选择性培养基增菌极容易造成亚致死状态细菌的漏检,因而给食品安全留下严重的安全隐患。对于金黄色葡萄球菌等微生物来说,细胞快速分裂的指数生长期比停止分裂的平台期更容易受到处理过程的影响[11]。即食果蔬加工过程中,多种处理方式都可能导致细菌进入亚致死状态,例如低热杀菌、紫外处理[12-13]、酸性电解水[14]等。目前我国的检测主要按照《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2016》进行,非选择性增菌培养基与选择性培养基的结合被认为是食源性细菌的标准培养方法,但这些方法耗时、耗力且成本高。即食果蔬样品中成分复杂,植物来源的抗菌化合物以及相关的竞争性菌群的存在,导致金黄色葡萄球菌的富集时间延长[15],且受损的细胞无法适应竞争性生长[16-19]。
本试验以LB培养基为基础培养基,筛选3种促进剂与6种抑制剂,促进金黄色葡萄球菌生长的同时抑制非目标菌生长,使用响应曲面分析中的星点设计试验优化出最适添加量。建立的新型选择性增菌培养基(SSA),不仅能高效培养金黄色葡萄球菌,抑制即食果蔬中常见的非目标菌生长,而且还可以恢复受到亚致死损伤的金黄色葡萄球菌细胞。此外,SSA培养基还缩短了检测时间,提高了检测准确度,为即食果蔬的安全快速检测提供技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 菌株本试验使用的菌株包括金黄色葡萄球菌CICC 21600、ATCC 43300、CICC 10786、CICC 10788、CICC 22942,单增李斯特菌CICC 21662,荧光假单胞菌CICC 21620,蜡样芽胞杆菌CMCC 63301,志贺氏菌CMCC 51571,鼠伤寒沙门氏菌CICC 21483,出血性大肠埃希氏菌O157:H7 CICC 21530,创伤弧菌CICC 21615和副溶血性弧菌ATCC 33847,均保藏于南京农业大学酶工程研究室。
1.1.2 主要培养基与试剂Luria-Bertani(LB)培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,pH7.4,加蒸馏水定容至1 L;胰蛋白胨大豆肉汤(TSB)培养基:胰蛋白胨17.0 g,大豆蛋白胨3.0 g,氯化钠5.0 g,磷酸氢二钾2.5 g,葡萄糖2.5 g,加蒸馏水定容至1 L;脑心浸液肉汤(BHI)培养基:蛋白胨10.0 g,脱水小牛脑浸粉12.5 g,脱水牛心浸粉5.0 g,氯化钠5.0 g,葡萄糖2.0 g,磷酸氢二钠2.5 g,pH7.4,加蒸馏水定容至1 L;营养肉汤(NB)培养基:蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,加蒸馏水定容至1 L;75 g·L-1氯化钠肉汤(NaCl+NB)培养基:蛋白胨10.0 g,牛肉膏5.0 g,氯化钠75.0 g,加蒸馏水定容至1 L。以上培养基配制后经高压蒸汽(115 ℃、20 min)灭菌备用。无水葡萄糖、氯化钠购自国药集团化学试剂有限公司;丙酮酸钠、亚碲酸钾购自上海阿拉丁生化科技股份有限公司;萘啶酮酸购自上海源叶生物科技有限公司;苯乙醇、吖啶黄购自上海麦克林生化科技有限公司;甘氨酸购自广州赛国生物科技有限公司;甘露醇购自北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 金黄色葡萄球菌亚致死损伤模型的建立取1 mL培养至对数增长期的金黄色葡萄球菌菌悬液,稀释至108CFU·mL-1,55 ℃ 热处理150~270 s,80 ℃热处理35~55 s,6 000 r·min-1离心5 min。用生理盐水进行梯度稀释,选取合适的稀释梯度涂布于LB平板和选择性平板(NaCl+NB琼脂)中,37 ℃倒置培养24~48 h后计数。3次平行试验,计算致死率[20]和亚致死率[21]筛选最佳金黄色葡萄球菌亚致死条件。
1.2.2 基础培养基的筛选细菌培养:将金黄色葡萄球菌菌悬液稀释至D600值为0.4,按1∶100的体积比接种至20 mL LB、BHI、NB、TSB、NaCl+NB 5种培养基中,37 ℃、180 r·min-1振荡培养10 h,测定D600值;同时取培养后菌液1 mL,用无菌生理盐水进行10倍梯度稀释;选择适宜的稀释度,吸取0.1 mL接种到LB琼脂平板上,置于37 ℃培养12 h进行平板计数。3次平行试验,计算平均值±标准差。
亚致死态细菌的恢复:取1 mL培养至对数增长期的金黄色葡萄球菌菌悬液,稀释至108CFU·mL-1,55 ℃热处理220 s,80 ℃热处理43 s,6 000 r·min-1离心5 min。用生理盐水进行梯度稀释,选取合适的稀释梯度,涂布于LB平板和选择性平板(NaCl+NB琼脂),37 ℃倒置培养24~48 h后计数,计算亚致死率和致死率。同时将稀释液重悬于LB、TSB和BHI培养基中,37 ℃、180 r·min-1分别振荡培养40~180 min,涂布于选择性平板,37 ℃倒置培养24~48 h后计数。
1.2.3 抑制剂和促进剂的选择单因素试验在LB培养基中进行,促进剂与抑制剂及添加量如表1所示。选取5株金黄色葡萄球菌和6株非目标菌(鼠伤寒沙门氏菌CICC 21483、蜡样芽胞杆菌CMCC 63301、志贺氏菌CMCC 51571、荧光假单胞菌CICC 21620、单增李斯特菌CICC 21662和大肠埃希氏菌O157:H7 CICC 21530)作为试验菌株,菌悬液调至D600为0.4左右,接种至含有不同添加物成分的LB培养基中。以未添加试剂的LB液体培养基作为空白对照,接种后于37 ℃、180 r·min-1培养10 h,根据菌液浓度适当稀释,测定D600。3次平行试验,按如下公式计算相应的促进率与抑制率。

表1 促进剂和抑制剂的添加量Table 1 Added level of promoters and inhibitors
促进率=(D600 添加促进剂/D600 原始LB-1)×100%;抑制率=(1-D600 添加抑制剂/D600 原始LB)×100%。
1.2.4 选择性增菌培养基(SSA)优化在单因素试验的基础上,运用Design-Expert.V8.0.6软件,根据星点设计(Central Composite Design)原理,对金黄色葡萄球菌选择性增菌培养基中的葡萄糖(A)、丙酮酸钠(B)、萘啶酮酸(C)、苯乙醇(D)添加量组合进行试验设计(表2)。以培养后菌液的D600值为响应值,进行四因素五水平共30组的响应面设计,包括24组因素试验和6组中心点试验,确定金黄色葡萄球菌特异性增菌培养基中4种因素的最优添加量。由于志贺氏菌CMCC 51571在单因素试验中显示出较难被完全抑制的特点,故将其加入响应面设计中。将金黄色葡萄球菌CICC 22942与志贺氏菌CMCC 51571分别接种到每组试验中,使得试验的初始细菌浓度约为102CFU·mL-1,在37 ℃、180 r·min-1培养10 h后,测定并记录培养基的D600值。

表2 各因素水平设计Table 2 Level design of each factor
1.2.5 SSA对亚致死损伤金黄色葡萄球菌的修复效果将经热处理(55 ℃、220 s)的金黄色葡萄球菌分别接种到20 mL SSA、LB 和NaCl+NB中,37 ℃分别培养60、90和120 min;用无菌生理盐水进行10倍梯度稀释,分别涂布于LB琼脂平板计数,37 ℃培养24 h后进行菌落计数,对比3种培养基对亚致死状态金黄色葡萄球菌修复状态。3次平行试验,计算平均值±标准差。
1.2.6 SSA对细菌的增菌效果将细菌培养后的菌悬液D600调至0.4左右,取3 μL分别接种到含有300 μL LB、SSA和NaCl+NB的孔板中,置于细菌自动生长检测仪37 ℃、180 r·min-1培养24 h。每隔30 min测定各个菌液的D600值,绘制菌株生长曲线,验证SSA对金黄色葡萄球菌及非金黄色葡萄球菌的增菌效果。3次平行试验,计算平均值±标准差。
1.2.7 SSA培养人工污染即食果蔬样品使用常见的5种水果(猕猴桃、火龙果、梨、香蕉和芒果)与5种蔬菜(黄瓜、甘蓝、胡萝卜、生菜和西红柿)作为即食果蔬样品,进行培养基的人工污染验证。用清水清洗即食果蔬样品,将块状样品加工为0.5~1 g的小块,将叶菜类样品均匀切片,样品规格约2 cm2,每份样品质量控制为(25±0.2)g。使用75%乙醇对果蔬样品表面进行消毒,置于生物安全柜中吹干表面剩余的乙醇。将消毒后的样品加入225 mL SSA培养基中,37 ℃、180 r·min-1培养6 h,使用实时荧光定量PCR进行分子检测。同时参照《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2016》的方法进行传统培养检测。
2 结果与分析
2.1 金黄色葡萄球菌亚致死损伤模型的建立
由图1可见:金黄色葡萄球菌在55 ℃低热杀菌时,随着处理时间增加,致死率不断升高,在处理时间达到220 s后,致死率达到50%以上;亚致死率也随处理时间增加而上升,处理时长为240 s时超过90%,其后呈现下降趋势。在80 ℃热处理时,致死率与亚致死率的变化趋势与前者相同,在热处理43 s时亚致死率达到最高,接近60%,热处理50 s后致死率达到100%。为获得更大的培养后亚致死恢复生长空间,倾向选择相对较低的致死率与较高的亚致死率,因此,将55 ℃热处理220 s与80 ℃热处理43 s作为亚致死恢复能力研究的处理条件。

图1 金黄色葡萄球菌在低热杀菌条件的致死率与亚致死率Fig.1 Lethal rate and sub-lethal rate of Staphylococcus aureus in low thermal sterilization 不同大、小写字母分别表示不同热处理时间致死率和亚致死率差异显著(P<0.05)。下同。 Different capital and lowercase letters indicate significant difference of lethal rate and sub-lethal rate on different low-thermally process time(P<0.05). The same as follows.
2.2 基础培养基的筛选
2.2.1 细菌培养如图2所示:5株金黄色葡萄球菌接种至5种培养基中培养后,4株金黄色葡萄球菌在LB中的富集能力显著高于其余4种培养基(P<0.05),LB对菌株ATCC 43300的生长促进作用也均高于其他培养基。75 g·L-1氯化钠肉汤(NaCl+NB)的高氯化钠含量使其具有金黄色葡萄球菌选择性,根据《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2016》,18~24 h的增菌培养才能使金黄色葡萄球菌在其中呈浑浊生长,因此培养12 h后尚未见浑浊。

图2 金黄色葡萄球菌在5种非选择性增菌培养基中的生长Fig.2 Growth effectiveness of S.aureus in five enrichment broths TSB:胰蛋白胨大豆肉汤 Tryptic soy broth;LB:Luria-Bertani肉汤 Luria-Bertani broth;BHI:脑心浸出液肉汤 Brain heart infusion broth;NB:营养肉汤 Nutrient broth;NaCl+NB:75 g·L-1氯化钠肉汤75 g·L-1 Sodium chloride broth. 下同The same as follows.
2.2.2 亚致死态细菌的恢复由图3可见:在55 ℃热处理220 s与80 ℃热处理43 s条件下的亚致死状态金黄色葡萄球菌恢复生长情况中,LB培养基均表现出比TSB与BHI培养基更好的恢复能力。在恢复培养180 min后,活菌浓度便恢复到108CFU·mL-1以上,在55 ℃、220 s热处理组尤为明显。因此,将LB培养基选作基础培养基进行因素优化。

图3 亚致死金黄色葡萄球菌在3种基础培养基中的恢复生长情况Fig.3 Recovery growth situation of S.aureus in three enrichment broths A. 55 ℃热处理220 s后修复效果Recovery effect after 220 s of heat treatment at 55 ℃;B. 80 ℃热处理43 s后修复效果Recovery effect after 43 s of heat treatment at 80 ℃.
2.3 促进剂和抑制剂的选择
由图4可见:丙酮酸钠和葡萄糖均能较好促进金黄色葡萄球菌的生长,当丙酮酸钠质量浓度为12~16 g·L-1时,对金黄色葡萄球菌的促进率相比其他浓度显著提高(P<0.05),除菌株ATCC 43300为25.9%外,其余4株菌的促进率均超过57%。与其他添加量相比,添加2 g·L-1的葡萄糖相比其他浓度能较好地促进金黄色葡萄球菌的生长,除菌株ATCC 43300为11.2%外,其余4株菌的促进率均超过24%。甘露醇对不同金黄色葡萄球菌的增菌效果差异较大,当质量浓度为6 g·L-1时,培养基对金黄色葡萄球菌生长的促进率相对更高。不同菌株的促进率存在差异,菌株ATCC 43300的促进率偏低,甚至有被抑制的现象。葡萄糖与丙酮酸钠对不同金黄色葡萄球菌菌株促进作用更稳定,选作继续优化的因素。

图4 不同质量浓度的促进剂对金黄色葡萄球菌生长的影响Fig.4 Impact of the different concentrations promoters on the cultivation of S.aureus
由图5和图6可见:35 g·L-1氯化钠可以完全抑制大肠埃希氏菌O157:H7 CICC 21530的生长,另5株非目标菌的抑制率也均大于60%(图6-A),20 g·L-1氯化钠对6株非目标菌均有抑制作用,同时对金黄色葡萄球菌抑制较小。10 mg·L-1吖啶黄对蜡样芽胞杆菌CMCC 63301的抑制率达到89.9%,但对其他非目标菌抑制较弱或无抑制(图6-B)。2.0 mL·L-1苯乙醇可完全抑制除志贺氏菌CMCC 51571外的5株非目标菌,志贺氏菌的抑制率也达到87.8%(图6-C),同时对4株金黄色葡萄球菌的抑制较弱,但CICC 10786的抑制率达到55.9%(图5-C)。当苯乙醇浓度为1.0 mL·L-1时,6株非目标菌的抑制率均超过50%,5株金黄色葡萄球菌的抑制率最高仅为5.3%,甚至在2个菌株中显示出促进作用。5 g·L-1甘氨酸对5株非目标菌抑制率在10%左右,而对荧光假单胞菌CICC 21620无明显抑制(图6-D)。8 mg·L-1萘啶酮酸可以完全抑制全部非目标菌的生长(图6-E),但对金黄色葡萄球菌CICC 21600的抑制率达到了68.4%(图5-E)。当萘啶酮酸浓度为4 mg·L-1时,金黄色葡萄球菌抑制率最高为15.5%,同时可完全抑制荧光假单胞菌CICC 21620与单增李斯特菌CICC 21662,对大肠埃希氏菌O157:H7 CICC 21530、鼠伤寒沙门氏菌CICC 21483和蜡样芽胞杆菌CMCC 63301的抑制率分别为98.2%、97.9%和84.5%,但对志贺氏菌CMCC 51571的抑制率仅为47.3%。当亚碲酸钾添加量为20 mg·L-1时,5株金黄色葡萄球菌的抑制率都不超过20%(图5-F),而对鼠伤寒沙门氏菌CICC 21483的抑制率达到100%,荧光假单胞菌CICC 21620和大肠埃希氏菌 O157:H7 CICC 21530的抑制率均达到85%以上,但其余3株非目标菌的抑制率较低(图6-F)。苯乙醇和萘啶酮酸兼具对非目标菌抑制率高和对金黄色葡萄球菌抑制率低的特点,因此将二者选作培养基的抑制剂。
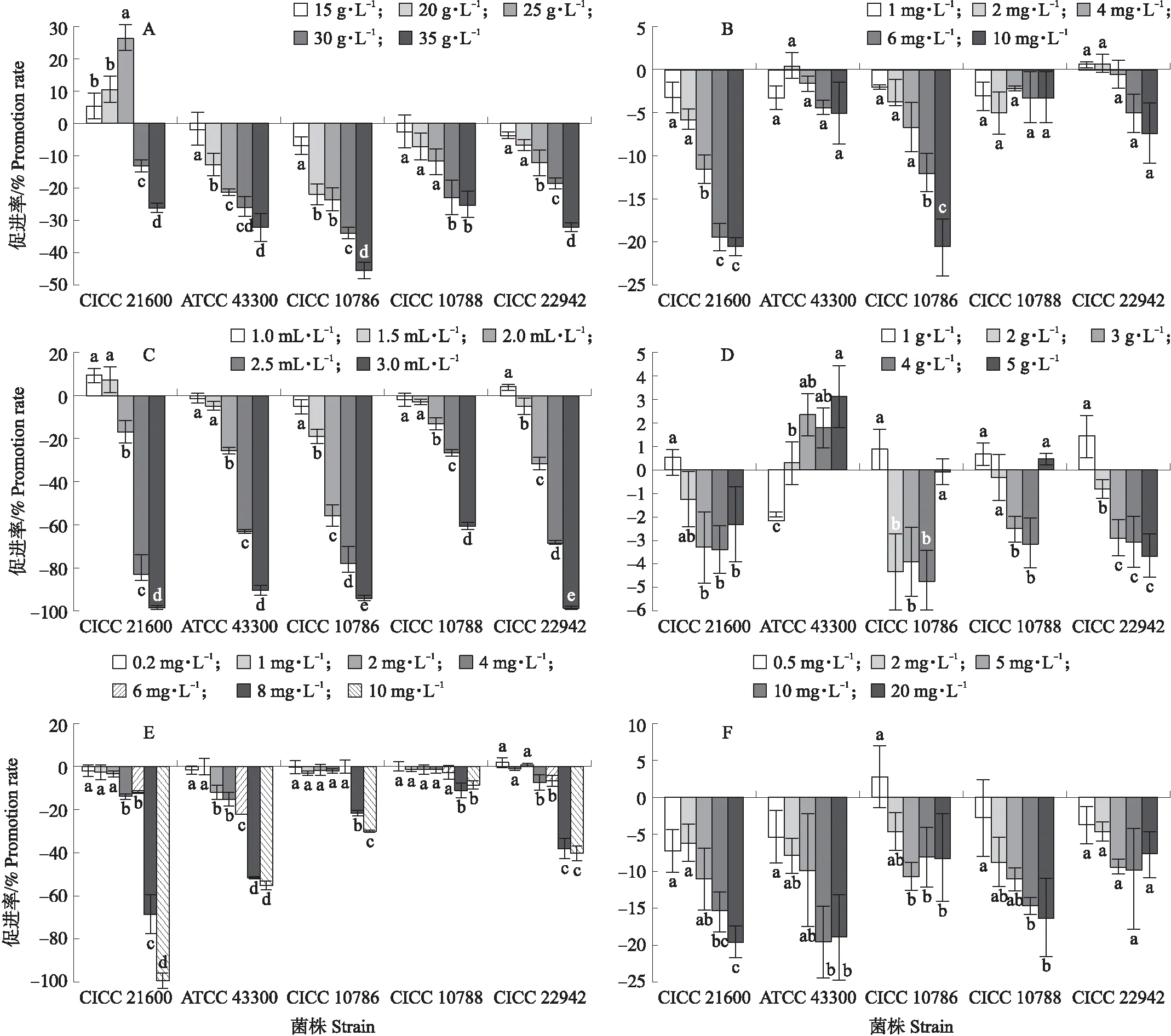
图5 不同浓度抑制剂对金黄色葡萄球菌生长的影响Fig.5 Impact of the different concentrations inhibitors on the cultivation of S.aureus A. 氯化钠 Sodium chloride;B. 吖啶黄 Acriflavine;C. 苯乙醇 Phenylethyl alcohol;D. 甘氨酸 Glycine;E. 萘啶酮酸 Nalidixic acid;F. 亚碲酸钾 Potassium tellurite.

图6 不同浓度抑制剂对非金黄色葡萄球菌生长的影响Fig.6 Impact of the different concentrations inhibitors on the cultivation of non-S.aureus A. 氯化钠 Sodium chloride;B. 吖啶黄 Acriflavine;C. 苯乙醇 Phenylethyl alcohol;D. 甘氨酸 Glycine;E. 萘啶酮酸 Nalidixic acid;F. 亚碲酸钾 Potassium tellurite.
2.4 选择性增菌培养基配方优化
2.4.1 响应面星点设计如表3所示:响应值R1为金黄色葡萄球菌CICC 22942生长促进率,R2为志贺氏菌CMCC 51571生长抑制率。在第2组和第4组中,金黄色葡萄球菌的促进率最高,均超过了93%。促进剂质量浓度处于高值时,金黄色葡萄球菌促进率较高;抑制剂质量浓度处于高值时,金黄色葡萄球菌促进率较低或被抑制,这与单因素试验结果相似。30个试验组,志贺氏菌CMCC 51571的生长均被抑制。
2.4.2 模型方程的建立与显著性检验根据表3的试验结果,使用 Design-Expert V8.0.6软件对生长促进率和各因素进行多元回归分析,同时拟得金黄色葡萄球菌CICC 22942的多元二次回归方程:R1=47.59-0.18A-7.04B-36.50C-44.92D+5.36AB-4.72AC-4.89AD-0.048BC-0.77BD-7.14CD-9.73A2-5.19B2-13.36C2-16.10D2。其中A、B、C、D分别表示葡萄糖、丙酮酸钠、萘啶酮酸、苯乙醇。方程R2值为0.970 2,说明该回归方程的拟合度较好,可通过回归方程对实际试验结果进行方差分析。

表3 星点设计结果Table 3 Results of Central Composite Design test

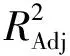
2.4.3 培养基配方的确定为减少志贺氏菌CMCC 51571对金黄色葡萄球菌选择性培养的干扰,使用软件模型将其生长抑制率控制在80%以上,依据此确定抑制剂的添加组合,并将其代入金黄色葡萄球菌生长模型。以苯乙醇浓度为自变量,计算出在此抑制剂条件下的最优促进剂组合,获得金黄色葡萄球菌特异性快速增菌培养基的最终配方。结果如表4所示,在苯乙醇为1.60 mL·L-1时,金黄色葡萄球菌CICC 22942生长促进率模型预测值达到最高值,促进率为44.35%,同时对志贺氏菌CMCC 51571的抑制率达到80%。此时的葡萄糖、丙酮酸钠和萘啶酮酸添加量分别为1.73 g·L-1、12.52 g·L-1和3.82 mg·L-1。

表4 培养基组合添加浓度优化Table 4 Optimization of additional concentration to the broth
2.5 选择性增菌培养基(SSA)重复性评价
由图7可知:在模型预测的最佳培养条件下,4株金黄色葡萄球菌中平均生长促进率最大的是CICC 10788,促进率为71.59%;生长促进最小的是CICC 10786,促进率为20.60%。金黄色葡萄球菌 CICC 22942的平均生长促进率为45.14%,超过预测值的44.68%,预测值与实际值的拟合性较好。4株金黄色葡萄球菌的平均生长促进率为37.20%,同时对志贺氏菌CMCC 51571的平均抑制率达到80.89%,优化结果具有可行性。
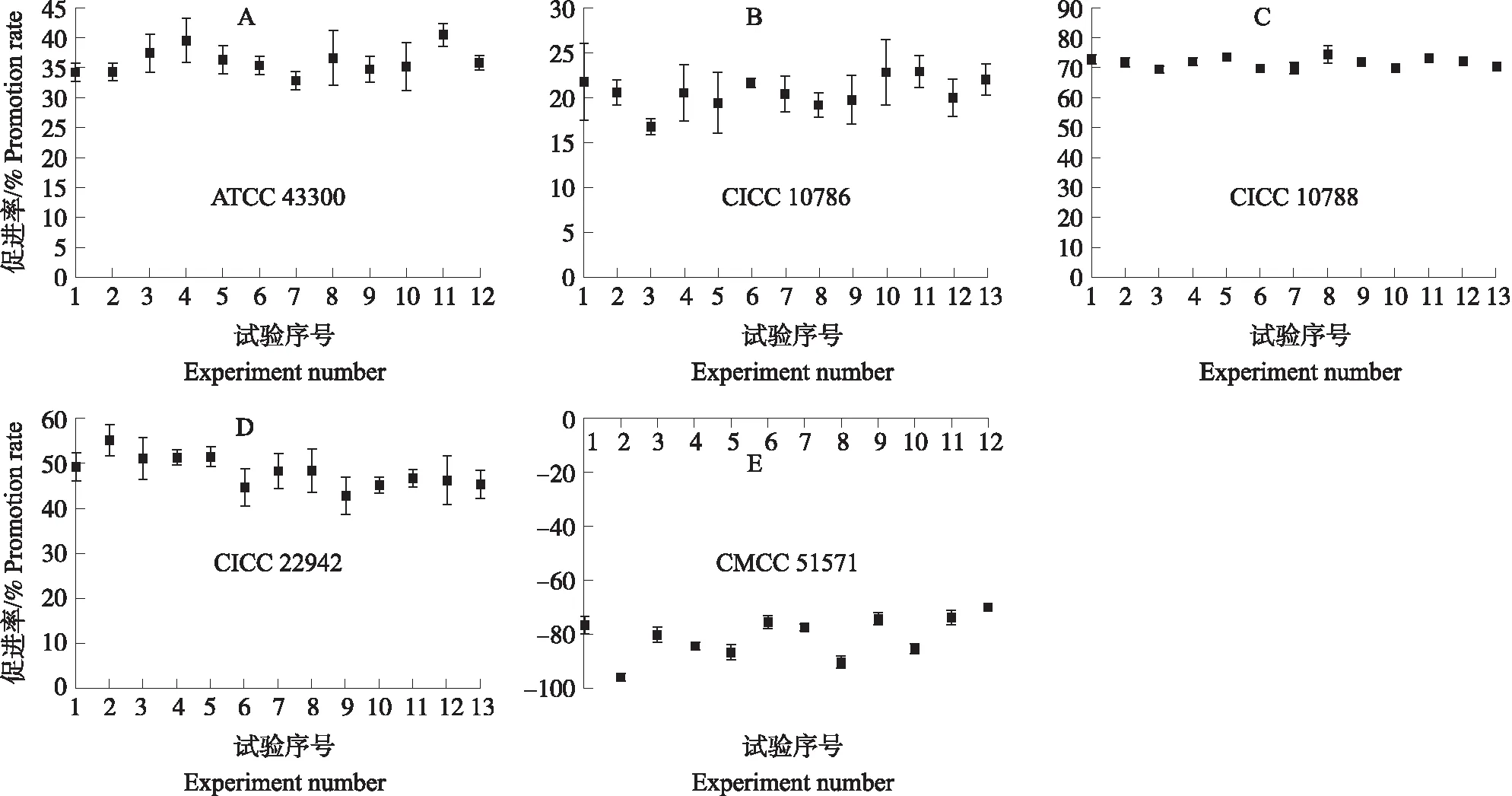
图7 金黄色葡萄球菌(A—D)和志贺氏菌(E)在选择性增菌培养基(SSA)中培养的稳定性Fig.7 Stability of S.aureus(A-D)and S.flexneri(E)cultivated in selective enrichment broth(SSA)
2.6 SSA对热损伤金黄色葡萄球菌的修复效果
由图8可知:SSA的亚致死修复效果相比LB培养基更好,经亚致死处理后的金黄色葡萄球菌在SSA中培养90 min后修复率可达到94.6%,显著高于LB培养基(73.7%);培养120 min后,SSA可达到100%修复,而NaCl+NB培养基在培养180 min后仅能达到71.7%的修复率。因此,SSA对热损伤金黄色葡萄球菌的修复相比LB与NaCl+NB培养基有显著优势。

图8 亚致死金黄色葡萄球菌在SSA 培养基中修复验证Fig.8 Verification of recovery ability of sub-lethal S.aureus in SSA
2.7 SSA对细菌的增菌效果
由图9-A—D可知:金黄色葡萄球菌在LB培养基中最早到达对数生长期,而在SSA培养基中可以得到最高的平台期菌体浓度,在37 ℃、180 r·min-1培养10 h时,SSA培养基中的D600值相比LB培养基高;在NaCl+NB培养基中的生长速度与菌体终浓度均较前两者低。8株非目标菌中,有6株均仅在LB培养基中生长,在SSA与NaCl+NB培养基中均不能生长(图9-E、F)。志贺氏菌CMCC 51571在SSA培养基中的D600值更高,但与金黄色葡萄球菌相比,志贺氏菌在SSA培养基中到达对数生长期更慢。在培养10 h时,在SSA培养基的吸光值显著低于在LB培养基的,故SSA培养基在短时快速培养中对志贺氏菌CMCC 51571也有明显抑制效果(图9-G)。副溶血性弧菌ATCC 33847在LB与NaCl+NB培养基中均能生长,而SSA培养基可以完全抑制其生长(图9-L)。故SSA培养基同时在促进金黄色葡萄球菌生长与抑制果蔬中常见其他致病菌中均有较好效果。
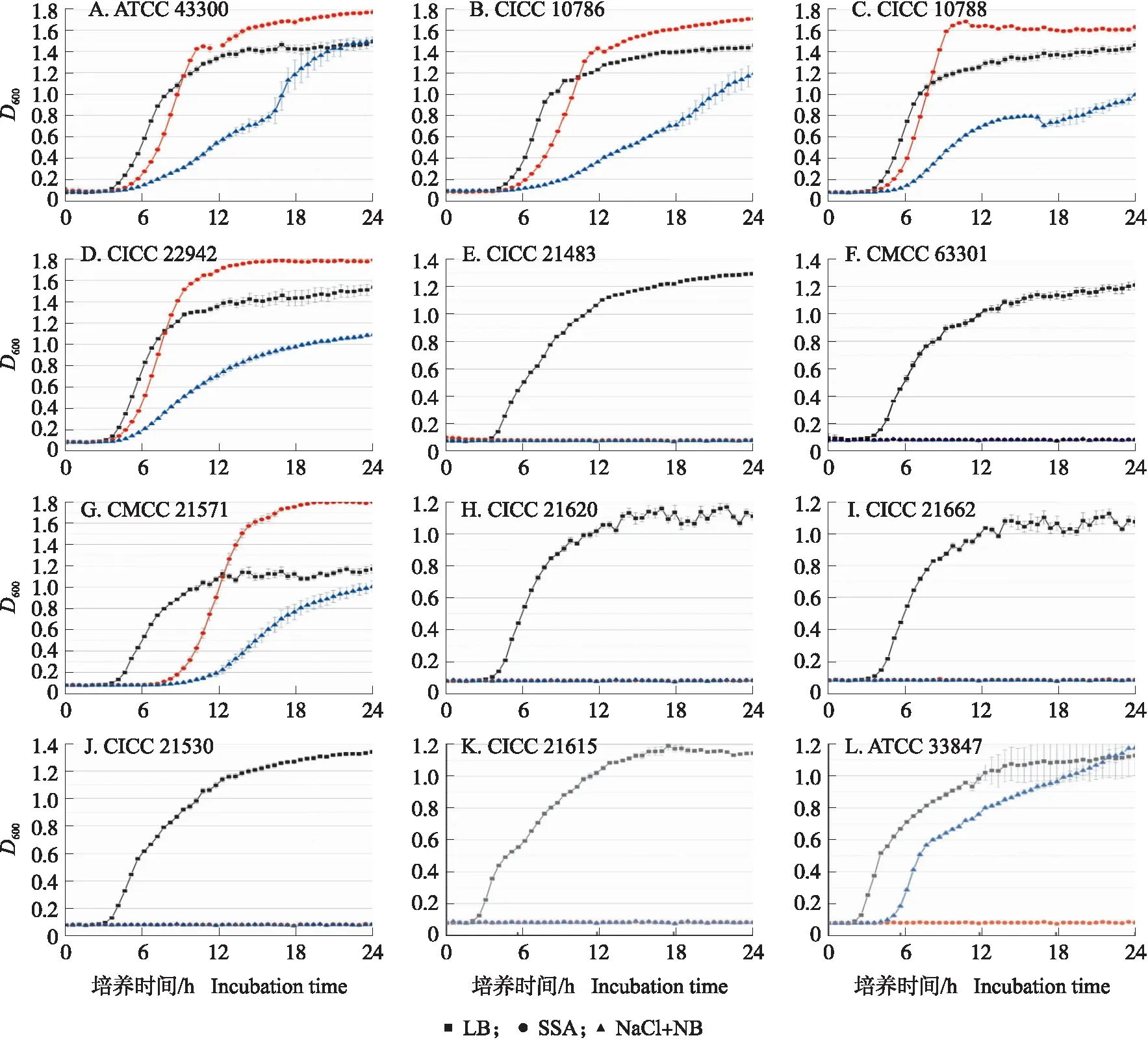
图9 金黄色葡萄球菌(A—D)及非目标菌(E—L)在LB、SSA和NaCl+NB培养基中的生长曲线Fig.9 Growth kinetics of S.aureus(A-D)and non-S.aureus(E-L)in LB,SSA and NaCl+NB broth
2.8 人工污染即食果蔬样品的检测
如表5所示:当样品在SSA培养基中培养6 h后,通过PCR法和涂布法对即食果蔬中金黄色葡萄球菌的检出率分别为100%和90%,在NaCl+NB培养基中培养18 h后PCR法和涂布法的检出率分别为90%和40%。因此,SSA培养基相较于NaCl+NB培养基在培养时间与检出率上均有明显的优势。

表5 通过SSA与NaCl+NB培养基检测人工污染即食果蔬样品中的金黄色葡萄球菌Table 5 Detection of S.aureus in artificially contaminated food samples cultured by SSA and NaCl+NB broth
3 讨论
在即食果蔬类食品加工过程中,为保护食品品质、外观和口感等因素不受破坏,常使用较温和的杀菌方法,如紫外照射、微波辐照、酸性电解水处理与低热杀菌等。Lu等[22]使用功率为700 w的家用微波炉加热圣女果40 s杀菌,菌落计数可下降101.5CFU·mL-1;Chen等[23]使用微酸性电解水和富马酸同时处理水果样品,单个水果的菌落计数可下降102.85~105.35CFU的降低。这些方法虽能在较短的时间内杀灭大部分致病菌,但这些方法不能实现彻底灭菌。部分受到损伤但还没有立即死亡的细菌细胞会停止生长,进入自我保护的休眠状态,等待足够的营养条件继续复苏生长。在即食果蔬类食品样品优沃的营养条件下,这类细菌很容易重新生长并产生毒素,在达到一定量的累积后便会对人体健康造成威胁。
关于金黄色葡萄球菌的增菌培养,采用TSB培养基进行增菌培养的实例最多[24]。LB、BHI和NB均为微生物培养实验中常选用的基础培养基,75 g·L-1氯化钠肉汤是国家标准中规定的金黄色葡萄球菌选择性增菌培养基。本研究发现,LB培养基对金黄色葡萄球菌的生长与亚致死细菌的恢复效果比其他培养基(BHI、NB、TSB和NaCl+NB)更好,故选择LB培养基作为基础培养基用于后续因素优化。
单因素添加物的选择对培养基的优化过程至关重要。本研究采用葡萄糖与丙酮酸钠作为金黄色葡萄球菌快速选择培养的促进剂,萘啶酮酸和苯乙醇作为抑制剂,在抑制即食果蔬中常见的杂菌生长时还能够促进金黄色葡萄球菌的生长。苯乙醇是一种具有令人愉悦的玫瑰风味的芳香醇,在食品和药品等领域具有广泛的应用[25]。苯乙醇在本研究中具有极好的筛选作用,对6株非目标菌发挥强有力的抑制作用,仅需1 mL·L-1就能对6株非目标菌造成50%以上的生长抑制,2 mL·L-1苯乙醇就能完全抑制除志贺氏菌(抑制率87.8%)外的非目标菌,但其对金黄色葡萄球菌的抑制则比较轻微。萘啶酮酸是常用的抑菌剂,朱敏等[26]研究发现,20 mg·L-1萘啶酮酸对大肠杆菌和蜡样芽胞杆菌的生长有较强的抑制性。本研究中,4 mg·L-1萘啶酮酸对沙门氏菌和大肠埃希氏菌O157:H7的抑制率分别达到97.9%和98.2%,大于Qu等[27]报道的93%的抑制率。葡萄糖是细菌培养中常见的碳源类物质,是TSB培养基的营养成分之一。本研究中,仅需2 g·L-1葡萄糖即可将金黄色葡萄球菌的生长率提高11.2%~33.9%。丙酮酸钠是一种在科学研究和日常生活中被广泛应用的丙酮酸盐,在食品科学领域可用作食品添加剂和膳食补充剂[28]。在微生物培养中,丙酮酸钠是常用的促进剂,同时有改善细胞损伤的作用。本研究中,添加12 g·L-1丙酮酸钠对金黄色葡萄球菌有60%左右的促进作用,这与Yoon等[29]的结果相似。
本研究采用四因素五水平的星点设计,对葡萄糖、丙酮酸钠、萘啶酮酸和苯乙醇这4种添加物进行多重组合试验。在抑制剂添加到适宜的浓度时,促进剂的浓度与金黄色葡萄球菌的生长促进率并非为完全的正相关关系。当萘啶酮酸为3.82 mg·L-1,苯乙醇为1.60 mL·L-1时,金黄色葡萄球菌的生长促进率均随2种促进剂试验范围内浓度的升高呈先升高后下降的趋势,这与单因素试验的结果不同,同时体现了多因素交互试验的价值。
综上所述,本研究优化了1种金黄色葡萄球菌选择性增菌培养基SSA,最佳培养基配方是胰蛋白胨10.00 g·L-1,酵母浸粉5.00 g·L-1,氯化钠10.00 g·L-1,葡萄糖1.73 g·L-1,丙酮酸钠12.52 g·L-1,萘啶酮酸3.82 mg·L-1,苯乙醇1.60 mL·L-1,可有效抑制即食果蔬中常见的非目标菌,同时提高金黄色葡萄球菌的生长效率及恢复热损伤细菌生长能力。SSA 培养基仅需6 h即可满足国家标准中即食果蔬中金黄色葡萄球菌检测限的培养需要,相比于国家标准所使用的75 g·L-1氯化钠肉汤所需的最短18 h的培养时间缩短2/3,结合分子检测方法,从取样起仅需不到10 h即能得到准确的检测结果,为即食果蔬的安全控制提供了新方法。
