TNF-α诱导小鼠乳腺上皮细胞凋亡和程序性坏死研究
2022-01-27杨彩霞杨敏王根林李亚南雷智琦李莲
杨彩霞,杨敏,王根林,李亚南,雷智琦,李莲
(南京农业大学动物科技学院乳牛科学研究所/动物科学类国家级实验教学示范中心,江苏 南京 210095)
奶牛乳腺炎是由病原微生物侵入乳腺组织,导致乳腺组织感染所引起的一系列炎症反应。乳腺炎可造成乳腺组织损伤,进而影响泌乳功能,使产奶量下降,严重时可造成乳房病变导致淘汰,是危害奶牛养殖业最为严重的疾病之一[1]。其中,乳腺上皮细胞在免疫过程中发挥十分重要的作用,当病原微生物感染组织时,肿瘤坏死因子(tumor necrosis factor,TNF)等炎性因子被识别后发出招募信号,乳腺上皮细胞将炎性信息传递至巨噬细胞及中性粒细胞等,招募免疫细胞转移至炎性损伤部位,识别并结合病原体,吞噬并杀死病原体后引起乳腺组织局部炎症,缓解病原体的致病作用[2]。目前,针对奶牛乳腺炎治疗的最有效方法是抗生素治疗法,但是抗生素治疗后产生的细菌抗药性以及抗生素残留问题是一个非常严峻的全球问题[3-4]。因此,随着分子生物学技术的发展,寻找乳腺炎感染分子调控的靶点,并结合抗病育种开发靶向药物,可能是预防与治疗奶牛乳腺炎的一个新途径。
程序性坏死(necroptosis)是近年来发现的一种受程序性调控的细胞死亡方式,与细胞凋亡共享上游信号元件,如死亡受体肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)、Fas相关死亡结构域(Fas associated death domain,FADD)等[5],由受体相互作用蛋白激酶1(receptor interacting serine/threonine protein kinase 1,RIP1)、受体相互作用蛋白激酶3(receptor interacting serine/threonine protein kinase 3,RIP3)和混合谱系激酶域样蛋白(mixed lineage kinase domain like pseudokinase,MLKL)传导通路所调控的半胱氨酸天冬氨酸蛋白酶(cysteine-aspartic proteases,Caspase)非依赖型细胞死亡方式[6-7]。而细胞凋亡依赖于Caspase家族调控,发生凋亡的细胞间相互连接丢失,细胞皱缩聚集后变圆亮,细胞核凝集,DNA碎片化,细胞膜包围形成凋亡小体,并最终被消化吞噬;细胞发生程序性坏死后细胞器肿胀,细胞内出现空泡,细胞膜破裂,释放的损伤相关分子模式(damage associated molecular patterns,DAMP)可以激发多种细胞(如巨噬细胞、中性粒细胞和成纤维细胞等)参与免疫反应,通过释放炎性细胞因子加剧炎症应答,从而导致程序性坏死在不同生理或病理过程中扮演重要角色[8-9]。近年的研究表明,细胞程序性坏死是凋亡被抑制情况下的一种细胞死亡方式。程序性坏死参与多种炎症相关的生理和病理过程,如胚胎发育、缺血/再灌注损伤、炎症反应和外源微生物(细菌和病毒)引起的感染,它在细胞存活和死亡中发挥十分重要的作用[10]。
奶牛生产主要是指利用奶牛乳房高效生产优质牛奶,高效优质的牛奶主要是由乳房乳腺上皮细胞合成和分泌。有研究表明,奶牛乳腺炎的发生与TNF诱导的信号通路造成的急性炎性损伤相关[11]。作为一种具有多种生物学功能的细胞炎性因子,TNF-α既可以诱导细胞凋亡,也可以启动细胞程序性坏死[10],因此通过TNF-α诱导小鼠乳腺上皮细胞凋亡或程序性坏死对奶牛生产具有十分重要的指导意义。但TNF-α在何种条件下诱导小鼠乳腺上皮细胞凋亡,又在何种条件下转向诱导细胞程序性坏死,其中的作用机制尚未清晰。环己酰亚胺(cycloheximide,CHX)是一种阻断真核细胞翻译延伸阶段的蛋白质合成抑制剂,Z-VAD-FMK是一种广谱Caspase家族抑制剂,通过TCZ混合处理成功诱导了TPKTS小鼠近端肾小管细胞的程序性坏死,表明TCZ联合诱导可引起细胞炎症并激活程序性坏死途径[12]。本研究采用TNF-α单独或与CHX、Z-VAD-FMK联合处理小鼠乳腺上皮细胞,旨在研究TNF-α诱导对小鼠乳腺上皮细胞凋亡和程序性坏死的调控机制,为后续探究细胞程序性坏死通路在奶牛急性乳腺炎发生过程中的作用奠定基础。
1 材料与方法
1.1 试验材料
本试验所用小鼠乳腺上皮细胞(HC-11细胞系)购于美国典型培养物保藏中心。TNF-α购于南京金斯瑞公司;CHX、Z-VAD-FMK(Caspase家族抑制剂)购自Med Chem Express(MCE)公司;胎牛血清(FBS)、胰蛋白酶购于Gibco公司;细胞冻存液购自新赛美公司;CCK-8细胞活力检测试剂盒购自同仁化学(Dojindo)公司;RPMI 1640培养基购自上海源培公司;PBS购于Hyclone公司;青霉素和链霉素购自合肥Biosharp公司;RNA提取试剂盒购自百泰克公司;RT Super Mix和ChamQ SYBR qPCR Master Mix购自南京诺唯赞公司。
1.2 试验方法
1.2.1 小鼠乳腺上皮细胞系的冻存、复苏、培养将对数生长期融合度大于80%的HC-11细胞用胰蛋白酶消化,加入1 mL冻存液,将冻存管置于冻存盒中-80 ℃低温保存24 h后,转移至液氮中长期保存。将装有 HC-11细胞的冻存管从液氮罐中取出后,置于37 ℃水浴,轻轻摇晃使其快速溶解,加入含10% FBS的RPMI 1640培养基至10 mL,1 000 r·min-1离心5 min,接种至T25培养瓶,置于37 ℃ 、5% CO2、饱和湿度培养箱内培养。大约12 h待细胞贴壁后,更换新鲜的完全培养基除去死细胞。每48 h换1次培养基,待细胞长至80%~90%汇合时,进行细胞消化传代培养。
1.2.2 TNF-α浓度的筛选将TNF-α粉末溶解在含有0.1% BSA的PBS中使其终质量浓度为100 μg·mL-1,CHX和Z-VAD-FMK溶解在DMSO中使其终浓度分别为10、20 mmol·L-1,分装于200 μL无菌离心管中,并在使用时用RPMI 1640培养基稀释成工作浓度。将对数期生长的小鼠乳腺上皮细胞接种于96孔细胞培养板,培养24 h以达到80%~90%汇合。对照组用DMSO处理(添加量为总体积的0.1%),其他各组用TNF-α(20、50、100 ng·mL-1)单独或与CHX(4 μmol·L-1)、Z-VAD-FMK(20 μmol·L-1)联合处理12 h和 24 h,然后将10 μL CCK-8溶液加入到100 μL细胞培养基中,37 ℃孵育2~3 h,用酶标仪测量450 nm处的吸光值A450。每组5个重复,结果取平均值。
1.2.3 试验分组及处理细胞分为4组:对照(Ctrl)组、TNF-α(T)组、TNF-α+CHX(TC)组和TNF-α+CHX+Z-VAD-FMK(TCZ)组,每组3个重复。对照组添加DMSO(添加量为总体积的0.1%),T组添加100 ng·mL-1TNF-α;TC组添加100 ng·mL-1TNF-α+4 μmol·L-1CHX;TCZ组添加100 ng·mL-1TNF-α+4 μmol·L-1CHX+20 μmol·L-1Z-VAD-FMK。处理24 h后进行后续试验。
1.2.4 RNA提取与RT-qPCR检测细胞凋亡、程序性坏死及炎症因子相关基因的表达收集细胞,按RNA提取试剂盒说明书提取细胞总RNA。取1 000 ng总RNA用RT Super Mix反转录成 cDNA,-80 ℃保存备用。用ChamQ SYBR qPCR Master Mix检测凋亡和程序性坏死相关基因mRNA的表达水平,反应产物经熔解曲线检测特异性,用 2-ΔΔCT法计算各基因mRNA相对表达量。引物序列见表1。

表1 荧光定量PCR引物序列Table 1 Primer sequences for quantitative real-time PCR
1.2.5 Western blot检测细胞凋亡和程序性坏死相关蛋白的表达收集细胞,加入含苯甲基磺酰氟(PMSF)的裂解液,冰上裂解30 min,4 ℃、12 000 r·min-1离心15 min,上清液中为细胞总蛋白,按照BCA试剂盒(南京碧云天生物技术公司)测定蛋白浓度。吸取上清液并加入裂解液和上样缓冲液将蛋白调整为统一浓度,95 ℃煮沸10 min变性,上样后进行SDS-PAGE,然后将蛋白转移至PVDF膜上,用50 g·L-1脱脂奶粉或牛血清白蛋白(BSA)室温封闭1 h,加一抗,4 ℃孵育过夜,TBST洗涤 3次后加辣根过氧化物酶(HRP)标记的山羊抗兔/鼠IgG二抗(1∶5 000)室温孵育1 h,TBST洗涤3次后用ECL试剂显影发光。用Image J软件进行条带的灰度分析。试验所用抗体Bcl-2、Bax和cleaved Caspase-3购自万类生物科技有限公司,RIP3、MLKL和p-MLKL购自Cell Signaling Technology公司,PGAM5、Drp1和 β-actin 购自Proteintech公司。
1.2.6 透射显微镜观察细胞超微结构变化培养好的细胞弃培养基,加入2.5%常温戊二醛固定液避光固定5 min,用细胞刮刀沿一个方向轻轻刮下细胞,收集到15 mL离心管中,4 000 r·min-1离心2 min,弃上清液,加入新固定液1.5 mL,室温避光固定2 h,转移至4 ℃冰箱中保存。经过漂洗—后固定—漂洗—脱水—渗透—包埋—超薄切片—染色后,用透射显微镜观察并拍照。
1.3 统计分析
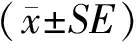
2 结果与分析
2.1 TNF-α、CHX和Z-VAD-FMK处理对小鼠乳腺上皮细胞增殖的影响
如图1所示:用不同浓度的TNF-α、TNF-α+CHX、TNF-α+CHX+Z-VAD-FMK分别处理小鼠乳腺上皮细胞12 h和24 h。在处理时间为12 h时(图1-A),T-100(100 ng·mL-1TNF-α)组的细胞活力极显著低于对照组(P<0.001);所有的TC组和TCZ组细胞活力均极显著低于对照组(P<0.001)。
在处理时间为24 h时(图1-B):T-50(50 ng·mL-1TNF-α)组和T-100组的细胞活力均极显著低于对照组(P<0.01或P<0.001);所有的TC组和TCZ组细胞活力均极显著低于对照组(P<0.001);其中TC-100(100 ng·mL-1TNF-α+4 μmol·L-1CHX)组处理24 h后细胞活力最低为52%。因此,后续试验采用的加药剂量为TNF-α 100 ng·mL-1、CHX 4 μmol·L-1、Z-VAD-FMK 20 μmol·L-1,处理时间24 h。

图1 TNF-α、CHX和Z-VAD-FMK处理12 h(A)和24 h(B)对小鼠乳腺上皮细胞增殖的影响Fig.1 Effects of TNF-α、CHX and Z-VAD-FMK treatment for 12 h(A)and 24 h(B) on proliferation of mouse mammary epithelial cells Ctrl:对照组Control group;T-20:TNF-α 20 ng·mL-1;T-50:TNF-α 50 ng·mL-1;T-100:TNF-α 100 ng·mL-1;TC-20:20 ng·mL-1 TNF-α+4 μmol·L-1 CHX;TC-50:50 ng·mL-1 TNF-α+4 μmol·L-1 CHX;TC-100:100 ng·mL-1 TNF-α+4 μmol·L-1 CHX;TCZ-20:20 ng·mL-1 TNF-α+4 μmol·L-1 CHX+20 μmol·L-1 Z-VAD-FMK;TCZ-50:50 ng·mL-1 TNF-α+4 μmol·L-1 CHX+20 μmol·L-1 Z-VAD-FMK;TCZ-100:100 ng·mL-1 TNF-α+4 μmol·L-1 CHX+20 μmol·L-1 Z-VAD-FMK. *P<0.05;**P<0.01;***P<0.001. 下同The same as follows.
2.2 光学显微镜观察T、TC、TCZ诱导小鼠乳腺上皮细胞形态学变化
如图2所示:对照组细胞连接紧密,形态规整,细胞间界限清晰,而T、TC和TCZ组部分小鼠乳腺上皮细胞形态紊乱,少数细胞悬浮,呈现不同程度的死亡。

图2 光学显微镜观察小鼠乳腺上皮细胞形态学变化Fig.2 Mouse mammary epithelial cells morphology observed by optical microscopy Ctrl:对照组Control group;T:100 ng·mL-1TNF-α;TC:100 ng·mL-1 TNF-α+4 μmol·L-1 CHX;TCZ:100 ng·mL-1 TNF-α+4 μmol·L-1 CHX+20 μmol·L-1 Z-VAD-FMK. 下同The same as follows.
2.3 透射电镜鉴定TCZ诱导小鼠乳腺上皮细胞死亡的方式
如图3所示:对照组细胞圆润,线粒体形态规整;TCZ组细胞内出现空泡,线粒体肿胀、断裂等坏死细胞所具有的细胞超微结构变化。
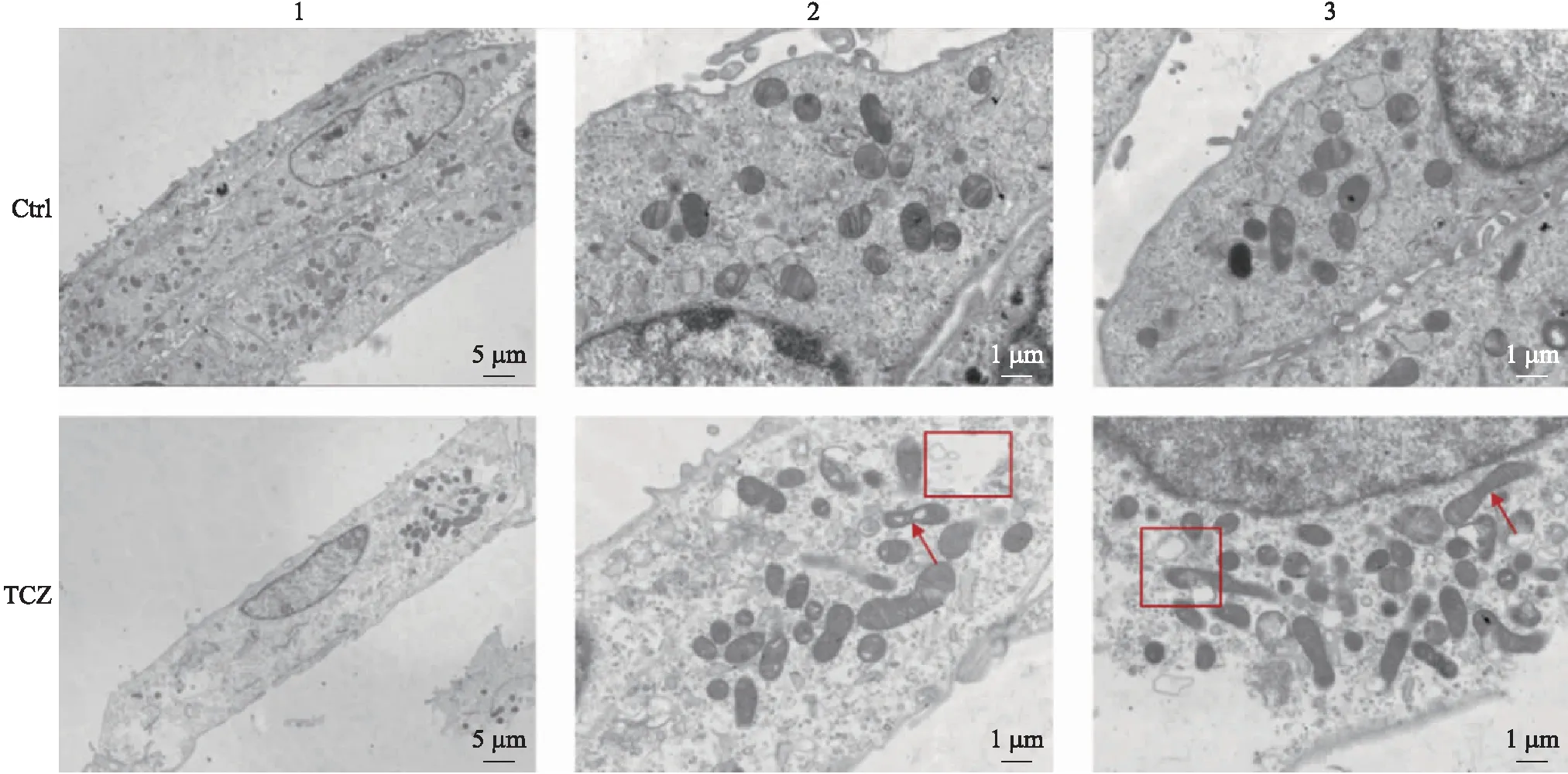
图3 小鼠乳腺上皮细胞死亡方式的透射电镜鉴定Fig.3 Mouse mammary epithelial cell death modalities identified by transmission electron microscopy 箭头指线粒体断裂,方框指细胞内空泡Arrows indicate mitochondrial breakage,squares indicate intracellular vacuoles. 1~3:是指不同放大倍数的图片Picture 1-3 refer to pictures with different magnification.
2.4 T、TC、TCZ处理对小鼠乳腺上皮细胞凋亡相关基因mRNA及蛋白表达的影响
如图4所示:与对照组相比,在T组和TC组中观察到Caspase-3mRNA表达水平极显著升高(P<0.01或P<0.001),T、TC和TCZ组Bax/Bcl-2mRNA表达水平比值均极显著升高(P<0.001)。

图4 T、TC、TCZ对小鼠乳腺上皮细胞凋亡相关基因mRNA(A)及蛋白(B)表达的影响Fig.4 Effects of T,TC and TCZ on mRNA(A)and protein(B)expressions of apoptosis related genes in mouse mammary epithelial cells *P<0.05;**P<0.01;***P<0.001. 下同The same as follows.
与对照组相比,T、TC和TCZ组Bax蛋白表达没有显著变化,T组和TCZ组Bcl-2蛋白表达水平略有下调,仅TC组Bcl-2蛋白表达水平显著下降(P<0.05),T组和TC组Bax/Bcl-2蛋白表达水平的比值和cleaved Caspase-3蛋白表达水平显著上升(P<0.05或P<0.001)。
2.5 T、TC、TCZ处理对小鼠乳腺上皮细胞程序性坏死相关基因mRNA及蛋白表达的影响
如图5所示:与对照组相比,T和TC组Caspase-8mRNA表达水平极显著升高(P<0.001或P<0.01),而TCZ组Caspase-8mRNA表达水平极显著降低(P<0.001);TC组和TCZ组的RIP3和MLKLmRNA表达水平极显著升高(P<0.001)。与对照组相比,T组RIP3蛋白表达水平显著降低(P<0.05),而TCZ组RIP3蛋白表达水平极显著升高(P<0.01),T和TC组MLKL和p-MLKL蛋白表达水平没有显著变化,而TCZ组MLKL和p-MLKL蛋白表达水平极显著升高(P<0.01或P<0.001),且p-MLKL/MLKL的比值显著升高(P<0.05)。

图5 T、TC、TCZ对小鼠乳腺上皮细胞程序性坏死相关基因mRNA(A)及蛋白(B)表达的影响Fig.5 Effects of T,TC and TCZ on mRNA(A)and protein(B)expressions of necroptosis related genes in mouse mammary epithelial cells
2.6 T、TC、TCZ处理对小鼠乳腺上皮细胞线粒体裂变相关基因mRNA及蛋白表达的影响
如图6所示:与对照组相比,TC组和TCZ组PGAM5和Drp1mRNA表达水平极显著升高(P<0.001),TCZ组的PGAM5蛋白表达水平显著升高(P<0.05),TC组和TCZ组Drp1的蛋白表达水平均极显著升高(P<0.001或P<0.01)。
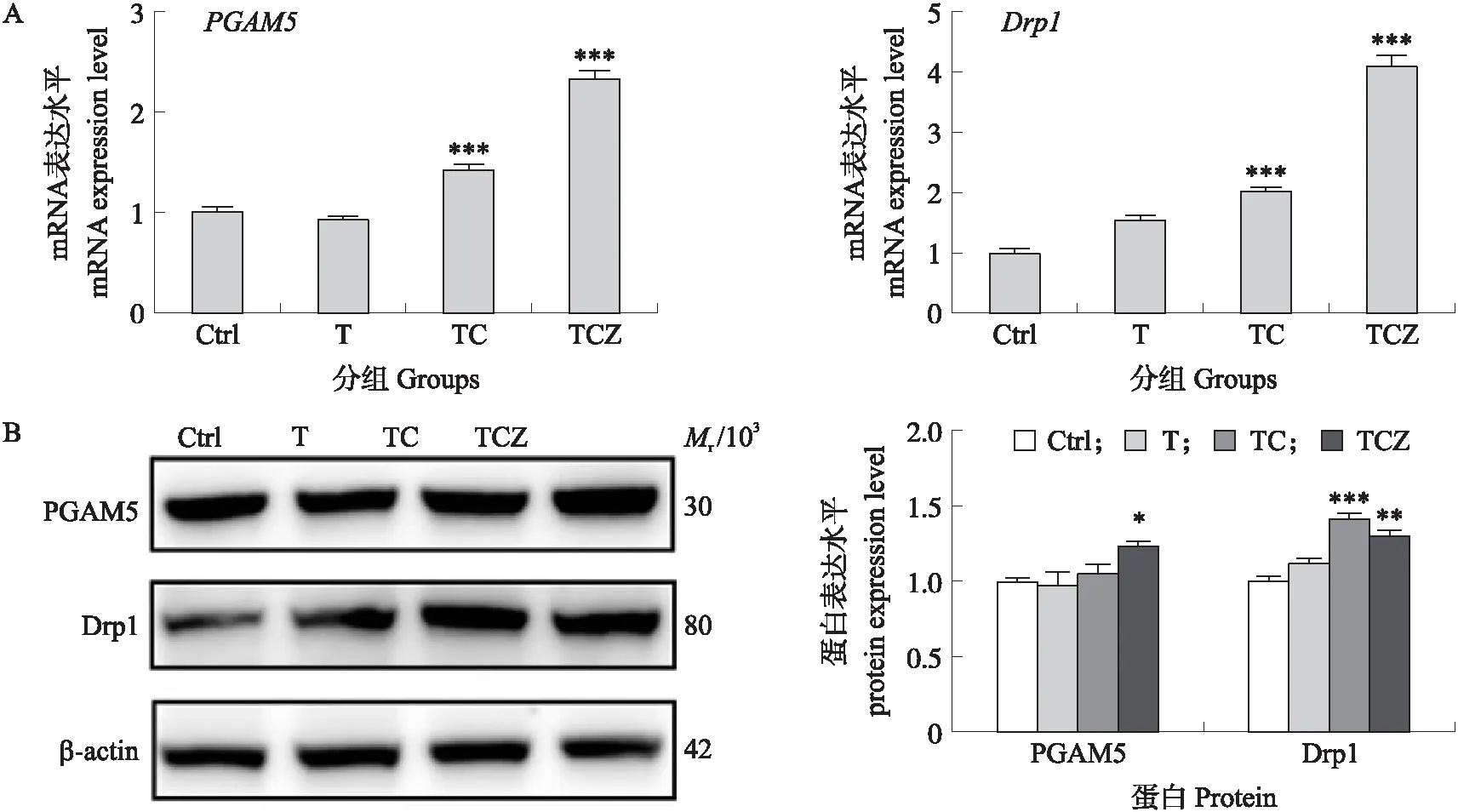
图6 T、TC、TCZ对小鼠乳腺上皮细胞线粒体裂变相关基因mRNA(A)及蛋白(B)表达的影响Fig.6 Effects of T,TC and TCZ on mRNA(A)and protein(B)expressions of mitochondrial fission related genes in mouse mammary epithelial cells
3 讨论
在本试验中,我们发现用TNF-α处理小鼠乳腺上皮细胞,Caspase-8被激活并诱导细胞凋亡,但在Caspase-8抑制的条件下部分细胞被诱导激活程序性坏死通路,即TNF-α单独处理、TNF-α与CHX联合处理均诱导一定程度的细胞凋亡,但TNF-α+CHX+Z-VAD-FMK联合处理能够诱导小鼠乳腺上皮细胞发生程序性坏死,且线粒体裂变后的下游事件可能会决定细胞的死亡方式。
线粒体除了具有生物学和代谢中的传统作用外,现在还被认为是细胞死亡的执行者。在细胞凋亡过程中,细胞色素c、Smac/Diablo、Omi/HtrA2、EndoG和AIF从线粒体膜间释放,引发一系列导致细胞凋亡的生化反应[13]。线粒体外膜对这些细胞凋亡因子的通透性由Bcl-2家族蛋白调控,其中Bax是重要的细胞凋亡基因[14],Bcl-2/Bax值决定细胞受到凋亡刺激时的生存状态,Bcl-2蛋白的比例大时细胞趋于存活,Bax蛋白的比例大时细胞趋于凋亡。Caspase家族是介导细胞凋亡过程中的重要组成部分,其中Caspase-3在细胞凋亡途径中起着关键作用[15-16]。在本试验中,与对照组相比,暴露于T、TC和TCZ诱导剂的小鼠乳腺上皮细胞增殖能力显著降低,且细胞死亡率从大到小依次为为TC组、TCZ组、T组。T组和TC组Bax/Bcl-2mRNA表达水平比值、Caspase-8和Caspase-3mRNA表达水平均显著上调,T组和TC组Bax/Bcl-2和cleaved Caspase-3蛋白表达水平显著上升,表明T组和TC组可诱导小鼠乳腺上皮细胞发生凋亡,其中TC组诱导较高水平的凋亡。
通常情况下,TNF-α与细胞膜受体TNFR1结合并诱导复合物Ⅰ形成,复合物Ⅰ中的RIP1泛素化可激活NF-κB途径,进而调控细胞的生长与存活;但在某些病理条件下,RIP1会去泛素化,进而诱导复合物Ⅱa的形成并激活复合物Ⅱa中的Caspase-8,从而激活凋亡途径并诱导细胞凋亡,而活化的Caspase-8也会阻止其形成复合物Ⅱb;然而,当Caspase-8或FADD被抑制时,它会转向诱导程序性坏死的发生[17-20]。RIP1 和RIP3相互磷酸化形成RIP1/3复合物Ⅱb,MLKL平常主要分布在细胞质、线粒体相关膜部位和细胞质膜等部位,被RIP1/3复合物Ⅱb招募后,MLKL磷酸化并形成寡聚体,转移到细胞膜并激活离子通道,促进细胞发生程序性坏死[21-23]。透射电镜可以观察细胞的超微结构变化,进而判断细胞的死亡类型,这是目前判断细胞死亡类型的金标准[9]。在本试验中,为了验证Caspase-8是否在细胞凋亡或程序性坏死过程中发挥“主开关”的作用,首先我们用透射电镜观察到TCZ组细胞内出现空泡、线粒体肿胀、断裂等坏死细胞所具有的细胞超微结构变化;检测细胞程序性坏死相关基因和蛋白表达水平,结果发现与对照组相比,TCZ组Caspase-8的mRNA水平显著降低,TC组和TCZ组RIP3、MLKLmRNA表达水平显著上升,但只有TCZ组程序性坏死标志蛋白MLKL和p-MLKL表达量显著上升,表明100 ng·mL-1TNF-α+4 μmol·L-1CHX+20 μmol·L-1Z-VAD-FMK混合物可成功诱导小鼠乳腺上皮细胞程序性坏死。
值得注意的是,本研究结果中TNF-α可能主要以细胞凋亡和随后晚期凋亡的方式诱导细胞死亡,CHX仅抑制细胞内蛋白质的合成但不改变细胞死亡的方式[24],因此,TC诱导更加严重的细胞凋亡,而TCZ主要诱导程序性坏死。而且TCZ还可以在一些细胞中诱导细胞凋亡,这表明细胞凋亡和程序性坏死可能同时发生,并且程序性坏死甚至可以在特定条件下转化为细胞凋亡[25]。如果是线粒体途径引起的细胞凋亡,Caspase家族抑制剂如Z-VAD-FMK不能阻止哺乳动物细胞凋亡。相反,死亡受体激活引起的细胞凋亡完全可以被Caspase家族抑制剂挽救[21]。在本研究中,与TC组相比,添加Z-VAD-FMK后细胞活力显著上升,表明Z-VAD-FMK可部分挽救小鼠乳腺上皮细胞免受TC诱导的细胞凋亡,转而导致程序性坏死。这被认为是当细胞凋亡受到抑制时,程序性坏死起决定性作用的证据。
PGAM5是一种线粒体磷酸酶,是MLKL的下游效应基因,在程序性坏死的发生中可能起到重要作用。有研究表明,敲除PGAM5基因可以减弱细胞程序性坏死发生,通过抑制PGAM5S与RIP3-MLKL-PGAM5S的相互作用会影响细胞程序性坏死[13]。诱导坏死后,PGAM5去磷酸化并激活GTPase活性,进而募集线粒体裂变蛋白Drp1,使Drp1的637位(丝氨酸)磷酸化,造成线粒体整体结构被破坏,具体表现为线粒体肿胀断裂和片段化,最终造成细胞程序性坏死的发生[26-27]。在本试验中,与对照组相比,TC组和TCZ组PGAM5mRNA表达水平显著升高,TCZ组PGAM5蛋白表达水平显著升高。Drp1介导的线粒体断裂似乎是凋亡和坏死的必需步骤[13]。在本试验中,与对照组相比,TC组和TCZ组Drp1的mRNA和蛋白表达水平均显著升高。在细胞凋亡过程中,线粒体片段化可能会改变线粒体外膜通透性,导致细胞色素c释放和Caspase家族激活。然而在TNF诱导的程序性坏死过程中细胞色素c不会释放[28],线粒体碎片在细胞核周围聚集,导致核膜和细胞质膜的破坏,即坏死的末期[13],这提示线粒体断裂后的下游事件在凋亡和坏死之间可能有所不同。目前,由Drp1介导的线粒体片段如何导致坏死尚不清楚。线粒体破碎可能会减少能量产生,增加ROS生成或激活尚未定义的下游坏死执行步骤。因此,阐明PGAM5和Drp1的坏死下游途径仍然是很大的挑战。
总之,本研究揭示了TNF-α在Caspase-8激活和抑制的条件下可分别诱导小鼠乳腺上皮细胞的凋亡和程序性坏死。我们首次证明程序性坏死参与调节TNF-α和环己酰亚胺诱导的小鼠乳腺上皮细胞死亡过程,且线粒体裂变后的下游事件可能会决定细胞的死亡方式。因此,更好地了解RIP3-MLKL-PGAM5-Drp1介导的程序性坏死分子途径并研发其关键靶点抑制剂,可能是预防和治疗奶牛临床急性乳腺炎的有效方法。
