MDC1和MMR蛋白在子宫内膜癌中的表达及临床意义
2022-01-25辛礼辉田云霄吴士茜郑神英
辛礼辉,田云霄,吴士茜,孙 颖,王 静,郑神英
(邯郸市中心医院病理科,河北 邯郸 056000)
子宫内膜癌是常见的妇科恶性肿瘤之一,其发病率及病死率逐年升高且呈年轻化趋势[1]。大部分子宫内膜癌临床症状典型,表现为阴道不规则出血、阴道排液等,早期易发现,但对于复发、晚期或特殊病理类型的子宫内膜癌,目前尚缺乏有效的治疗手段。近年来,靶向药物在各类肿瘤的治疗中均有较好的效果,但其在妇科肿瘤中的研究相对滞后[2]。具有DNA损伤反应(DNA damage response,DDR)缺陷的肿瘤可以采用多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂替代治疗[3]。研究表明,DNA损伤检查点蛋白调节子1(mediator of DNA damage checkpoint protein 1,MDC1)在早期DNA损伤修复和细胞信号传递中发挥重要作用[4]。DNA错配修复(mismatch repair,MMR)途径可以识别和纠正DNA复制过程中产生的非沃森—克里克碱基对和插入/缺失环[5]。MMR去除在重组过程以及DNA的化学修饰过程中出现的碱基对错配和分支DNA中起到重要作用[6]。因此,本研究通过检测MDC1和MMR蛋白表达,分析其与子宫内膜癌患者临床病理特征的关系,以期为该病的临床治疗提供一定依据。
1 资料和方法
1.1 临床资料
选取2012年至2016年我院病理科收治的126例子宫内膜癌患者的手术或刮宫标本,收集患者的临床及病理资料,包括年龄、组织学类型、临床分期、组织学分级、肌层浸润深度等。患者年龄30~76岁,中位年龄58岁;术后随访5~67个月,中位时间58个月。纳入标准:术前均未接受新辅助化疗,术后证实为子宫内膜癌。排除标准:合并其他恶性肿瘤。
1.2 试剂
MDC1抗体购自abcam公司(1∶300稀释);MMR蛋白相关抗体,包括减数分裂后分离蛋白2(postmeiotic segregation increased 2,PMS2)、鼠抗人MutL同源蛋白1(MutL homolog 1,MLH1)、MutS同源蛋白2(MutS homolog 2,MSH2)、MutS同源蛋白6(MutS homolog 6,MSH6),辣根过氧化物酶标记鼠兔专用抗体,磷酸盐缓冲液(phosphate buffered saline,PBS),DAB显色液,苏木精等均购自福州迈新生物科技公司;石蜡组织标本均由我院病理科提供。
1.3 免疫组化染色和HE染色
选取组织蜡块作厚度4 μm连续切片,分别行免疫组化染色和HE染色,免疫组化染色严格按照试剂盒说明书操作,PBS代替一抗作为阴性对照试剂,淋巴细胞或间质细胞作为内对照。HE染色采用莱卡全自动染色机严格按流程操作。以细胞核内出现明确棕黄色颗粒为阳性细胞,随机选取5个高倍视野(×400),计算MDC1、MMR(MLH1、MSH2、MSH6、PMS2)蛋白阳性细胞率。细胞核中MLH1、MSH2、MSH6、PMS2阳性表达均出现棕黄色着色(且阳性率≥5%),即判断为MMR表达完整(MMR-proficient,MMR-p);若有1种或几种抗体出现阴性表达(阳性率<5%),则判定为MMR表达缺失(MMR-deficient,MMR-d)。细胞核中MDC1阳性表达出现棕黄色颗粒(且阳性率≥5%),即判为阳性,否则为阴性。由我院病理科3名医师阅片判读结果,如有争议则于多头显微镜下共同讨论。分析MDC1、MMR蛋白表达及结合两种蛋白不同表达与患者临床特征的关系,采用Kaplan-Meier法绘制生存曲线图分析MDC1和MMR蛋白联合检测与总生存率的关系,并分析MDC1与MMR蛋白表达的相关性。
1.4 统计学处理
采用SPSS 22.0 IBM软件进行统计学分析,计量资料组间比较采用t检验,多组间比较采用方差分析,等级资料采用秩和检验;定性资料采用χ2或Fisher精确检验;生存分析采用Kaplan-Meier法,行Log-Rank检验;相关性分析采用Spearman秩相关性分析。检验标准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 MDC1、MMR蛋白表达与临床特征的关系
126例患者中,MDC1阴性表达12例,MDC1阳性表达114例。与MDC1阳性表达患者相比,MDC1阴性表达患者年龄较小,主要为低级别(1~2级)子宫内膜样腺癌(P<0.05);MDC1阴性表达患者与MDC1阳性表达患者临床分期、肌层浸润深度比较,差异均无统计学意义(P>0.05)。与MMR-p患者相比,MMR-d患者年龄较小,主要为低级别(1~2级)子宫内膜样腺癌(P<0.05);MMR-p患者与MMR-d患者临床分期、肌层浸润深度比较,差异均无统计学意义(P>0.05),见表1。
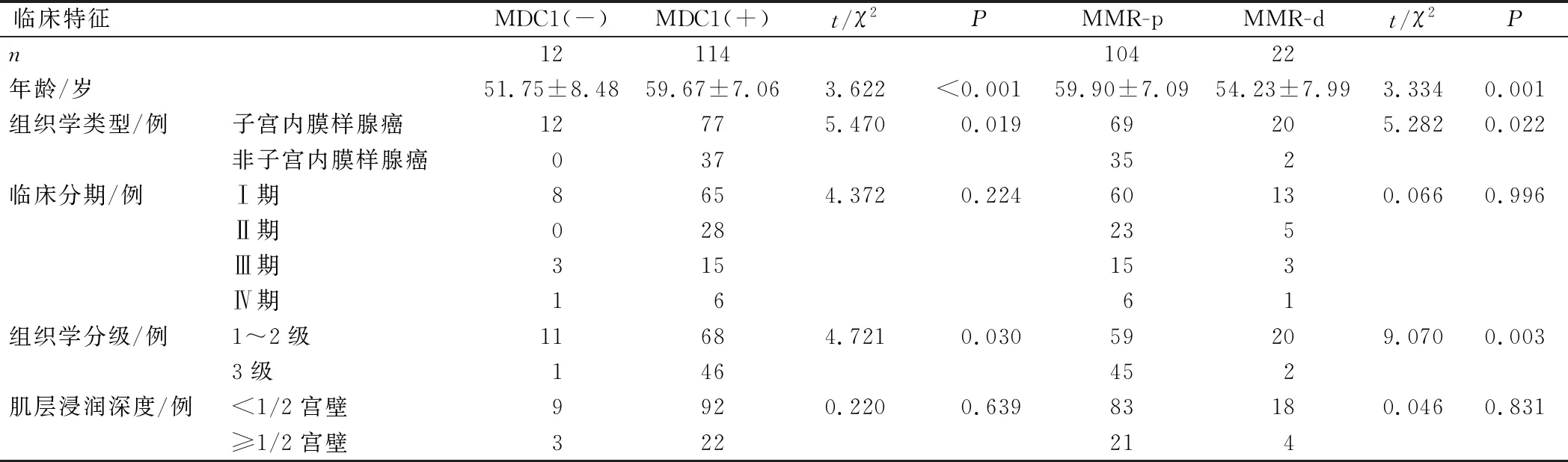
表1 MDC1、MMR蛋白表达与临床特征表达的关系
2.2 MDC1与MMR蛋白不同表达结合与临床特征的关系
MDC1与MMR蛋白表达配对分组:MDC1(+)/MMR-p有102例,MDC1(-)/MMR-p有2例,MDC1(+)/MMR-d有12例,MDC1(-)/MMR-d有10例。各组患者年龄、组织学类型、组织学分级比较,差异有统计学意义(P<0.05);而临床分期、肌层浸润深度比较,差异无统计学意义(P>0.05),见表2。
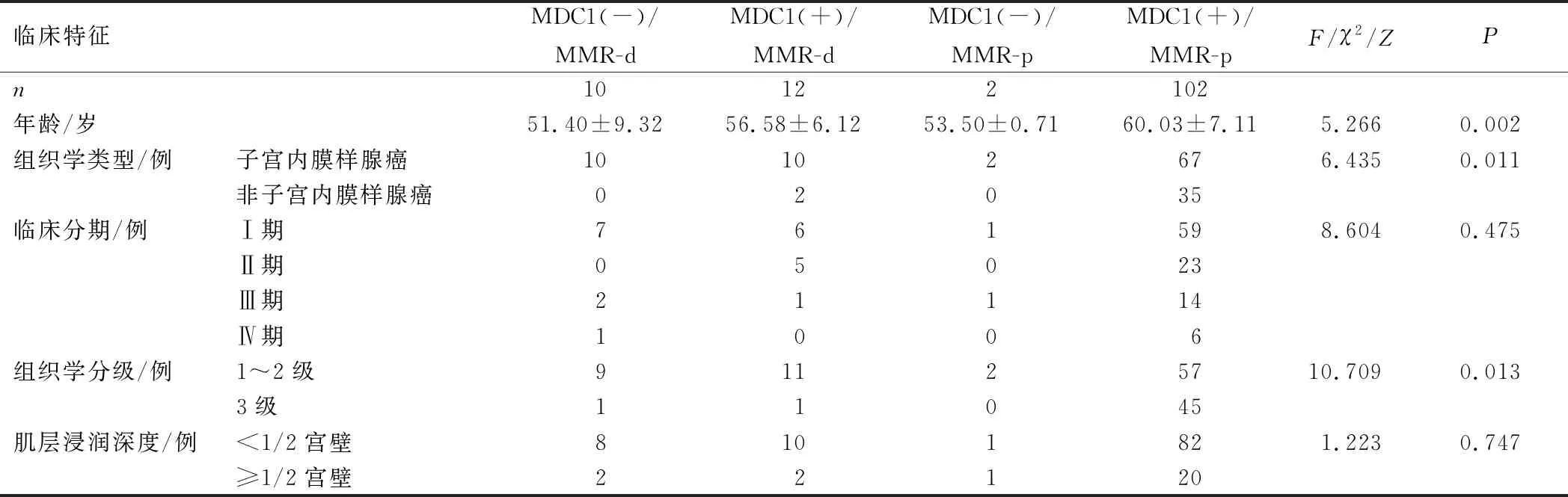
表2 MDC1与MMR蛋白不同表达结合与临床特征的关系
2.3 MDC1、MMR蛋白联合检测的生存分析
126例患者中,45例复发或死亡,其中MDC1(+)/MMR-p有36例,MDC1(-)/MMR-p有1例,MDC1(-)/MMR-d有2例,MDC1(+)/MMR-d有6例。总体生存曲线显示,MDC1、MMR蛋白联合检测与总生存率无关(Log-Rank=0.976,P=0.807),见图1。
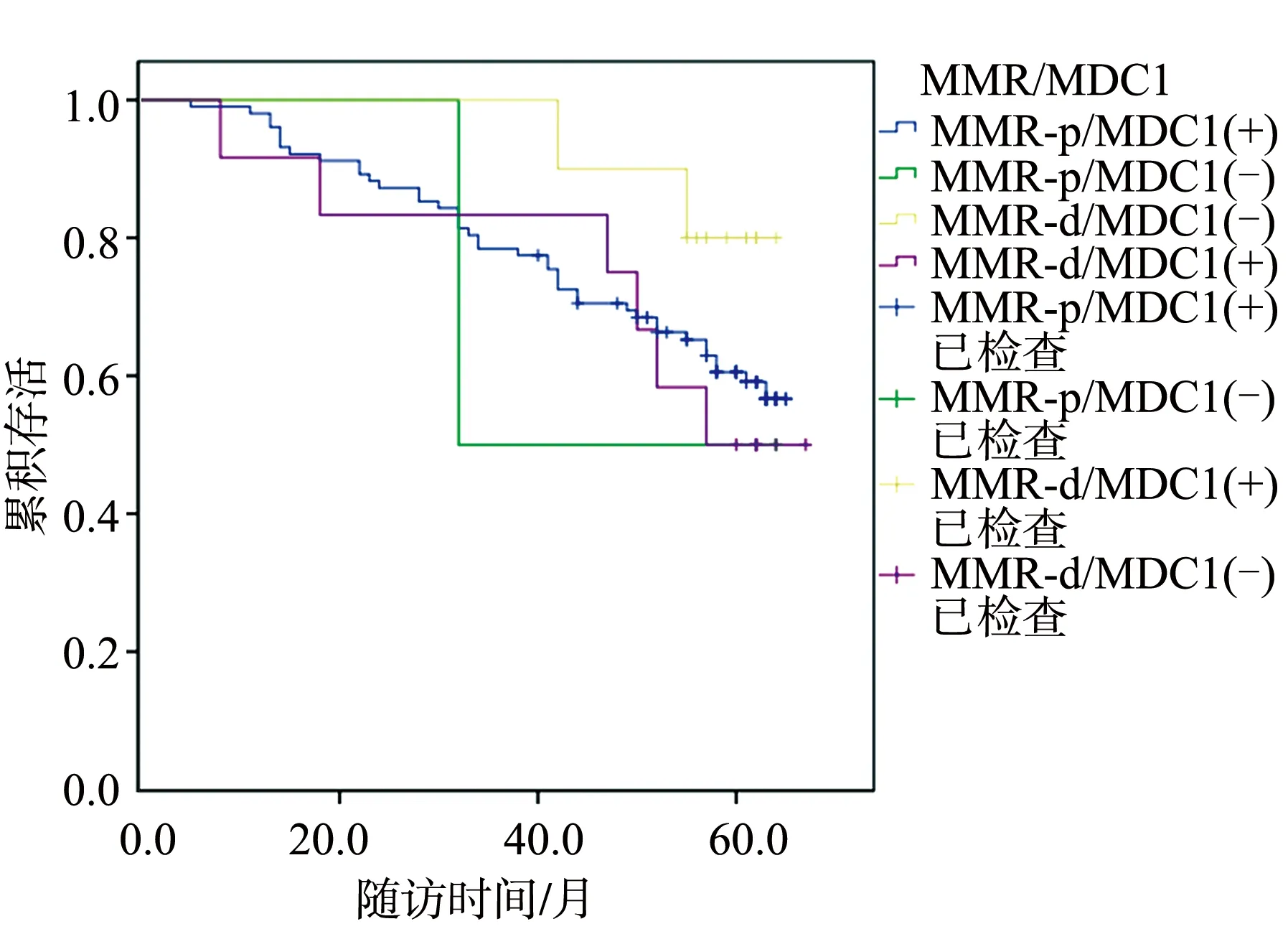
图1 患者总体生存曲线
2.4 MDC1与MMR蛋白表达及其相关性分析
126例患者中,MDC1阴性表达12例;MDC1阳性表达114例,其中强阳性表达82例,占子宫内膜样腺癌的60%(53/89),占非子宫内膜样腺癌的78%(29/37),弱阳性表达32例,占子宫内膜样腺癌的27%(24/89),占非子宫内膜样腺癌的22%(8/37),见图2。MMR蛋白阴性表达22例,其中PMS2阴性表达6例,PMS2、MLH1阴性表达10例,PMS2、MSH2阴性表达1例,MSH6阴性表达3例;MSH2、MSH6阴性表达2例;MMR蛋白阳性表达104例。相关性分析结果显示,MDC1阴性表达与MMR-d呈正相关(r=0.563,P<0.001)。
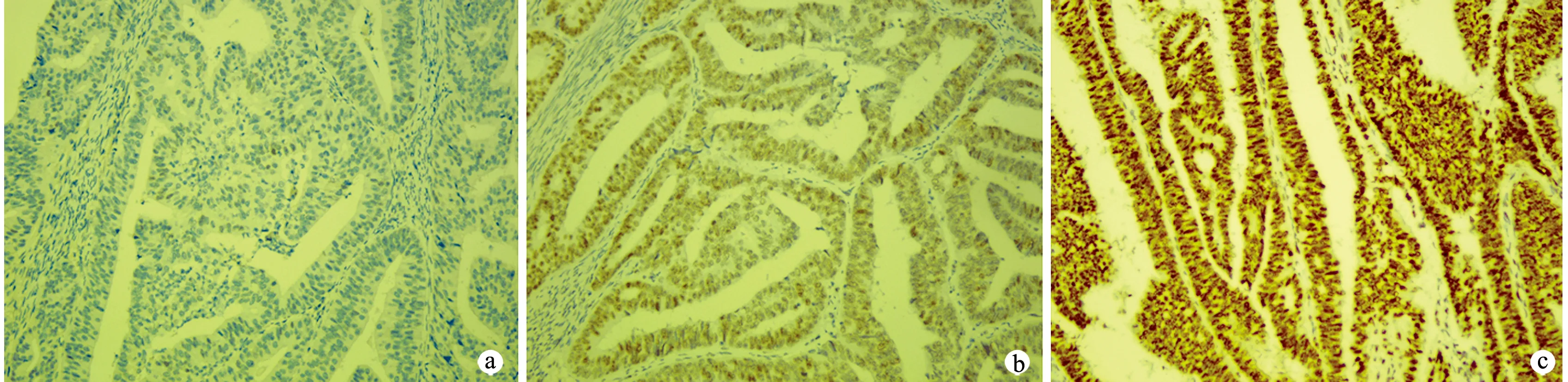
a:MDC1阴性表达;b:MDC1弱阳性表达;c:MDC1强阳性表达
3 讨论
Bokhman[7]于1983年首次提出“二元论”假说,并将子宫内膜癌分为雌激素依赖型(Ⅰ型)和非雌激素依赖型(Ⅱ型)。Ⅰ型包括大部分的子宫内膜样腺癌,Ⅱ型包括3级子宫内膜样腺癌、浆液性腺癌与透明细胞癌等非子宫内膜样腺癌。随着对肿瘤分子机制的深入研究,许多学者开始对子宫内膜癌不同组织学类型的分子改变进行研究。癌症基因组图谱根据拷贝数和基因组图谱将373例子宫内膜癌分为DNA聚合酶ε(polymerase epsilon,POLE)超突变型、微卫星不稳定高突变型、高拷贝数型和低拷贝数型[8]。大部分子宫内膜样腺癌为微卫星不稳定高突变型,其存在其他基因突变(高突变基因组),DNA双链断裂修复机制基因就是其中之一[9]。MDC1通过非同源末端连接反应和同源重组途径在DNA双链断裂修复机制中发挥重要作用[10]。MMR机制、PI3K-PTEN-AKT途径以及P53途径的信号转导缺陷对子宫内膜癌的发生、发展有重要影响[11]。因此,本研究探讨MDC1和MMR蛋白在子宫内膜癌中的表达情况及其与相关临床特征的关系。
MDC1作为DNA损伤早期效应物,是DNA双链断裂同源重组修复的重要物质[4]。研究发现,MDC1突变的小鼠会出现对辐射敏感、染色体不稳定、免疫缺陷等各种失调[12]。Bartkova等[13]发现,在正常乳腺组织和肺组织中MDC1普遍表达,但在乳腺癌细胞中30%的MDC1失表达,肺癌细胞中26%的MDC1失表达,并且与其下游效应分子53BP1表达一致。但Yuan等[14]的研究显示,60%宫颈癌患者的MDC1表达上调。同样,MDC1在喉癌肿瘤组织中的阳性表达率为56%,但其在正常组织中的阳性表达率仅为27%[15]。有研究表明,乳腺癌组织中MDC1的表达缺失与肿瘤的浸润转移、临床分期有关[16]。本研究发现,9.5%(12/126)的子宫内膜癌患者MDC1表达为阴性,均为子宫内膜样腺癌,该类患者平均年龄较MDC1阳性表达患者小,且MDC1阳性表达患者出现强弱不等,强阳性表达患者占非子宫内膜样腺癌的78%(29/37),而占子宫内膜样腺癌的60%(53/89);弱阳性表达患者占非子宫内膜样腺癌的22%(8/37),占子宫内膜样腺癌的27%(24/89)。阴性表达患者全部为子宫内膜样腺癌,提示MDC1失表达可能与组织学分级相关,并且与子宫内膜样腺癌密切相关;但MDC1不同表达在临床分期和肌层浸润深度中差异无统计学意义,提示MDC1失表达可能与子宫内膜癌的浸润和转移无关。
MMR蛋白表达缺失可导致DNA碱基配对无法校正,引起具有微卫星短串联重复序列长度改变,导致微卫星不稳定。有研究发现,MMR蛋白免疫组化结果与微卫星不稳定检测结果高度一致[17]。且免疫组化检测操作简单,可在病理科进行。有研究表明,MMR-d型子宫内膜癌常为高级别子宫内膜样腺癌,突变率高,患者预后不良[18-19]。但也有研究发现,MMR-d型子宫内膜癌患者预后较好[20]。本研究结果显示,MMR-d型子宫内膜癌占所有子宫内膜癌患者的17.4%,而其中90.9%为子宫内膜样腺癌,组织学分级低,可能是由入组的子宫内膜样腺癌患者的比例偏大造成;其中PMS2阴性表达6例,PMS2、MLH1阴性表达10例,PMS2、MSH2阴性表达1例,MSH6阴性表达3例,MSH2、MSH6阴性表达2例,与国外Cohn等[21]的研究结果不一致,该研究中MSH2表达缺失率最高;但与国内晋薇等[22]研究结果一致,该研究结果显示,PMS2表达缺失率最高,其次为MLH1。造成这种差异的原因可能与种族、选取入组的子宫内膜癌类型的比例、患者入院时的临床分期等有关。有研究表明,MMR-d型子宫内膜癌具有不同的治疗方式和预后,对铂类药物抵抗[23]。因此,本研究采用免疫组化法筛选出具有MMR-d表型的子宫内膜癌,研究MMR-d型子宫内膜癌与MDC1表达的关系,以期为MMR-d型子宫内膜癌患者的治疗提供新的理论依据。本研究结果显示,MMR-d与患者的肌层浸润深度和临床分期无关,提示MMR蛋白在子宫内膜癌预后评估中可能需要结合其他指标共同判断,与何亚等[24]的报道一致。
MDC1表达下调可影响DNA损伤修复,从而影响同源重组[25]。有研究发现,存在同源重组DNA修复机制缺陷的肿瘤对PARP抑制剂敏感[26]。而子宫内膜癌是携带高同源重组突变基因的一类肿瘤[2]。磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)参与机体的同源重组修复,其在子宫内膜样腺癌中常失表达,使肿瘤细胞对PARP治疗更加敏感。在体外实验和临床上,具有生殖细胞BRCA1/2基因功能缺陷的实体肿瘤采用PARP抑制剂治疗可使患者获益[27]。研究表明,MDC1低表达的鼻咽癌联合PARP抑制剂治疗,可提高对奥拉帕尼的敏感性[25]。本研究中MDC1在部分患者中失表达或弱表达,提示子宫内膜癌细胞中可能存在同源重组DNA修复机制缺陷,而存在同源重组DNA修复机制缺陷的肿瘤对PARP抑制剂敏感[26],因此MDC1的检测可能对临床晚期、复发或特殊病理类型的子宫内膜癌的治疗选择有益,有待后续实验进一步验证。
本研究结果显示,MDC1、MMR蛋白联合检测结果与患者总生存率无关,可能是纳入的样本量小所致,需进一步扩大样本量进行验证;但在联合检测过程中发现,MDC1阴性表达和MMR-d呈正相关,提示MDC1和MMR蛋白在DNA损伤修复中可能起到相互协助的作用,同时MDC1的表达可能与子宫内膜癌的微卫星不稳定性有关。
综上所述,MDC1和MMR蛋白多在年轻患者及低级别子宫内膜样腺癌中失表达,但与临床分期及肌层浸润深度无明显相关性;MDC1阴性表达和MMR-d呈正相关,提示MDC1的失表达与子宫内膜癌微卫星不稳定性密切相关。