复合CTLA4的脱钙骨基质抑制T淋巴细胞免疫能力和增强骨髓间充质干细胞迁移能力的体外作用研究
2022-01-25宋磊,周锐,何磊,肖军,代飞
宋 磊,周 锐,何 磊,肖 军,代 飞
(1.陆军军医大学第一附属医院骨科,重庆 400038;2.火箭军广州特勤疗养中心特勤生理训练科,广东 广州 515515)
因创伤、感染、肿瘤、骨坏死及先天畸形等多种疾病引起的骨缺损在临床上较为常见,但治疗仍较为困难。近年来,骨组织工程的发展为骨缺损的修复开辟了新的途径,其中支架材料是骨组织工程研究的关键[1]。尽管支架材料在基础研究方面取得了较大进展,但在大规模临床应用中仍存在许多需要解决的问题,如慢性炎症反应和异物反应导致的骨修复失败等[2]。通过人工引入免疫调控因子将有可能克服支架材料带来的不利因素,营造有利于成骨的骨免疫微环境。细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated protein 4,CTLA4)是一种T淋巴细胞表面蛋白,作为一类免疫抑制因子,对激活T淋巴细胞具有负性调控的作用[3]。研究发现,在体外免疫激活的环境下,过表达CTLA4可以显著提高骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)的成骨分化能力[4]。体内实验表明,与脱钙骨基质(demineralized bone matrix,DBM)复合的CTLA4修饰的BMMSCs成骨分化能力明显增强[4-5]。另外,通过对相关机制的研究发现,在免疫激活环境下,CTLA4可通过促进BMMSCs中骨膜蛋白(periostin,POSTN)和促红细胞生成素肝细胞受体B4(erythropoietin-producing hepatocellular receptor B4,EphB4)的表达增强BMMSCs的成骨分化能力[4-5],且CTLA4修饰的BMMSCs可以在免疫激活环境下增强异体BMMSCs的迁移能力[6]。这些研究结果提示,CTLA4修饰的BMMSCs具有免疫调控作用。但是目前异体间充质干细胞(mesenchymal stem cells,MSCs)移植治疗在临床中的安全性及有效性尚无明确定论,导致其在临床上的推广应用受限。另外,构建携带异体MSCs的组织工程骨由于受细胞培养时间及无菌环境要求的限制,不能很好地满足战场环境大批量伤员及时救治的需要。因此,我们提出新的构想:去除异体MSCs这一因素,构建复合CTLA4的新型骨移植修复材料。本文通过分析复合CTLA4的DBM对T淋巴细胞免疫能力和BMMSCs迁移能力的体外调控作用,以期为该新型骨移植修复材料的临床应用提供理论基础。
1 材料与方法
1.1 材料
猪源纤维蛋白凝胶(广州倍绣生物)、人CTLA4蛋白(Abbexa)、DBM(北京鑫康辰)、植物血凝素(PHA,SIGMA)、EasySep人外周血单核细胞(peripheral blood mononuclear cells,PBMCs)全血直接分选试剂盒(上海珞焱生物)、Human IL-2 Quantikine ELISA Kit(R&D Systems)、Human IFN-γ Quantikine ELISA Kit(R&D Systems)、Cell Counting Kit-8试剂盒(日本同仁化学)、Transwell小室(Corning)、24孔细胞培养板(Corning)、RPMI1640和胎牛血清(Gibco)。
1.2 方法
1.2.1 复合CTLA4的DBM的制备 制备纤维蛋白凝胶复合CTLA4溶液,CTLA4浓度为100 μg/mL。将DBM制成直径12 mm、厚度5 mm的圆片,使用前高温灭菌。通过特殊负压灌注装置(专利号:ZL201320058080.7)构建复合CTLA4的DBM。按照常规方法进行扫描电镜样品的制备,观察复合CTLA4的DBM的微观形态。
1.2.2 PBMCs分离 抽取健康成人(志愿者)外周血10 mL,置于含有3 000 U肝素的50 mL离心管中;按照EasySep人PBMC全血直接分选试剂盒的方法步骤进行PBMCs分离;最后用RPMI1640+10%胎牛血清培养基重悬PBMCs,计数备用。
1.2.3 T淋巴细胞免疫激活诱导 在体外利用植物血凝素(phytohaemagglutinin,PHA)20 μg/mL激活PBMCs中的T淋巴细胞,构建免疫激活微环境。
1.2.4 CTLA4蛋白缓释实验 将制备的复合CTLA4的DBM依次放入24孔细胞培养板中,加入约1 mL的RPMI1640细胞基础培养基。放置于细胞培养箱中,分别于5、10、20、30、40 d后取约200 μL的培养基,通过ELISA检测培养基中CTLA4的浓度。根据以下公式计算CTLA4的累积释放率:CTLA4的累积释放率=(培养基中CTLA4的浓度×1 mL)/复合DBM中的CTLA4总量×100%。
1.2.5 ELISA检测IL-2和IFN-γ的表达 按照如下条件进行分组,构建Transwell共培养模型。DBM组:在Transwell下室接种PBMCs,PHA预处理24 h后,在上室加入不复合CTLA4的DBM,共培养12 h后,收集下室细胞培养基。CTLA4+DBM组:在Transwell下室接种PBMCs,PHA预处理24 h后,在上室加入复合CTLA4的DBM,共培养12 h后,收集下室细胞培养基。ELISA检测:按照Human IL-2 Quantikine ELISA Kit和Human IFN-γ Quantikine ELISA Kit的方法检测IL-2和IFN-γ在上述培养基中的含量。
1.2.6 BMMSCs增殖能力分析 参照本研究小组以往的实验方法分离BMMSCs[7-8]。将600 μL含1×105BMMSCs的细胞悬液加入到Transwell下室,上室中加入复合CTLA4的DBM或不复合CTLA4的DBM,并加入200 μL含10%胎牛血清的培养基,置于37 ℃培养箱中孵育,分别于2 d和3 d后按照CCK8试剂盒说明书测定每组样品的吸光度(optical density,OD)值,测定波长为450 nm。
1.2.7 BMMSCs迁移能力分析 将100 μL含1×104BMMSCs的细胞悬液加入到Transwell上室,下室中加入复合CTLA4的DBM或不复合CTLA4的DBM,并加入600 μL含20%胎牛血清的培养基,置于37 ℃培养箱中孵育24 h后,取出Transwell小室,用PBS洗2次,5%戊二醇固定,加入0.5%结晶紫染色液染色5 min,PBS洗2次,用棉花球擦去上表面未穿过的细胞,显微镜下观察穿过的细胞,计数5个200倍镜视野下细胞的数量,取平均值作为每组的迁移细胞数。
1.3 统计学分析
2 结果
2.1 复合CTLA4的DBM的电镜形态
制备的复合CTLA4的DBM结构完整有序,具有良好的三维网络结构(图1)。

图1 复合CTLA4的DBM的扫描电镜形态图
2.2 CTLA4蛋白累积释放率
复合CTLA4的DBM在培养基中孵育5、10、20、30、40 d后,CTLA4的累积释放率分别为(11.3%±1.9%)、(27.9%±3.7%)、(48.4%±3.6%)、(62.8%±3.8%)和(83.0%±2.5%),见图2。
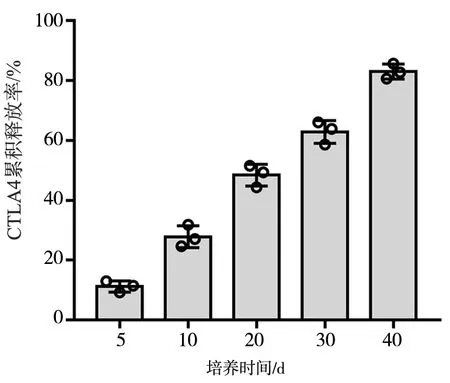
图2 复合CTLA4的DBM的CTLA4累积释放率
2.3 复合CTLA4的DBM对IL-2和IFN-γ表达的影响
DBM组培养基中IL-2的含量为(292.0±12.3)pg·mL-1,CTLA4+DBM组培养基中IL-2的含量为(187.0±11.0)pg·mL-1,二者比较差异有统计学意义(P=0.000 4)。DBM组培养基中IFN-γ的含量为(525.3±23.1)pg·mL-1,CTLA4+DBM组培养基中IFN-γ的含量为(387.0±11.0)pg·mL-1,二者比较差异有统计学意义(P=0.000 7),见图3。与单纯的DBM相比,复合CTLA4的DBM共培养可显著减少培养基中IL-2和IFN-γ的含量。
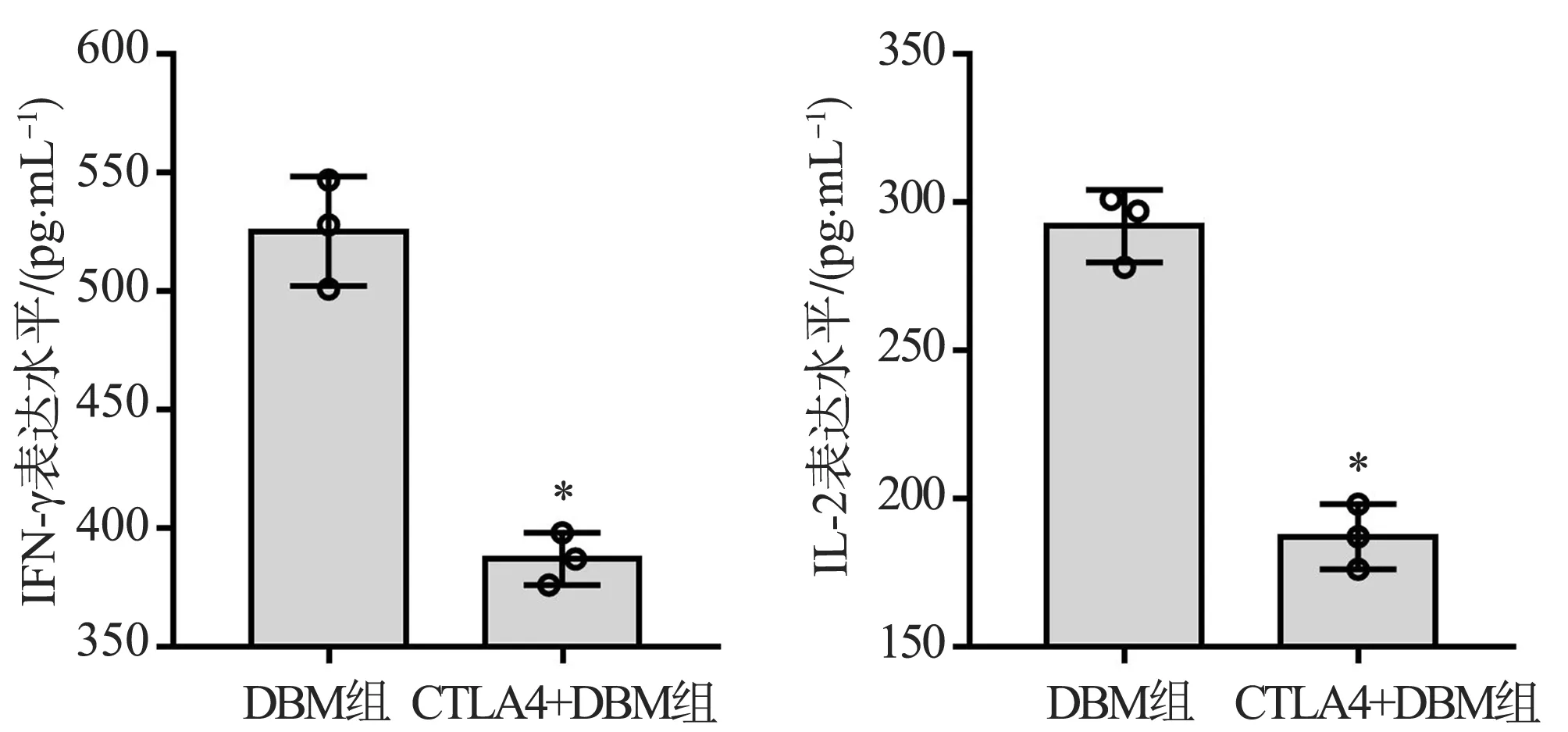
*:与DBM组比较,P<0.05
2.4 复合CTLA4的DBM对BMMSCs增殖能力的影响
共培养2 d时,DBM组的OD值为(0.71±0.05),CTLA4+DBM组的OD值为(1.12 ±0.07),二者比较差异有统计学意义(P=0.003 1);共培养3 d时,DBM组的OD值为(0.95±0.04),CTLA4+DBM组的OD值为(1.59±0.05),二者比较差异有统计学意义(P=0.000 6),见图4。与单纯的DBM相比,复合CTLA4的DBM共培养可显著增强BMMSCs的增殖能力。
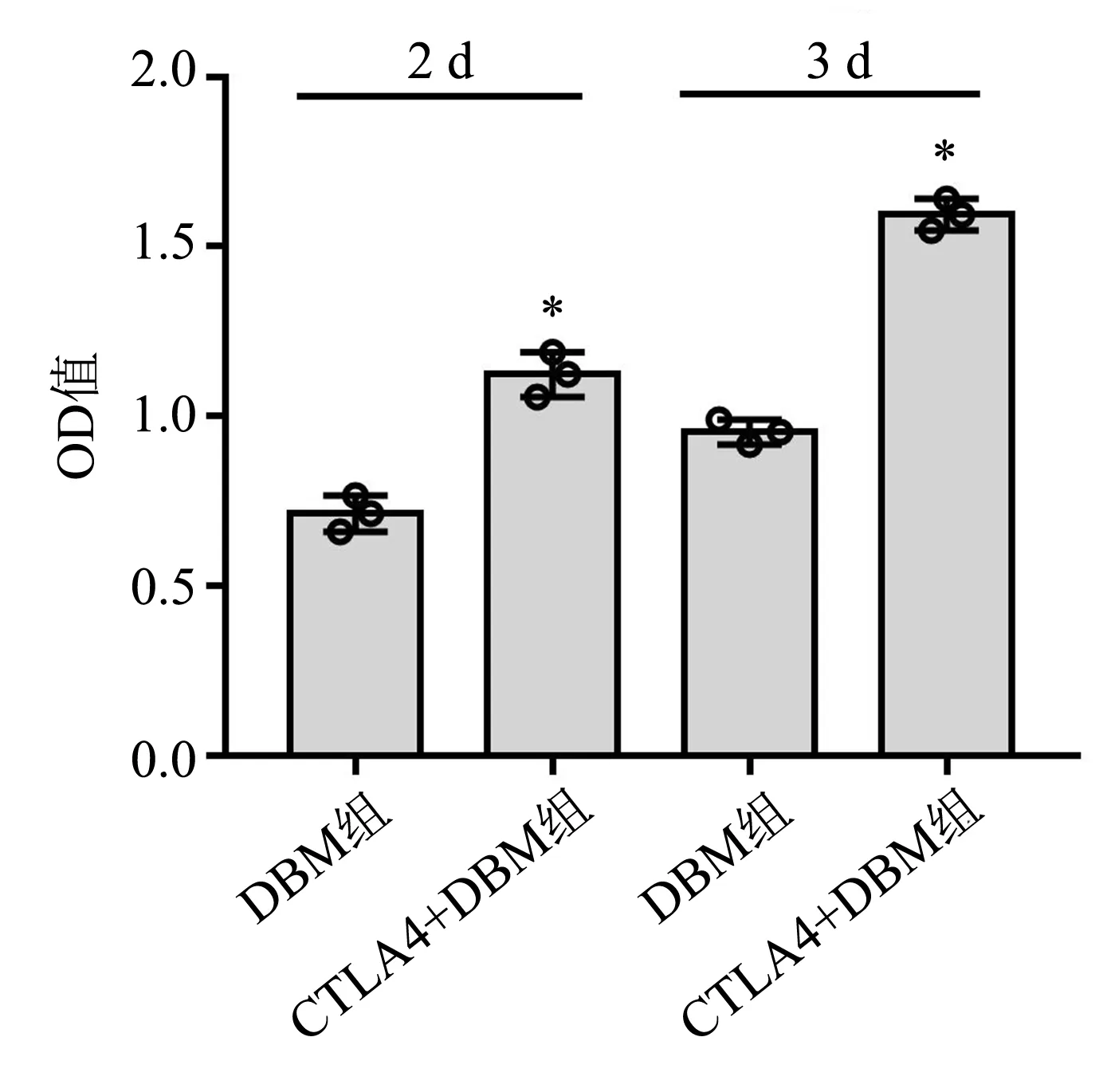
*:与DBM组比较,P<0.05
2.5 复合CTLA4的DBM对BMMSCs迁移能力的影响
DBM组迁移细胞数为(17.3±2.5)个,CTLA4+DBM组迁移细胞数为(56.0±5.6)个,二者比较差异有统计学意义(P=0.000 4),见图5。与单纯的DBM相比,复合CTLA4的DBM共培养可显著增强BMMSCs的迁移能力。
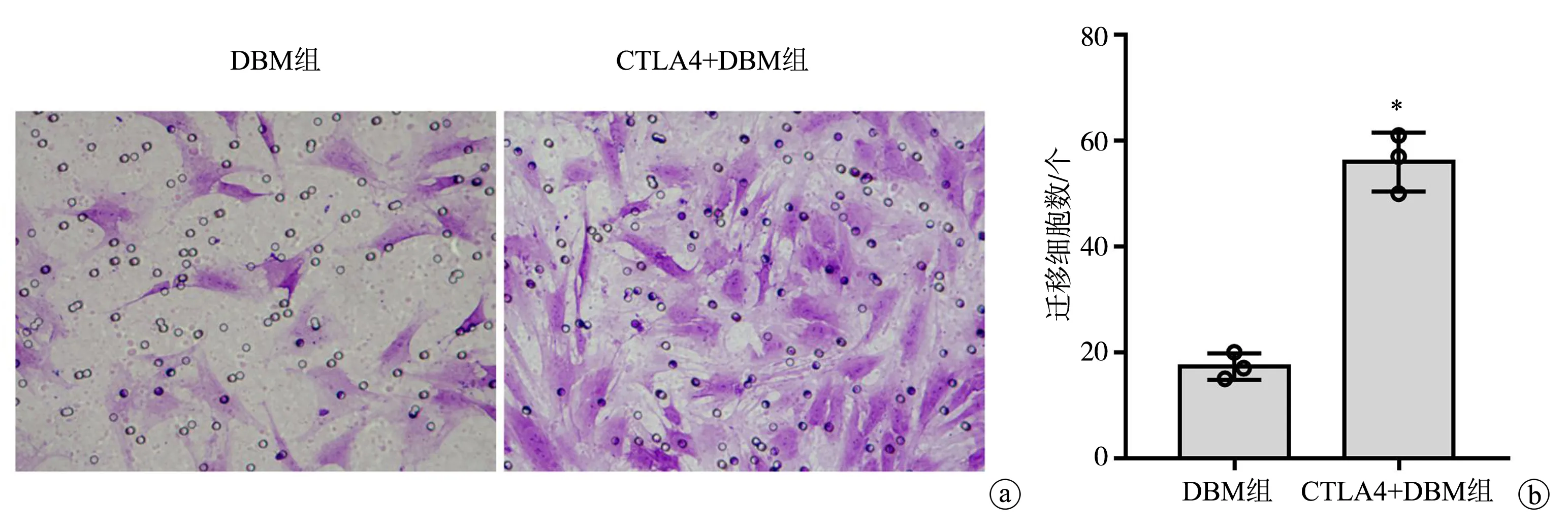
a:显微镜下迁移细胞数(×200);b:迁移细胞数统计结果 *:与DBM组比较,P<0.05
3 讨论
目前,对于异体MSCs移植治疗在临床中的安全性及有效性尚无明确定论,导致其在临床上的推广运用十分受限[9-10]。与此同时,考虑到在战场环境中需要及时大批量的进行伤员救治,而构建携带异体MSCs的组织工程骨由于受细胞培养时间及无菌环境要求的限制,不能很好地满足战场救治的需要。有研究提示,作为免疫负调控因子的CTLA4可能具备骨微环境免疫调控的能力[11]。因此,本研究去除异体MSCs这一因素,通过将CTLA4复合于DBM中,以此来构建复合CTLA4的新型组织工程骨,以期优化骨免疫微环境,营造有利的成骨微环境,解决骨支架材料存在的“骨微环境调控缺陷”[12]。
本研究发现,复合CTLA4的DBM具有CTLA4缓释的特点,在长达40 d的孵育过程中,CTLA4一直有缓慢的释放。相比携带异体MSCs的组织工程骨,该材料更加易于保存和运输,有更加广阔的应用前景。
免疫反应与骨再生的过程密切相关。免疫细胞是骨再生微环境的中心调控者,其创造的免疫微环境对成骨与破骨活动具有显著影响,在骨再生过程中发挥了关键作用[13]。T淋巴细胞是免疫系统的重要成员。IL-2是促进T淋巴细胞增殖和分化的关键分子,被称作T淋巴细胞生长因子[14-15]。本研究结果显示,复合CTLA4的DBM对IL-2的表达具有抑制作用,说明复合CTLA4的DBM对T淋巴细胞的活化具有抑制作用。在干细胞促骨形成方面,促炎的T淋巴细胞通过IFN-γ降低干细胞内Runx-2通路并增强TNF-α信号,抑制外源性BMMSCs介导的骨修复能力[16-17]。本研究结果显示,复合CTLA4的DBM可以抑制T淋巴细胞分泌IFN-γ,说明CTLA4可以改善DBM的成骨免疫微环境,促进成骨。去除MSCs这一因素,重组CTLA4蛋白仍可发挥免疫抑制的作用。因此,重组CTLA4蛋白有可能替代CTLA4修饰的MSCs成为新的组织工程骨成骨效能优化因子。
我们前期的研究表明,即使在免疫激活的微环境下,过表达CTLA4的BMMSCs的成骨能力仍明显增强[4],且能增强异体BMMSCs的迁移能力,提示过表达CTLA4的BMMSCs可能具有诱导宿主干细胞归巢的能力[6]。本研究结果显示,复合CTLA4的DBM能增强BMMSCs的迁移能力。提示去除MSCs这一因素,重组CTLA4蛋白仍具有促进干细胞迁移的能力。本研究结果还显示,复合CTLA4的DBM能增强BMMSCs的增殖能力。因此我们推测,在体内环境下,复合CTLA4的DBM可能具有诱导宿主BMMSCs迁移至损伤部位并促进其增殖的功能,在今后的体内实验中将进一步验证该材料的功能,为其临床应用提供更加扎实的理论基础。
综上,复合CTLA4的DBM在体外环境下具有T淋巴细胞免疫抑制的能力,是一种新型骨移植修复材料,这种材料可以提前构建,在无菌封装后进行冷冻保存,可保证在战场条件下满足携带方便、随时补给、高效简洁的需求。但其临床应用效果仍需要大量的实验数据支撑。我们将在今后的实验中探讨其在体内环境下对免疫微环境的调控功能以及是否具有促进成骨的效能。