MgAl2O4包覆对钨铝复合氧化物水热稳定性的影响
2022-01-25姜冬冬陈长林
姜冬冬,陈长林
(南京工业大学 化工学院 材料化学工程国家重点实验室,江苏 南京 211800)
γ-Al2O3又称活性氧化铝,由于其庞大的比表面积、丰富的表面酸性位以及优异的力学强度被广泛应用于工业生产中。与γ-Al2O3相比,钨铝复合氧化物WOx/Al2O3(WAl)拥有更强的表面酸性,并且由于Al—O—W的生成,使其同时具有Brønsted酸和Lewis酸的特征,这在加氢脱氧反应过程中尤为重要[1-3]。然而,WAl在含有水或者反应过程中有水生成的条件下并不稳定,WAl中的Al2O3会与水作用,水合相变生成勃姆石而造成孔道坍塌,比表面积、孔容、表面酸性以及力学强度降低,从而造成催化剂失活[4-7]。因此,提高WAl 的水热稳定性是目前面临的最主要的挑战之一。
为了提高γ-Al2O3的水热稳定性,将Ba、Sr、La、Gd、Sn、Si、P等掺杂到Al2O3的结构中[8]。俞芳等[9]利用X线衍射仪(XRD)研究不同金属离子浸渍对γ-Al2O3水合性能的影响,结果表明:K+、Ca2+对γ-Al2O3水合几乎没有影响;Fe3+有较小的抑制作用;Zr4+、Cu2+和Ni2+有较明显的抑制作用;Mg2+、Li+、Co2+、Ce3+和Zn2+有很强的抑制作用。Murrell等[10]发现分散的硅溶胶能够在高温蒸汽条件下稳定Al2O3的比表面积。Pham等[11]以蔗糖为碳源沉积一层碳膜来增强介孔氧化物如SiO2和Al2O3的水热稳定性,碳膜的包覆改变了氧化物表面的化学性质,使得氧化物在高温条件下很难发生水合。Xiong等[12]以甲烷为反应物利用化学气相沉积法(CVD)于900 ℃条件下在γ-Al2O3表面沉积石墨碳,然后将石墨碳/γ-Al2O3复合物以及纯γ-Al2O3于220 ℃水热处理12 h,结果表明:纯γ-Al2O3在水热处理后水合形成勃姆石,而石墨碳/γ-Al2O3复合物并没有发生相变,并且比表面积和孔容也没有发生变化,然而纯γ-Al2O3结构却发生巨大的变化,其中比表面积降低了80%,孔容降低了90%。Van Cleve等[13]在γ-Al2O3表面沉积长链烷基膦酸盐,通过调节烷基长度达到抑制勃姆石生成的目的。Liu等[14]使用正硅酸乙酯作为硅源在Pt/Al2O3上沉积一层硅,形成的Al—O—Si能够有效阻止由于Al2O3表面的Al配位不饱和而对水的吸附。Hu等[15]在Pd/ZrO2-Al2O3催化剂中掺杂Mg,形成镁铝尖晶石(MgAl2O4),降低了表面羟基数量,从而有效增强催化剂的水热稳定性。
在MgAl2O4结构中,Mg2+占据四面体位置,Al3+占据八面体位置,O2-为立方紧密堆积,使得MgAl2O4具有优异的化学稳定性和力学强度,高晶格密度的稳定结构在水热条件下使得水分子很难进入尖晶石内部而发生水合[16]。因此,本文采用多次浸渍-焙烧法在WAl表面制备MgAl2O4,以期通过MgAl2O4包覆提高WAl的水热稳定性。
1 实验
1.1 样品的制备和水热处理
1)WAl样品的制备。首先,将γ-Al2O3加到计量好的偏钨酸铵水溶液中,充分搅拌均匀后,密封放置于85 ℃恒温烘箱中浸渍24 h。然后,将浸渍好的样品烘干并挤压成型。最后,将样品在800 ℃马弗炉中焙烧3 h,取出研磨得到450~1 000 μm的WAl颗粒,其中W占WAl的理论质量分数为10%。
2) MgAl2O4包覆WAl样品的制备。首先,在去离子水中加入计量好的摩尔比为2∶1的Al(NO3)3·9H2O (≥99.0%)和Mg(NO3)2·6H2O(≥99.0%),搅拌均匀制得浸渍液。然后,将WAl等体积浸渍到制备好的浸渍液中,室温下放置12 h。最后,将样品烘干并在800 ℃马弗炉中焙烧3 h,得到不同含量MgAl2O4包覆的WAl样品,记为yMgAl2O4@WAl,其中MgAl2O4占WAl的理论质量分数分别为0、6%、12%和18%,对应的y=0、6、12和18。
3)样品的水热处理(HT)。取5.0 g样品放置于100 mL内衬为聚四氟乙烯的水热釜中,同时加入50 mL去离子水,将水热釜密封放置于200 ℃恒温烘箱中,水热处理100~500 h。
1.2 样品的表征
粉末X线衍射在日本Rigaku公司Smart Lab型X线衍射仪(XRD)上测定,以Cu靶Kα线为辐射源(λ=0.154 06 nm),管电压为40 kV,管电流为100 mA,扫描速率为20 (°)/min,扫描范围:衍射角(2θ)为10°~80°。
样品的比表面积、孔容、孔径在贝士德仪器科技(北京)有限公司的3H-2000PS系列全自动比表面及孔径分析仪上测定。在测定前,样品在200 ℃ 真空条件下预处理2 h来移除物理吸附的湿气,待温度平衡至室温后,将样品冷却至液氮温度下进行N2吸附-脱附测试,用Brunauer-Emmet-Teller (BET)方程计算得到样品的比表面积,用Barrett-Joyner-Halenda (BJH)法计算得到样品的孔容和平均孔径。
采用FEI-Quanta FEG 250型扫描电子显微镜(SEM)观察样品形貌,用金粉溅射以获得所需的导电性。
样品的衰减全反射红外光谱(ATR-IR)是在Agilent Cary 660型傅里叶变换红外光谱仪(FT-IR)上测得,光谱测量范围为400~4 000 cm-1,分辨率为4 cm-1。
2 结果与讨论
2.1 MgAl2O4包覆对WAl 物相结构、比表面积、孔容、孔径的影响
2.1.1 MgAl2O4包覆对WAl物相结构的影响
图1为WAl、6MgAl2O4@WAl、12MgAl2O4@WAl、18MgAl2O4@WAl及浸渍液焙烧制备的MgAl2O4的XRD图谱。由图1可知:对于WAl,通过与标准卡片(JCPDS No. 10-0425)对照得到在2θ=19.5°、31.9°、37.6°、39.5°、45.9°、60.9° 和 67.0°处为γ-Al2O3的特征衍射峰,并未观察到WOx的衍射峰,这是因为WOx在γ-Al2O3上可能处于单层分散状态[17]。6MgAl2O4@WAl、12MgAl2O4@WAl、18MgAl2O4@WAl中未观察到明显的MgAl2O4衍射峰,一方面是由于MgAl2O4在WAl表面高度分散而低于XRD检测线,另一方面则是因为MgAl2O4的衍射峰与γ-Al2O3非常相似。
由图1还可知:随着MgAl2O4含量的增加,位于45.9°和67.0°附近γ-Al2O3的(400)和(440)晶面衍射峰向低角度偏移,峰强度增加,半峰宽变窄,这是由MgAl2O4的晶格密度大于γ-Al2O3造成的。为了进一步确认MgAl2O4是否能在WAl表面生成,测试浸渍液在相同条件下焙烧后的纯相MgAl2O4的衍射图谱,通过与标准卡片(JCPDS No. 21-1152)对照得到在2θ=19.0°、31.3°、36.9°、44.8°、55.7°、59.4°、65.2°和 77.3°处出现归属于MgAl2O4的特征衍射峰,表明在相应条件下MgAl2O4是可以生成的。
2.1.2 MgAl2O4包覆对WAl比表面积、孔容及孔径的影响
测得样品的比表面积、孔容、平均孔径及吸附-脱附曲线如表1和图2所示。由表1可知:随着MgAl2O4质量分数的增加,样品的比表面积和孔容均减小,表明MgAl2O4不仅在WAl的外表面生成,而且在孔道内部也有部分生成。由图2可知:随着MgAl2O4质量分数的增加,样品的结构并未改变,均属于Langmuir IV型吸附等温线、H1型滞后环,说明其孔道为两端开口、管径分布均匀的介孔结构,表明MgAl2O4包覆后并未影响到样品的介孔类型。

表1 样品的比表面积、孔容及平均孔径

图2 样品的N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherm of samples
2.2 MgAl2O4对WAl 水热稳定性的影响
2.2.1 MgAl2O4对WAl 样品水热处理后物相结构的影响
图3为样品随水热处理时间变化的XRD图谱。由图3可知:WAl样品在水热处理100 h后就能够观察到新的物相衍射峰,随着水热时间的延长,晶相变得容易识别,当水热时间达到500 h,γ-Al2O3物相消失。通过与标准卡片(JCPDS No. 21-1307)对照得到在2θ=14.5°、28.2°、38.3°、48.9° 以及49.2°处的衍射峰分别对应勃姆石(AlOOH)的(020)、(120)、(140)、(051)和(200)晶面,表明此时γ-Al2O3相已经完全转变为勃姆石相。当包覆MgAl2O4后,WAl 的水热稳定性明显提高,yMgAl2O4@WAl样品水热处理500 h后测得的XRD图谱见图4。由图4可知:对于样品6MgAl2O4@WAl,在水热处理500 h后,有少量的勃姆石生成。当MgAl2O4的质量分数≥12%时,XRD图谱中未观察到明显的勃姆石相,表明此时MgAl2O4全部覆盖在WAl 表面。由此可以推测,通过高温焙烧在WAl表面形成的MgAl2O4可以阻止WAl表面不饱和Al配位产生Lewis酸位,使得勃姆石形成的初始水合位点难以与水作用,从而抑制了对水的吸附。
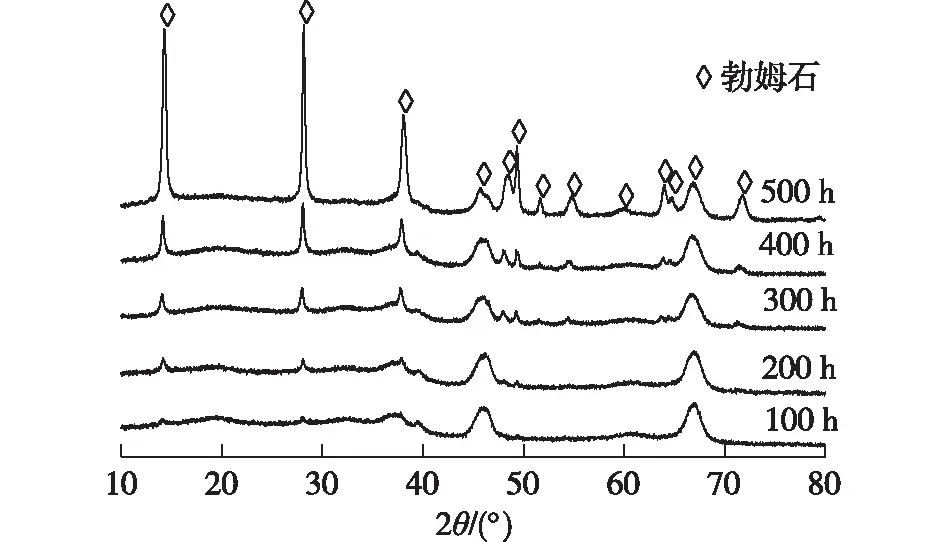
图3 WAl样品随水热时间变化的XRD图谱Fig.3 Changes of XRD spectra of WAl samples with hydrothermal treatment time

图4 yMgAl2O4@WAl样品水热500 h后的XRD图谱Fig.4 XRD spectra of yMgAl2O4@WAl samples after hydrothermal treatment for 500 h
2.2.2 MgAl2O4包覆WAl 样品水热处理后的比表面积、孔容及孔径分析
图5为MgAl2O4包覆前后的WAl样品在不同水热处理时间后的比表面积、孔容和平均孔径。由图5可知:最初,水热处理导致样品的比表面积增加,而平均孔径降低,这种现象被认为是勃姆石形成的过渡中间状态。勃姆石的形成初期会造成样品表面粗糙,但不会破坏整体结构,这有助于保持孔隙结构。对于WAl样品,在处理100 h后,比表面积达到最大值173 m2/g,随着水热时间的延长,比表面积开始下降,当水热时间达到500 h,比表面积急剧下降到最大值的43.9%,仅为97 m2/g;孔容从水热处理100 h时的0.52 cm3/g降至0.27 cm3/g,降低了48.1%;平均孔径从水热处理100 h的12.59 nm降至10.27 nm,降低了18.43%。WAl样品的吸附等温线由Langmuir IV型吸附等温线、H1型滞后环转变为Langmuir IV型吸附等温线、H2型滞后环,表明WAl样品由介孔结构转变为片状结构(图6)。对于6MgAl2O4@WAl样品,随着水热时间的延长(100~500 h),比表面积从最大值157 m2/g降低至148 m2/g,孔容从0.50 cm3/g降低至0.46 cm3/g,平均孔径从13.4 nm降至12.49 nm,分别仅降低了5.7%、8.0%和6.8%。可见当MgAl2O4包覆后,比表面积、孔容及平均孔径的降低得到抑制。当MgAl2O4质量分数≥12%时,比表面积和孔容随水热处理时间的延长变化不大。此外,由吸附等温线(图6)可以看出,水热处理并没有改变MgAl2O4包覆WAl样品的介孔类型。以上结果表明,MgAl2O4的引入能够削弱水对WAl样品孔道的攻击,从而使得WAl样品在水热条件下依然能够保持较高的比表面积和孔容(图5)。

图5 样品的比表面积、孔容及平均孔径随水热处理时间的变化Fig.5 Changes of specific surface area, pore volume and average pore diameter of samples with hydrothermal treatment time
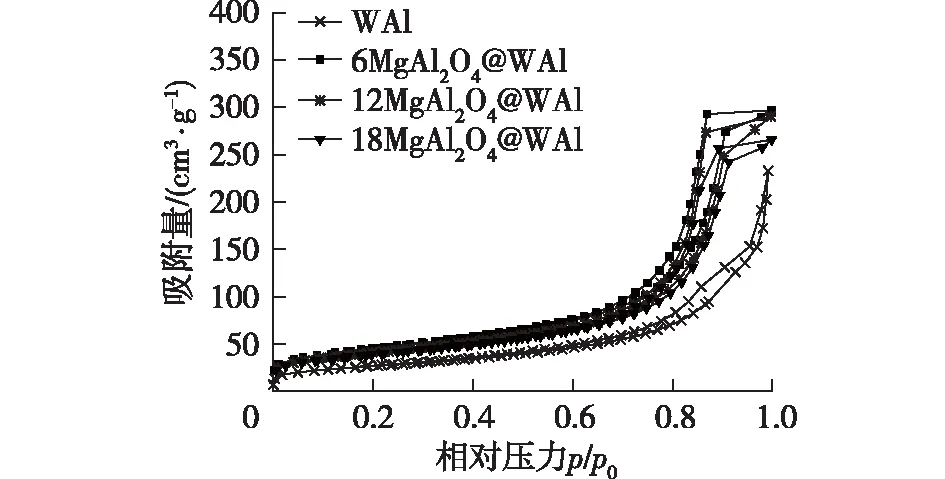
图6 样品水热处理500 h后的N2吸附-脱附等温线Fig.6 N2 adsorption-desorption isotherm of samples after hydrothermal treatment for 500 h
2.2.3 MgAl2O4包覆WAl 样品水热处理后的形貌分析
水热处理对WAl和12MgAl2O4@WAl样品形貌的影响如图7所示。由图7可知:水热处理100 h时,WAl表面形成了大量的平均直径约为100~150 nm、长度约为1 μm的勃姆石层状晶体;进一步延长水热处理时间至500 h,WAl样品中勃姆石相的密度增加,表明勃姆石结晶度得到明显的提高。对于12MgAl2O4@WAl样品,在水热处理500 h后,表面并未观察到勃姆石层状晶体,而只有轻微地粉化现象,表明MgAl2O4的引入抑制了勃姆石相的形成,这与XRD结果一致。

图7 水热处理对样品形貌的影响Fig.7 Effects of the hydrothermal treatment on the morphology of the samples
2.2.4 MgAl2O4包覆WAl样品在水热处理后的红外光谱分析
研究水热处理对WAl和12MgAl2O4@WAl样品ATR-IR光谱的影响,结果见图8。由图8可知:在3 468 和1 630 cm-1附近的两个宽的吸收峰分别对应于水的O—H伸缩振动和H—O—H弯曲振动,并且还观察到了在2 166 cm-1处的一个小的吸收峰,这是弯曲振动峰和近红外宽带耦合的结果[18]。2 050 cm-1处的弱吸收峰和1 630 cm-1处的尖锐吸收峰分别对应水的结合键引起的伸缩和弯曲振动, 在1 070、3 294和3 100 cm-1附近的肩峰分别归属于勃姆石相的—OH弯曲和伸缩振动[19-21]。位于703 和620 cm-1处的两个弱宽峰分别对应WAl样品中的W—O—Al和Al—O—Al对称伸缩振动, 在729 cm-1处的峰应归属于钨氧四面体中的W—O伸缩振动[22]。因此,在水热条件下,水分子首先吸附在WAl样品表面形成表面羟基,随着处理时间的延长,过量的羟基导致W—O—Al和Al—O—Al键的断裂形成Al—O—H键,从而促进了勃姆石相的生成。MgAl2O4包覆后,经过500 h水热处理,仅观察到吸附水的O—H伸缩振动峰,并未观察到新的振动峰。这表明WAl样品经过MgAl2O4包覆后,水分子很难进入内部与WAl样品接触发生水合,从而提高了WAl样品的水热稳定性。

图8 水热处理对样品红外光谱的影响Fig.8 Effects of the hydrothermal treatment on the ATR-IR spectra of the samples
3 结论
采用浸渍-焙烧法在WAl表面包覆不同含量的MgAl2O4。水热处理初期,水热处理使得所有样品的比表面积均增加,孔容和平均孔径均减小。未包覆MgAl2O4的WAl产生相变生成勃姆石,随着水热处理时间的延长,勃姆石相增加,比表面积、孔容和平均孔径迅速下降,WAl的结构也由层状变为片状。在水热处理500 h后,未包覆MgAl2O4的WAl中的γ-Al2O3已完全转变为勃姆石,而包覆少量MgAl2O4后,仅有部分的勃姆石生成。当MgAl2O4质量分数≥12%时,样品中已经完全观察不到有勃姆石相的生成,并且依然保持较高的比表面积、孔容和平均孔径,说明MgAl2O4包覆有效地提高了钨铝复合氧化物的水热稳定性。
