SHH信号通路在骨髓增生异常综合征中的表达及SMO抑制剂对MUTZ-1细胞的作用研究*
2022-01-24姚柳赵芳秦玉婷王欢尼罗帕尔吐尔逊陈双帕提古丽阿不力孜郝建萍
姚柳,赵芳,秦玉婷,王欢,尼罗帕尔·吐尔逊,陈双,帕提古丽·阿不力孜,郝建萍
[新疆医科大学第一附属医院 血液病中心(新疆维吾尔自治区血液病研究所),新疆 乌鲁木齐830054]
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组异质性髓系克隆性疾病,其特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少、高风险向急性髓系白血病转化[1]。MDS 的发病机制仍然不明确,可能与多基因累积突变,癌基因与抑癌基因异常,造血干细胞、祖细胞增殖分化和凋亡行为异常,以及免疫功能紊乱等多种因素有关[2-3]。造血干细胞移植是目前唯一有潜力的治疗方法,但是,只有很少的患者接受造血干细胞移植。靶向表观遗传途径逆转抑癌基因的病理性失活是MDS 的另一种治疗可能性。该方法具有侵袭性和细胞毒性,并且随着治疗时间的推移,部分患者的疗效会逐渐降低,耐药现象普遍存在[4-6]。因此,迫切需要替代的低毒疗法。研究表明,Hedgehog(HH)是多种人类癌症发病机制中的关键介质,HH 信号在白血病干细胞的自我更新和维持肿瘤干细胞中发挥重要作用,其异常激活与肿瘤的发生、侵袭和转移密切相关[7-8]。HH 基因家族包括 Sonic Hedgehog (SHH)、 Desert Hedgehog(DHH)和Indian Hedgehog(IHH)3 种同源基因,分别编码相应的分泌型蛋白作为HH 信号通路的配体,其中SHH 信号通路与人类关系最密切,其由SHH、Patched、Smoothened(SMO)和Gli4 种基因组成,分别编码SHH 配体、Patched 受体、SMO 受体以及下游的转录因子Gli 家族蛋白[9]。跨膜受体Patched 包括Patched-1 和Patched-2 两种亚型[10]。SHH 信号通路受SHH 蛋白调节呈双相性:无SHH 配体时,Patched 与蛋白复合物结合,可触发Caspase 依赖的细胞死亡途径[11];存在SHH 配体时,Patched 释放SMO,解除对SMO 的抑制,激活转录因子Gli-1、Gli-2、Gli-3 和下游靶基因,最终调节多种靶基因(Cyclin D1、Bcl-2、C-myc、Cyclin E和BMP 等)的表达,进而调控细胞的生长、增殖与分化[12-13]。SHH 信号通路作为HH 信号的重要分支,在血液肿瘤中发挥着重要作用,但在MDS 发生、发展中的作用研究较少。本研究旨在探讨SHH 信号通路相关基因在MDS 中的表达,SMO 抑制剂Jervine 对人骨髓增生异常综合征细胞MUTZ-1 增殖、凋亡及SHH 通路相关基因、蛋白表达的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年6月—2018年3月于新疆医科大学第一附属医院血液病中心经骨髓细胞形态学、染色体R 显带分析、荧光原位杂交、流式细胞术检查确诊的53 例MDS 患者。其中,男性30 例,女性23 例;年龄15~88 岁,中位发病年龄67 岁;根据WHO 2016 分型标准[14]进行分型,MDS 伴单系病态造血(MDS-SLD)4 例,MDS 伴多系病态造血(MDS-MLD)12 例,MDS 伴 环形铁粒幼细胞(MDS·RS)1 例,MDS 伴原始细胞增多Ⅰ型(MDS-EB-1)7 例,MDS伴原始细胞增多Ⅱ型(MDS-EB-2)29 例;依据国际预后积分系统(IPSS)[15]对患者预后分组:低危组2 例,中危1 组16 例,中危2 组21 例,高危组14 例。将低危组和中危1 组归为相对低危组,中危2 组和高危组归为相对高危组。选取同期该院25 例缺铁性贫血患者作为正常对照组。本研究经医院医学伦理委员会批准,患者签署知情同意书。
1.2 仪器、试剂与细胞
流式细胞仪(美国BD Bioscience 公司),磁珠分选仪(德国美天旎生物技术有限公司);羊抗人SHH 抗体、兔抗人SMO 抗体、羊抗人Patched-1 抗体、兔抗人Gli-1 抗体(美国Santa Cruz 公司),Trizol 试剂(美国Invitgen 公司),逆转录酶试剂(日本TaKaRa 公司),Jervine(英国Abcam 公司),兔二抗、鼠二抗(武汉博士德生物工程有限公司),10%胎牛血清(FBS)和1%青霉素-链霉素的RPMI 1640培养基(美国Gibco 公司),CCK-8 细胞计数试剂盒(上海碧云天生物技术有限公司),Annexin V-FITC/PI 试剂盒(南京凯基生物公司);MUTZ-1 细胞(上海通派生物科技有限公司)。
1.3 实验方法
1.3.1 CD34+细胞分离 流式细胞仪检测53 例MDS 患者骨髓单个核细胞中CD34+细胞的数量,磁珠分选仪分离CD34+细胞,分选的CD34+细胞纯度在95%以上,有效率在90%以上。
1.3.2 实时荧光定量聚合酶链反应(qRT-PCR)检测SHH、Patched-1、SMO 和Gli-1 mRNA 的相对表达量 抽取MDS 患者和正常对照组患者空腹肘正中静脉血3~4 mL,12 000 r/min 离心15 min,取上清液。按照Trizol 试剂盒说明书步骤从血清中提取总RNA,按照逆转录酶试剂盒说明书步骤逆转录成cDNA,置于-20℃冰箱保存备用。扩增引物根据GeneBank 序列设计并由武汉巴菲尔生物技术公司合成,引物序列见表1。β-actin为内参基因。采用20 μL PCR 扩增体系,每孔加入SYBR Green Master Mix 10.0 μL,50×ROX Reference Dye 2 0.4 μL,高纯水4.8 μL,正、反向引物各0.4 μL,cDNA 4.0 μL,每个样本设3 个复孔。扩增反应条件:95℃预变性1 min、95℃变性15 s、60℃退火15 s、72℃延伸30 s,于72℃采集荧光信号,循环40 次。采用2-ΔΔCt法计算目的基因的相对表达量。

表1 引物序列
1.3.3 细胞培养和Jervine 干预 MUTZ-1 细胞系在含10% FBS 和1%青霉素-链霉素的RPMI 1640 培养基,37℃、5%二氧化碳培养箱中培养[16]。将溶解在DMSO溶液中终浓度为1 μ mol/L、5 μ mol/L、10 μmol/L 的Jervine 加入对数生长期的MUTZ-1 细胞中,共孵育24 h。
1.3.4 CCK-8法检测细胞增殖活性 收集MUTZ-1细胞,按照5×104个/mL 接种于96 孔板,每孔接种100 μL 细胞悬液,分别加入0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L Jervine,37℃、5%二氧化碳饱和湿度培养箱中培养24 h,加入10 μL CCK-8,37℃培养4 h,在酶标仪450 nm 波长处测定吸光度值。进行3 次独立重复实验,计算细胞活力变化情况。不含细胞只含培养基为空白组,Jervine 0 μmol/L为对照组,Jervine 1 μmol/L、Jervine 5 μmol/L、Jervine 10 μmol/L 为实验组,计算增殖率,增殖率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
1.3.5 流式细胞术检测细胞凋亡率 用0 μmol/L、1 μmol/L、5 μmol/L、10 μmol/L Jervine 处理MUTZ-1细胞,每孔总体积为3 mL。37℃、5%二氧化碳饱和湿度的培养箱中培养24 h 后,收集细胞,严格按照Annexin V-FITC/PI 试剂盒说明书操作,通过流式细胞仪检测细胞凋亡率。实验重复3 次,取平均值进行统计分析。
1.3.6 qRT-PCR 检 测MUTZ-1细胞的SMO 和Gli-1 mRNA的相对表达量 用Trizol试剂从MUTZ-1细胞中提取总RNA,用逆转录酶试剂逆转录成cDNA,引物序列同表1。反应条件和计算方法同1.3.2。
1.3.7 Western blotting 法检测SMO、Gli-1、Bcl-2、Caspase-3、Cyclin D1 蛋白相对表达量 用RIPA 裂解液提取MUTZ-1 细胞总蛋白,每次取20 μL 总蛋白进行SDS-PAGE 凝胶电泳(80 V 40 min,120 V 60 min),将蛋白从SDS-PAGE 胶上转印至PVDF 膜(100 V 120 min)。5%脱脂奶粉封闭2 h。β-actin 为内参。按 照1∶500 稀 释Gli-1,按 照1∶1 000 稀 释SMO、Caspase-3, 1∶2 000 稀 释Bcl-2, 1∶5 000 稀 释Cyclin D1,1∶200 稀释β-actin,4℃孵育过夜,按照1∶50 000 稀释兔二抗和鼠二抗,37℃孵育2 h,随后显色底物显影。
1.4 治疗方案
相对低危组以沙利度胺、环孢素、雄激素治疗为主,联合间断输血。相对高危组根据患者意愿分别输血、给予地西他滨或预激化疗。
1.5 随访
所有患者随访到死亡或2018年3月30日。总生存期(OS)为从确诊到死亡的时间或2018年3月30日。随访数据从医院记录中获得,或者通过电话采访患者或其家人获得。
1.6 统计学方法
数据分析采用SPSS 23.0 统计软件。2-ΔΔCt法分析基因的相对表达量,结果不服从正态分布,做对数转换为正态分布后进行统计学分析。方差齐时,计量资料用均数±标准差(±s)表示,多组比较采用方差分析,进一步两两比较采用LSD-t法;方差不齐时,计量资料用中位数(上四分位数,下四分位数)[M(P25,P75)]表示。用Kaplan-Meier 法绘制生存曲线,比较用Log rank χ2检验。采用Pearson 法做相关性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 3组患者SHH、Patched-1、SMO 和Gli-1 mRNA相对表达量的比较
3 组患者SHH 和Patched-1 mRNA 相对表达量比较,差异无统计学意义(P>0.05)。3 组患者SMO 和Gli-1 mRNA 相对表达量比较,差异有统计学意义(P<0.05);进一步两两比较,相对高危组SMO 和Gli-1 mRNA 相对表达量高于正常对照组和相对低危组(P<0.05);相对低危组与正常对照组比较,差异无统计学意义(P>0.05)。见表2。
表2 3组患者SHH、Patched-1、SMO和Gli-1 mRNA相对表达量的比较 (±s)

表2 3组患者SHH、Patched-1、SMO和Gli-1 mRNA相对表达量的比较 (±s)
注:①与正常对照组比较,P <0.05;②与相对低危组比较,P <0.05。
组别正常对照组相对低危组相对高危组F 值P 值n Gli-1 mRNA 0.07±0.49 0.14±0.92 1.03±1.32①②7.928 0.001 25 18 35 SHH mRNA 0.22±1.71 1.20±2.17 1.32±2.03 2.458 0.089 Patched-1 mRNA 0.05±1.84 1.01±2.25 1.01±2.07 1.845 0.170 SMO mRNA-0.38±2.09 1.17±3.05 3.89±2.51①②21.601 0.000
2.2 SHH信号通路相关基因与患者预后生存分析
53 例患者中位生存时间为12.0(7.5,16.5)个月;平均SMO mRNA 相对表达量为(2.95±2.97),平均Gli-1 mRNA 相对表达量为(0.73±1.26)。高于平均水平的患者为高表达组,低于平均水平的患者为低表达组。SMO基因高、低表达组患者中位生存时间分别为8.0(6.7,9.3)个月和20.0(14.2,25.8)个月,Gli-1基因高、低表达组患者中位生存时间分别为7.0(4.6,9.4)个月和20.0(7.2,32.8)个月。用Kaplan-Meier 法绘制生存曲线,结果显示,SMO基因高、低表达组患者3年累积生存率分别为8.4% 和36.9%,两组比较,采用Log rank χ2检验,差异有统计学意义(χ2=10.840,P=0.001)(见图1);Gli-1基因高、低表达组患者3年累积生存率分别为11.6%和31.5%,两组比较,采用Log rank χ2检验,差异有统计学意义(χ2=10.180,P=0.001)(见图2)。
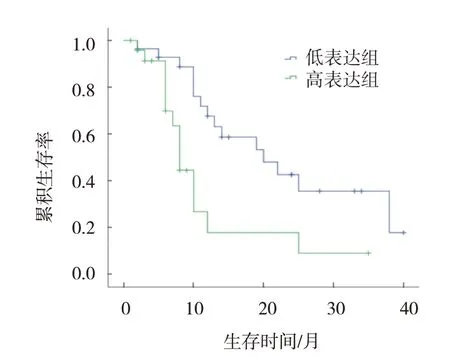
图1 MDS患者SMO基因高、低表达组的生存曲线

图2 MDS患者Gli-1基因高、低表达组的生存曲线
2.3 Jervine对MUTZ-1细胞增殖的影响
CCK-8 法检测结果显示,Jervine 0 μmol/L 组、Jervine 1 μ mol/L 组、Jervine 5 μ mol/L 组、Jervine 10 μmol/L 组MUTZ-1 细胞的增殖率分别为(99.88±0.12)%、(93.39±0.93)%、(87.88±1.72)%和(78.76±0.75)%,4 组比较,差异有统计学意义(F=217.752,P=0.000);进一步两两比较,Jervine 5 μmol/L 组和Jervine 10 μmol/L 组细胞增殖率低于Jervine 0 μmol/L 组(P<0.05)(见图3)。MUTZ-1 细胞增殖率与Jervine 浓度呈负相关(r=-0.977,P=0.000),随着Jervine 浓度升高,对MUTZ-1 细胞增殖作用越小,呈现剂量依赖性。

图3 不同浓度Jervine作用MUTZ-1细胞24 h后细胞增殖率的比较 (±s)
2.4 Jervine对MUTZ-1细胞凋亡的影响
流式细胞仪检测结果显示,Jervine 0 μmol/L 组、Jervine 1 μ mol/L 组、Jervine 5 μ mol/L 组、Jervine 10 μmol/L 组细胞凋亡率分别为(3.53±0.21)%、(5.69±0.23)%、(10.90±0.13)%和(18.23±0.72)%,4 组比较,差异有统计学意义(F=806.727,P=0.000)(见图4)。MUTZ-1 细胞凋亡率与Jervine 浓度呈正相关(r=0.997,P=0.000),随着Jervine 浓度升高,对MUTZ-1 细胞凋亡作用越明显,呈现剂量依赖性。

图4 不同浓度Jervine组MUTZ-1细胞的凋亡率
2.5 Jervine 对MUTZ-1 细 胞SMO 和Gli-1 基 因表达的影响
Jervine 0 μmol/L 组、 Jervine 1 μ mol/L 组、Jervine 5 μ mol/L 组、Jervine 10 μmol/L 组MUTZ-1细胞的SMO、Gli-1 mRNA 相对表达量比较,差异有统计学意义(P<0.05);进一步两两比较,Jervine 5 μmol/L 组和Jervine 10 μmol/L 组SMO、Gli-1 mRNA相对表达量低于Jervine 0 μmol/L 组(P<0.05)。见表3。
表3 不同浓度Jervine组MUTZ-1细胞的SMO、Gli-1 mRNA相对表达量的比较 (±s)

表3 不同浓度Jervine组MUTZ-1细胞的SMO、Gli-1 mRNA相对表达量的比较 (±s)
注:†与Jervine 0 μmol/L组比较,P <0.05
组别Jervine 0 μmol/L组Jervine 1 μmol/L组Jervine 5 μmol/L组Jervine 10 μmol/L组F 值P 值Gli-1 mRNA 1.09±0.08 0.76±0.13 0.49±0.08†0.27±0.07†44.822 0.000 SMO mRNA 0.99±0.07 0.81±0.07 0.61±0.04†0.39±0.07†50.623 0.000
2.6 Jervine 对MUTZ-1 细 胞SMO 和Gli-1 蛋 白表达的影响
Jervine 0 μmol/L 组、 Jervine 1 μ mol/L 组、Jervine 5 μ mol/L 组、Jervine 10 μmol/L 组MUTZ-1细胞的SMO、Gli-1 蛋白相对表达量比较,差异有统计学意义(P<0.05);进一步两两比较,Jervine 5 μmol/L 组和Jervine 10 μmol/L 组SMO、Gli-1 蛋白相对表达量低于Jervine 0 μmol/L 组(P<0.05)。见图5 和表4。
表4 不同浓度Jervine组MUTZ-1细胞的SMO、Gli-1蛋白相对表达量的比较 (±s)

表4 不同浓度Jervine组MUTZ-1细胞的SMO、Gli-1蛋白相对表达量的比较 (±s)
注:†与Jervine 0 μmol/L组比较,P <0.05。
组别Jervine 0 μmol/L组Jervine 1 μmol/L组Jervine 5 μmol/L组Gli 0.8 0.7 0.5 SMO 蛋白0.78±0.04 0.64±0.04 0.47±0.03†Jervine 10 μmol/L组F 值P 值-1 蛋白5±0.081±0.090±0.06†0.28±0.05†38.685 0.000 0.30±0.04†85.542 0.000
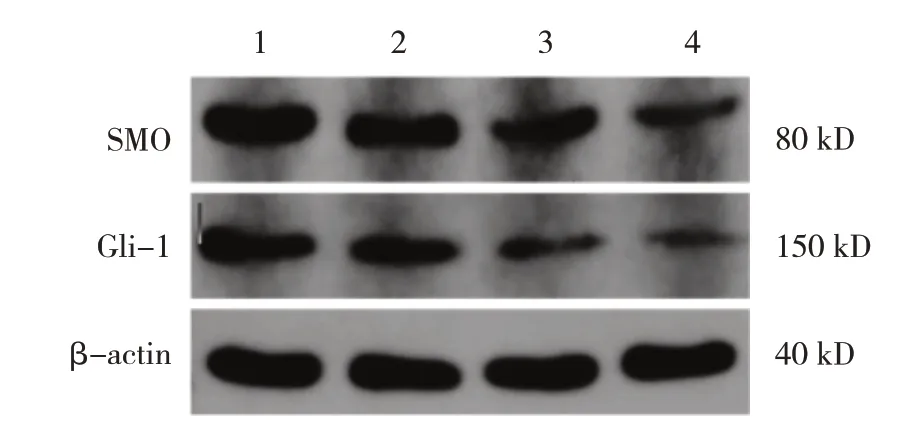
图5 不同浓度Jervine组MUTZ-1细胞的SMO、Gli-1蛋白的表达
2.7 Jervine对Bcl-2、Caspase-3、Cyclin D1蛋白表达的影响
Jervine 0 μmol/L 组、 Jervine 1 μ mol/L 组、Jervine 5 μmol/L 组、Jervine 10 μmol/L 组MUTZ-1细胞的Bcl-2、Caspase-3、Cyclin D1 蛋白相对表达量比较,差异有统计学意义(P<0.05);进一步两两比较,Jervine 1 μmol/L 组、Jervine 5 μmol/L 组、Jervine 10 μmol/L组与Jervine 0 μmol/L组比较,Bcl-2、Cyclin D1 蛋白相对表达量降低,Caspase-3 蛋白相对表达量升高(P<0.05)。见图6 和表5。
表5 不同浓度Jervine 组MUTZ-1 细胞的Bcl-2、Caspase-3、Cyclin D1蛋白相对表达量的比较(±s)

表5 不同浓度Jervine 组MUTZ-1 细胞的Bcl-2、Caspase-3、Cyclin D1蛋白相对表达量的比较(±s)
注:†与Jervine 0 μmol/L组比较,P <0.05。
组别Cyclin D1蛋白0.72±0.04 0.59±0.06†0.41±0.02†0.29±0.03†68.334 0.000 Bcl-2 蛋白Jervine 0 μmol/L组Jervine 1 μmol/L组Jervine 5 μmol/L组Jervine 10 μmol/L组F 值P 值0.78±0.04 0.64±0.10†0.49±0.04†0.31±0.04†31.871 0.000 Caspase-3蛋白0.23±0.07 0.35±0.07†0.48±0.05†0.61±0.06†19.762 0.000

图6 不同浓度Jervine作用MUTZ-1细胞后Bcl-2、Caspase-3和Cyclin D1蛋白的表达
3 讨论
HH 信号通路在调节正常细胞分化和胚胎发育以及驱动肿瘤形成和发展的病理过程中起至关重要作用,其中SHH 信号通路与人类关系最为密切[17-18]。MDS 发生、发展有多个因素参与,涉及多个信号通路,本研究分析SHH 信号通路在MDS 中的地位,结果显示MDS 患者骨髓中CD34+细胞SHH信号通路异常激活,参与MDS 的发生、发展,SMO 或Gli-1 高表达的MDS 患者中位生存时间短,预后较差。目前国内外关于SHH 信号通路在MDS中的作用机制报道极少,ZOU 等[19]对23 例MDS 患者和9 例MDS 转急性髓系白血病患者进行SHH、SMO和Gli-1基因检测,结果显示在MDS 患者中存在SHH 信号通路的活化,而且高危MDS 及转白血病患者中SHH、SMO和Gli-1基因表达水平明显高于低危患者,SHH、SMO 和Gli-1 表达水平与IPSS预后分组相关。XAVIER-FERRUCIO 等[20]对63 例低危和高危MDS 患者骨髓CD34+细胞进行Patched、SMO、Gli-1和Gli-2基因检测,结果显示SMO 在MDS 患者中高表达,SMO 表达与WHO 分型有关,SMO 高表达患者无事件生存率和OS 明显缩短。本研究也证实了上述观点。因此阻断该通路可以影响肿瘤干细胞的发育和存活,为MDS 治疗提供一个新的选择。因相关研究较少,不同的研究结果略有差异,结果的一致性还需扩大样本量进行观察。
为进一步探讨SHH 信号通路在MDS 中的作用机制,本研究选用SMO 抑制剂Jervine 对存在SHH信号通路高表达的MDS 细胞株MUTZ-1 进行抑制效应及其可能机制的研究。Jervine 是从Veratrum calfornicum 中分离得到的一种天然甾体生物碱,通过与SMO 的跨膜结构域结合而抑制HH 信号通路[21]。MUTZ-1 是从难治性贫血伴原始细胞增多MDS 患者中分离建株的细胞。本研究采用不同浓度Jervine 作用MUTZ-1 细胞,检测细胞的增殖率和凋亡率发现,MUTZ-1 细胞增殖率随Jervine 浓度增加而降低,凋亡率随Jervine 浓度增加而升高,表明Jervine 具有抑制MUTZ-1 细胞增殖和促进细胞凋亡的作用。本研究对不同浓度Jervine 组MUTZ-1 细胞的SMO、Gli-1 mRNA 相对表达量和蛋白相对表达量进行检测,结果表明,Jervine 可下调MUTZ-1 细胞SMO 和Gli-1 基因、蛋白的表达,且随着Jervine浓度增加,SMO 和Gli-1 基因和蛋白表达明显下降。此外,Bcl-2、Caspase-3 和Cyclin D1 是SHH 信号通路的下游靶基因,本研究结果显示,加入不同浓度Jervine 作用于MUTZ-1 细胞后,Bcl-2 和Cyclin D1 蛋白表达明显下降,Caspase-3 则相反,表明SHH 通路对MUTZ-1 细胞增殖和凋亡的作用可能是通过对Bcl-2、Caspase-3 和Cyclin D1 的调节而实现的。KOBUNE 等[22]研究结果显示,在初诊急性粒细胞白血病患者中CD34+细胞上存在HH 信号通路激活,并介导白血病细胞耐药,使用SMO 抑制剂Cyclopamine 作用于急性粒细胞白血病细胞株(Kasumi-1、Kasumi-3 及TF-1)与原代急性粒细胞白血病细胞48 h 后,上述所有细胞凋亡率明显增加。这与本研究结论一致。
综上所述,MDS 患者中存在SHH 信号通路异常激活;作为SHH 信号通路的阻断剂,Jervine 可抑制MDS 细胞的发展,为MDS 提供了一种潜在的新的治疗策略。
