军曹鱼响应低氧胁迫转录组SNP位点鉴定及其功能注释分析
2022-01-22杨二军杨林桐王维政黄建盛张健东王忠良陈刚
杨二军,杨林桐,王维政,黄建盛,2,3*,张健东,2,3,王忠良,2,3,陈刚,2,3*
( 1. 广东海洋大学 水产学院,广东 湛江 524088;2. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3. 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
1 引言
溶解氧(Dissolved Oxygen, DO)对水生动物的发育和健康至关重要[1],同时也是水生动物生存不可缺少的环境因子之一。溶解氧不足时,机体的生长发育、呼吸、新陈代谢、繁殖及免疫功能等生化反应和生理功能会受到影响,严重时会发生死亡[2]。随着全球气候变暖和水体富营养化引发的一系列生态问题,水体低氧化现象越来越严重。调查发现,我国近岸海域出现的低氧层(DO浓度约为3 mg/L)水域范围越来越大,对生活在其中的海洋生物造成了极大的威胁,低氧现象已成为一个被高度重视和广泛关注的问题[3-4]。
军曹鱼(Rachycentron canadum),隶属于鲈形目(Periformes),军曹鱼科(Rachycentridae),军曹鱼属(Rachycentron),又名海鲡、海龙鱼等,是热带和亚热带海域的广盐性、肉食性洄游鱼类。因其具有生长快、抗病能力强、营养丰富、肉质鲜美等特点,使其成为我国南方沿海地区深水网箱养殖的重要品种之一[5]。近年来,随着高密度集约化养殖模式的推广,军曹鱼近海浮动式网箱养殖和深海网箱养殖发展迅速,然而受养殖密度大、管理不善、养殖生态环境恶化、天气、温度等因素的影响,军曹鱼在养殖过程中容易出现缺氧、抗病能力下降等情况,导致病害日趋频繁,严重制约了军曹鱼的健康养殖发展[6-7]。针对军曹鱼养殖过程中出现的缺氧问题,本实验室前期开展了低氧胁迫对军曹鱼幼鱼生长和血清生化指标、氧化应激、能量代谢以及肠道菌群影响的研究,结果表明,低氧胁迫对军曹鱼幼鱼的生理状况有显著影响[7-12]。因此,开展军曹鱼的遗传改良和优良性状品种培育的工作,对促进我国军曹鱼养殖业健康快速的发展具有现实意义。
单核苷酸多态性(Single Nucleotide Polymorphism,SNP)是指因单个核苷酸变异引起的DNA序列多态性,其形式包括单个碱基的转换、颠换、插入和缺失,是一种常见的基因突变[13]。SNP作为第三代分子标记方法,是基因型和表型之间最好的研究载体,相比于前几代的标记方法,它具有位点丰富、分布广泛、遗传稳定性强、检测快速、自动化分析便利和成本低等特点,已成为最具前景的遗传标记方法之一,被广泛应用于生物、农学、医学等众多领域[14-15]。近年来,SNP分子标记技术在鱼类[16-17]、甲壳类[18-19]和贝类[20-21]等水产动物的研究中也取得了重要进展。
随着高通量测序技术的快速发展以及测序成本的下降,利用转录组测序筛选目标性状SNP位点已成为研究遗传多样性、分子育种等分子标记的常用手段[22]。研究发现,利用转录组测序技术和物种基因组信息,更易获得与目标性状相关的SNP[23]。目前,通过转录组测序来筛选大量SNP位点的研究已在多种水产动物中被报道,如马氏珠母贝(Pinctada fucata)[20]、方斑东风螺(Babylonia areolata)[23]、罗氏沼虾(Macrobrachium rosenbergii)[24]、团头鲂(Megalobrama amblyocephala)[25]、鳙鱼(Hypophthalmichthys nobilis)[26]等。关于军曹鱼群体遗传的研究资料较为匮乏,曹丹煜[27]曾利用转录组测序结果筛选与军曹鱼盐度适应相关SNP位点,但未对其响应低氧胁迫SNP位点挖掘和功能注释进行研究。本研究基于低氧胁迫后的军曹鱼幼鱼肠道转录组测序结果,筛选出大量SNP位点,对SNP所在基因的SNP-Unigene进行功能注释,侧重对免疫防御及低氧通路中的相关基因进行SNP的挖掘与筛选,以期为今后军曹鱼耐低氧和抗病品系的遗传选育、分子辅助育种研究提供基础资料。
2 材料和方法
2.1 实验用鱼及饲养
军曹鱼幼鱼由广东海洋大学湛江东海岛生物研究基地提供。实验在广东恒兴饲料实业股份有限公司863基地进行,养殖设施为室内24 h持续充气的流水养殖系统,水体为500 L。选取大小规格整齐、活力好、体格健壮的军曹鱼210尾(体重为(50.44±2.78)g),先在养殖水槽中暂养1周使其适应新环境后再进行低氧胁迫实验,每天投喂2次,及时用虹吸管清理粪便和剩余饵料,暂养期间水体溶解氧在6 mg/L以上,水温为(29±1)℃,pH为7.8~8.0,盐度为28~30,氨氮浓度小于0.02 mg/L,自然光照。
2.2 实验设计及采样
将实验用鱼分为对照组(CT组)和低氧组(HT组),每组设置3个重复实验,每个重复实验有35尾鱼。HT组溶解氧浓度为(3.15±0.21)mg/L,通过覆盖塑料薄膜、调整充气量和水流速度的大小来降低水体溶解氧浓度。水体溶解氧采用碘量法(GB 7489-87)进行测定,CT组无任何处理,溶解氧浓度为 (6.18±0.23)mg/L。实验处理周期为28 d。军曹鱼采样前24 h禁止饲喂,采样时先经丁香酚麻醉,测定鱼体的生物学指标,然后置于冰上解剖,取出整个肠道并剔除脂肪、结缔组织和内容物,用无菌生理盐水冲洗干净后,放置于2.0 mL的冻存管中,投入液氮速冻,运回实验室后转入-80℃冰箱保存进行后续实验。
2.3 转录组测序数据
实验样品送至广州基迪奥生物科技有限公司进行转录组测序工作,使用TRIzol法提取总RNA,纯度(NanoDrop 2000)和浓度(Agilent 2100)检测合格后,每组建3个转录组文库,每个文库以2尾鱼的肠道RNA等效混合进行建库,利用Illumina Hiseq-2000进行测序[23]。转录组测序共获得302 588 246条原始读数(Raw Reads),经去除含有接头、重复及测序质量较低的原始读数后共获得293 736 220条干净读数(Clean Reads)(数据未发表)。
2.4 SNP位点检测及所在Unigene的注释与功能分析
使用hisat2(http://ccb.jhu.edu/software/hisat2/index.shtml)全局比对方式,将不同长度的干净读数比对到本实验室军曹鱼参考基因组(NCBI Bioproject ID:PRJNA634421)获得比对文件,使用samtools sort对其进行排序[28];将CT组和HT组中所有样本排序后的比对文件和相应的参考基因组序列输入到bcftools(https://github.com/samtools/bcftools)软件中,使用bcftools mpileup命令将两组军曹鱼比对后的bam文件转换成vcf文件,进行SNP分型;使用bcftools filter对vcf文件进行过滤,将质量值小于20的低质量突变位点过滤掉,保留质量值不小于20的结果;使用annovar(http://www.openbioinformatics.org/annovar/)软件对过滤后的vcf文件进行注释;使用Excel统计SNP位点的数量及分布情况[29-31]。再将包含SNP的基因序列比对到GO、KOG和KEGG数据库进行功能注释。同时,从转录组数据中筛选免疫和低氧相关的KEGG通路,再由其通路筛选出差异表达的免疫防御和低氧相关基因,进行SNP位点分析[23]。
3 结果与分析
3.1 SNP位点分析
3.1.1 SNP位点数量
利用软件SOAPsnp将CT组和HT组的转录组数据进行分析,26 120条Unigene中共存在431 845个SNP位点,其中CT组有215 953个SNP位点,HT组有215 892个SNP位点。所有SNP位点中,纯合SNP位点有152 642个(CT组76 550个,HT组76 092个)(表1)。SNP发生频率约为1/171 bp(约171 bp有1个SNP位点)。SNP密度频数分析显示,每1 000 bp含有0~5个SNP位点的Unigene出现的频率最高(图1)。
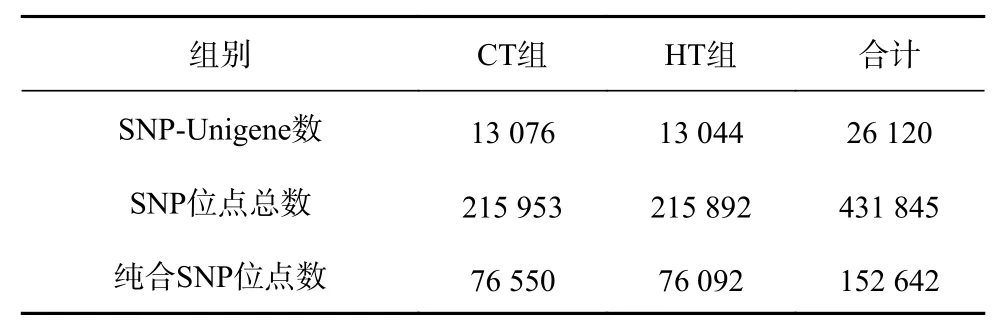
表1 SNP位点数量概况Table 1 The number of the SNP sites
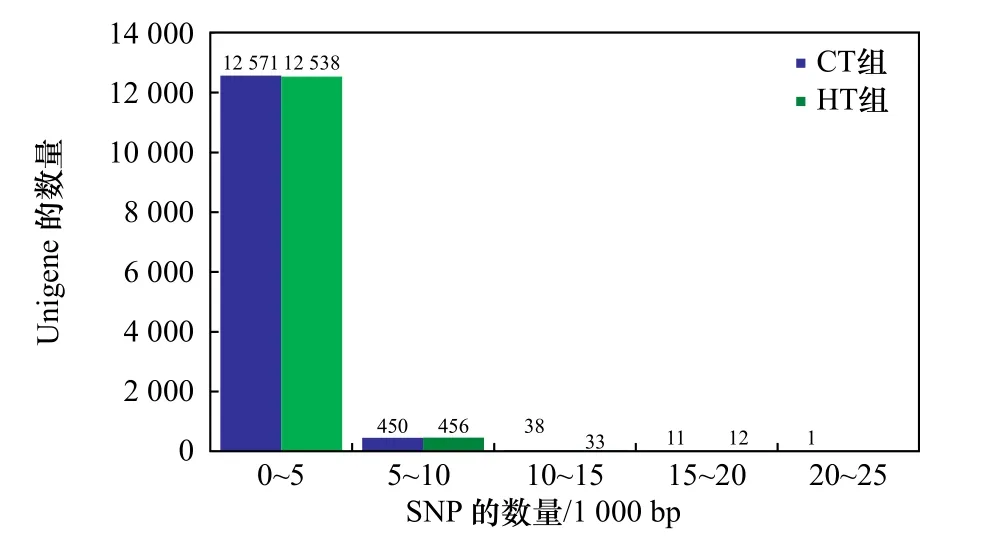
图1 SNP密度频数分布Fig. 1 The density frequency distribution of SNP
3.1.2 SNP的分布及转换、颠换信息
对于Unigene中SNP位点数目统计得出,CT组和HT组中分别含有1个SNP位点的Unigene有4 337和4 384条,含有2~10个SNP位点的Unigene有8 299和8 258条;含有10个以上SNP位点的Unigene有400条和402条(图2)。
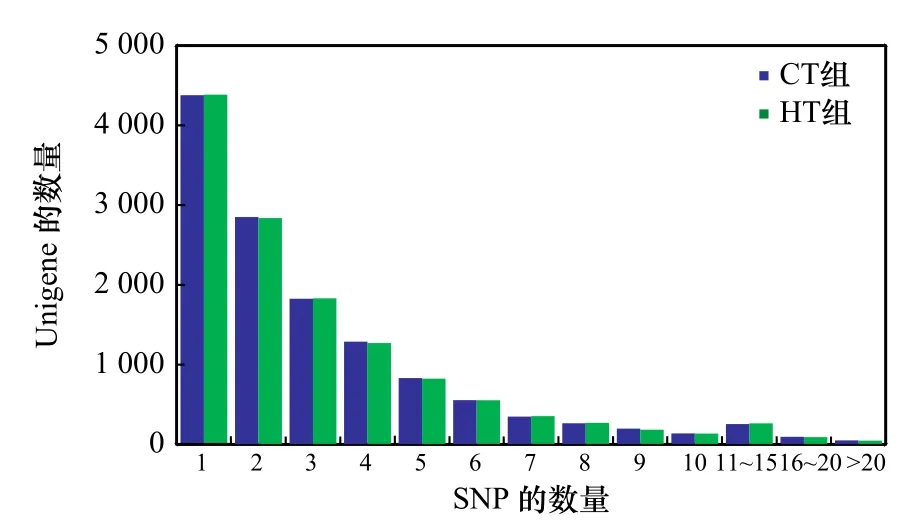
图2 SNP的分布统计Fig. 2 The statistics distribution of SNP
对军曹鱼SNP突变类型的数量分析表明,在纯合SNP位点中,转换数量明显高于颠换数量,即CT组SNP位点中,转换类型131 054个(60.69%),颠换类型84 899个(39.31%);HT组SNP位点中,转换类型131 587个(60.95%),颠换类型84 305个(39.05%)。在核苷酸的变异类型中,C-T发生转换的频率最高,分别占纯合SNP数的44.60%(CT组34 145个)和45.21%(HT组34 400个);T-A发生颠换的频率最高,分别占纯合SNP数的16.45%(CT组12 591个)和16.37%(HT组12 458个)(图3)。
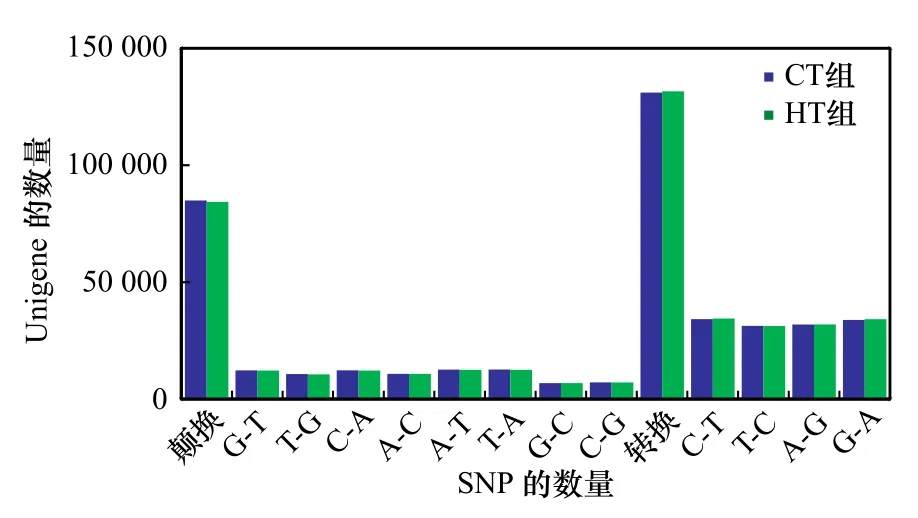
图3 SNP突变类型数量统计Fig. 3 The numbers of different mutation types statistics of SNP
3.1.3 SNP位置分析及突变类型分析
对军曹鱼肠道转录组SNP序列位置变异类型分析结果显示(图4),CT组和HT组中SNP位点总数分别为215 953和215 892个,位于内含子和基因间区的SNP位点较多。在CT组和HT组中,位于内含子的SNP位点分别占45.13%和44.62%;位于基因间区的SNP位点分别占24.66%和25.17%;位于外显子的SNP位点分别占20.53%和20.43%;位于基因下游的SNP位点分别占13.54%和13.71%;位于3′非编码区的SNP位点分别占8.74%和8.76%;位于基因上游的SNP位点分别占4.45%和4.44%;位于5′非编码区的SNP位点分别占2.20%和2.15%;位于基因上游和下游的SNP位点分别为2 031个和2 028个; 位于剪切位点的SNP位点分别为523个和518个。
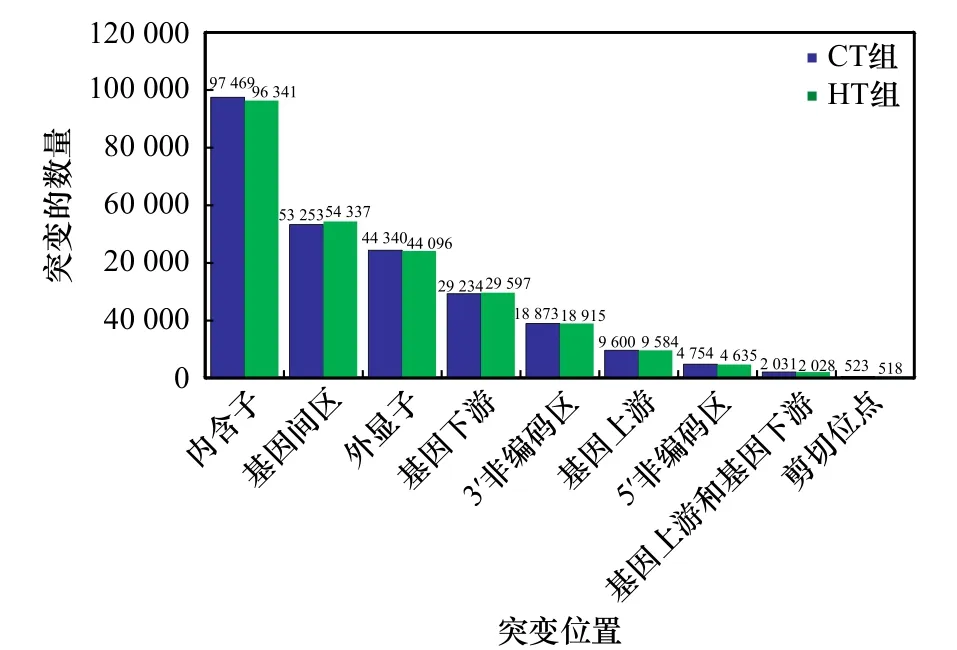
图4 SNP位置鉴定Fig. 4 Identification of SNP location
对SNP的突变类型分析结果显示(图5),突变的SNP位点数量较少,其中同义突变SNP位点数量占比最高,CT组为10.10%,HT组为10.04%;非同义突变SNP位点数量在CT组中占比为9.15%,HT组占比为9.11%。其他少量突变类型包括移码缺失、无义突变和非移码缺失等。

图5 SNP突变类型鉴定Fig. 5 Identification of SNP variants type
3.2 SNP-Unigene的注释与功能
将26 120条SNP-Unigene与GO数据库比对,结果显示,分布于生物学过程(Biological Process,BP)、分子功能(Molecular Function,MF)和细胞组分(Cellular Component,CC)3大功能分类的GO条目分别为8 043条、7 537条和7 854条,其中参与生物学过程的SNP-Unigene数量最多(图6)。将SNP-Unigene序列比对到KOG数据库进行注释和分类,结果显示,共有14 334条SNP-Unigene匹配到相应的注释信息,根据功能分为25类,其中以“信号转导机制”和“一般功能预测”类较多,分别包含2 822条和2 548条SNPUnigene(图7)。将26 120条SNP-Unigene序列进行KEGG富集分析,发现有5 160条SNP-Unigene富集到349条KEGG代谢通路中,其中以“信号转导” “全球概览地图”和“传染病”通路中富集的SNP-Unigene较多,分别为1 541条、1 123条和1 153条(图8)。
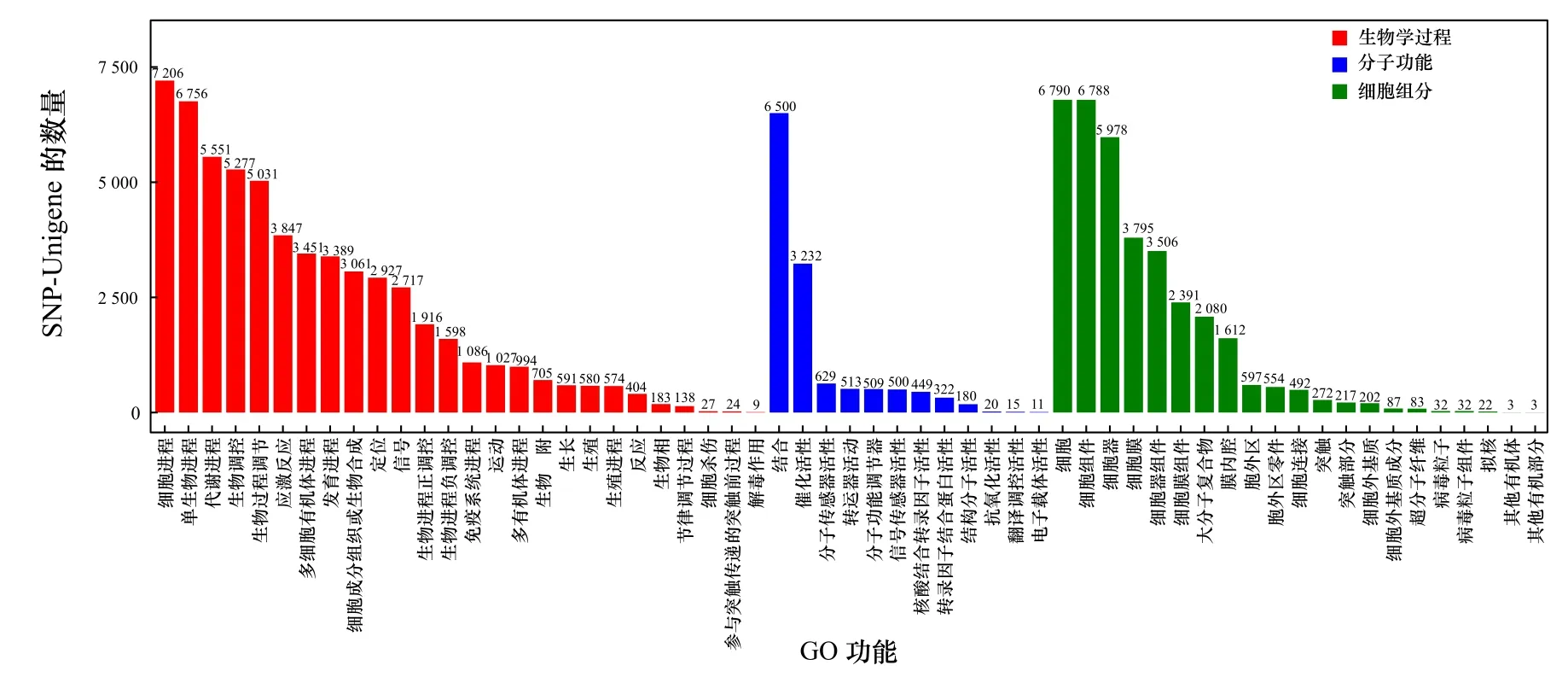
图6 SNP-Unigene GO功能注释分析Fig. 6 GO annotation analysis of SNP-Unigene
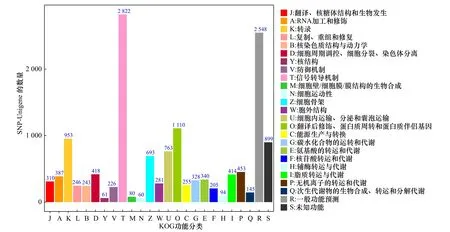
图7 SNP-Unigene KOG功能注释分析Fig. 7 KOG function annotation analysis of SNP-Unigene
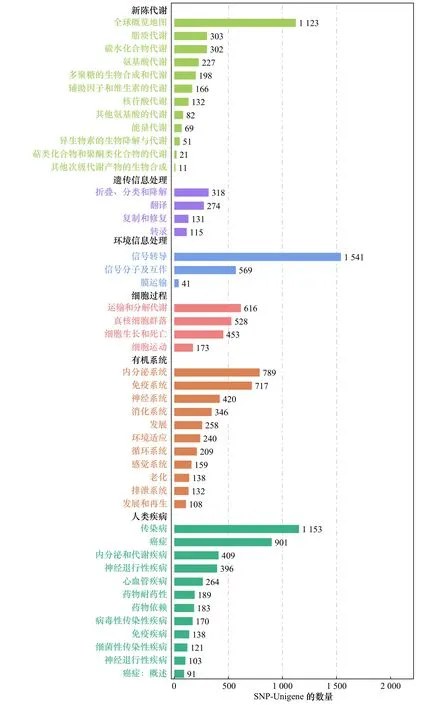
图8 SNP-Unigene的KEGG功能注释分析Fig. 8 KEGG classification of SNP-Unigene
3.3 免疫防御相关SNP-Unigene的富集及特异SNP位点
根据KEGG信号通路的富集分析,发现共有3 417条免疫防御相关的SNP-Unigene被注释到“MAPK信号通路”等35条与免疫相关的通路中,其中以“MAPK信号通路”中注释的SNP-Unigene最多(262条),其次分别为“神经活性配体-受体相互作用”(228条)、“Rap1信号通路”(190条)、“Ras信号通路”(164条)等信号通路(表2)。
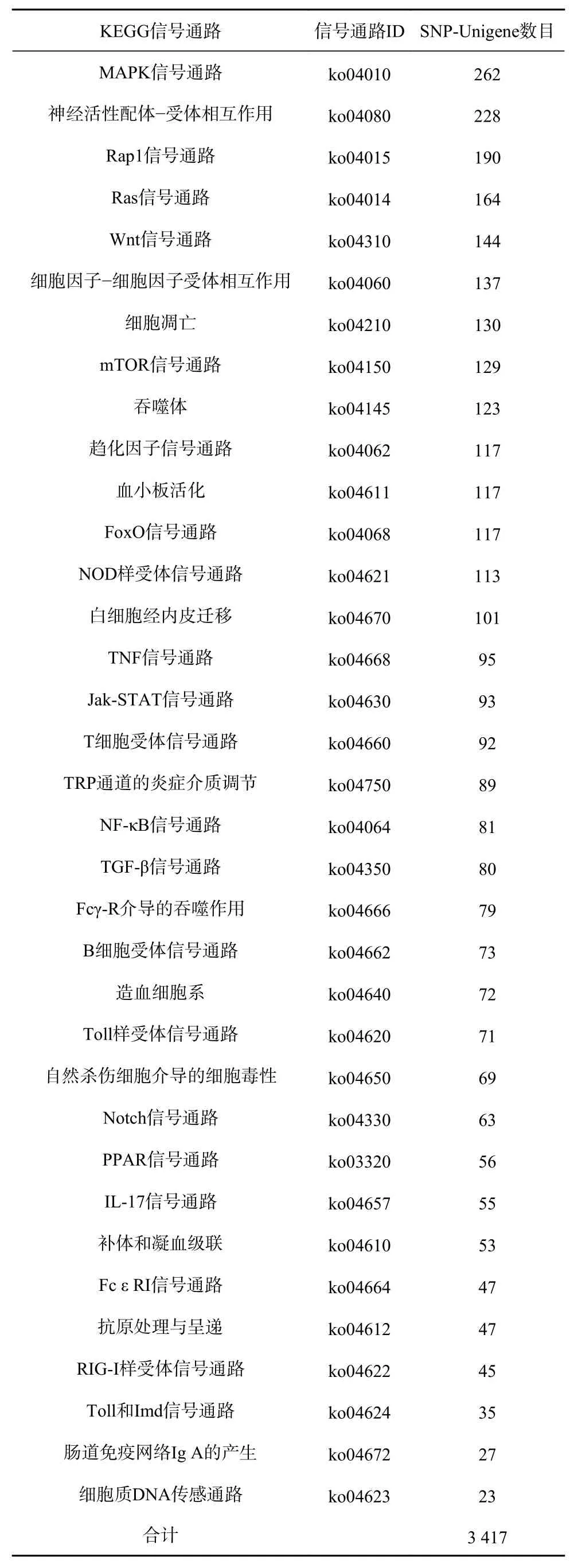
表2 免疫防御相关SNP-Unigene的KEGG富集分析Table 2 KEGG enrichment analysis of immune-related SNP-Unigene
3.4 差异表达免疫防御及低氧相关基因SNP位点分析
基于军曹鱼低氧胁迫后肠道转录组分析,得到大量的差异基因(筛选条件为错误发生率(False Discovery Rate,FDR)小于0.05且|log2FC|大于1,其中FC为差异倍数)。对“MAPK信号通路”等7个免疫通路及“HIF-1信号通路”中差异基因进行了SNP位点分析(表3)。
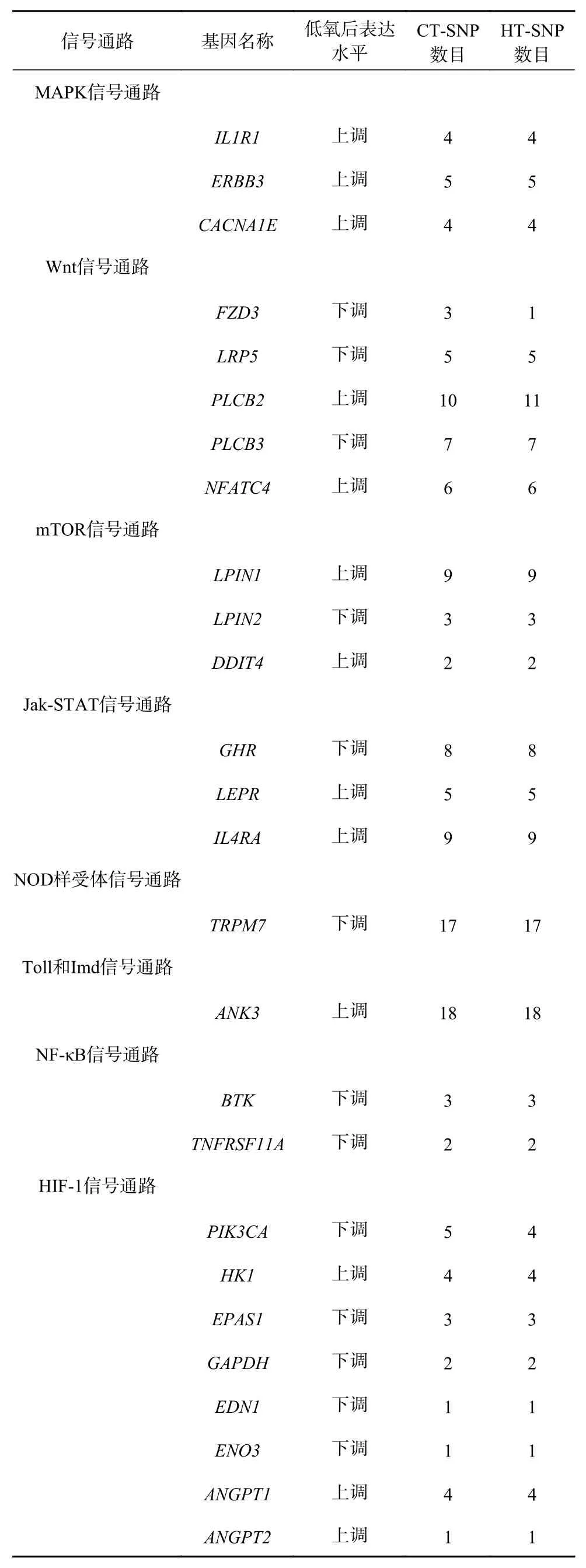
表3 CT和HT转录组中差异表达免疫防御及低氧相关基因SNP位点分析Table 3 SNP identified in differentially expressed immune and hypoxia-related genes in CT and HT transcriptomes
4 讨论
4.1 低氧胁迫下军曹鱼转录组数据中SNP位点鉴定及功能注释
SNP作为一种分子遗传标记,在水生动物的遗传选育中发挥着重要作用[25]。本研究从CT转录组、HT转录组数据中分别获得大量的SNP位点,SNP发生频率依次为0.00 586和0.005 858(1/171 bp),高于盐度胁迫对军曹鱼(1/730 bp)[27]、半滑舌鳎(Cynoglossus semilaevis)(1/491 bp)[32]、大 黄 鱼(Larimichthy crocea)(1/506 bp)[33]、罗氏沼虾(Macrobrachium rosenbergii)(1/1 152 bp)[24]、大西洋鲑(Salmo salar)(1/641 bp)[34]SNP发生频率,但低于马氏珠母贝(1/100 bp)[20]。有研究表明,不同物种中SNP分布频率差异很大,可能与研究物种、遗传背景和生存环境有关[19],也可能是因为在表达序列标签中筛选SNP的要求和条件不同[21]。SNP碱基替换是产生基因突变和推动进化的原始动力[35]。碱基替换类型分为转换(A-G和T-C的相互置换)和颠换(A-T、C-G、A-C、T-G的相互置换)。理论上,生物中发生颠换与转换比例为1∶2[23]。本研究中,SNP转换类型的比例约为60%,颠换类型的比例约为40%,转换大于颠换,符合“转换偏差”原理。在核苷酸变异类型中,C-T发生转换的比例最高,与大多数水产动物的研究结果相一致[19,36],原因可能是CpG二核苷酸上甲基化的胞嘧啶残基容易脱去氨基形成胸腺嘧啶[37],或受物种进化过程中承受的压力影响[38]。
根据SNP在基因组的分布位置可分为3类:基因编码区SNPs(cSNPs)、基因间SNPs(iSNPs)和基因周边SNPs(pSNPs)[39]。其中cSNP和pSNP会对基因的表达产生影响[22]。根据对生物遗传性状的影响,cSNPs又分为同义突变和非同义突变,前者编码序列的变化不会影响翻译后的氨基酸序列,故不会导致蛋白质的功能变化;后者编码序列的变化会引起翻译后氨基酸序列的变化,改变蛋白质的生物学功能[40]。由于受到较强的选择压力,非同义SNP位点的突变经常会影响生物的表型,而关于非同义SNP位点的研究已在团头鲂[25]、大黄鱼[41]有相关报道。对军曹鱼肠道转录组序列SNP位置和突变类型分析发现,位于基因编码区的SNP位点以及非同义突变SNP位点占比较多。因此,研究基因编码区非同义SNP可能对军曹鱼具有重要的生物学意义。此外,GO、KOG及KEGG功能注释结果表明,大部分SNP-Unigene涉及信号转导、传染病、代谢、癌症、内分泌系统和免疫系统等多种途径,表明军曹鱼幼鱼遭受低氧胁迫后,这些SNP-Unigene参与各种生命活动,并影响机体的各种生物学性状。
4.2 低氧胁迫下军曹鱼免疫相关基因SNP位点分析
免疫相关基因的SNP在水产遗传育种中的应用对鱼类抗逆性性状的选育具有重要意义[41]。在本研究中,为了解军曹鱼免疫防御机制,对转录组测序数据进一步分析,结果发现,3 417条SNP-Unigene被注释到35条与免疫防御相关的通路中,大部分SNP-
Unigene参与“MAPK信号通路” “神经活性配体-受体相互作用” “Rap1信号通路” “Ras信号通路”等免疫通路。我们从相关免疫通路中筛选出了大量差异表达的免疫相关基因及其SNP位点。因此,这里对部分关键基因进行后续的研究分析。
IL1R1是细胞表面重要的免疫基因,是白细胞介素-1β(IL-1β)的受体,在机体炎症反应和免疫信号转导过程中非常重要[42]。Lam等[43]研究报道,慢性缺氧时,大鼠颈动脉体细胞中促炎细胞因子及其受体(IL-1β和IL1R1)的表达量显著增加,表明其在颈动脉体局部炎症中起着重要功能。在本研究中,军曹鱼受低氧胁迫后,肠道IL1R1基因的表达量显著上调,提示IL1R1基因可能在军曹鱼免疫调节和抵御低氧应激中发挥着重要作用。此外,在基因多态性方面,已发现IL1R1基因的SNP与多种人类疾病相关[44]。胡亮[45]对岗巴绵羊的候选特异性SNP位点进行基因注释和富集分析,发现IL1R1和IL1R2基因参与炎症反应及自身免疫性调节。因此,暗示IL1R1基因可作为军曹鱼免疫防御的候选基因,这为今后进行IL1R1基因的多态性与疾病关联研究提供了参考。
Wnt信号通路是一个高度保守的系统,通过Wnt蛋白与细胞表面受体相互作用,调控着细胞增殖、分化和黏附等多种复杂的生物学过程[23,46]。Wnt配体蛋白与跨膜受体卷曲蛋白(FZD)和低密度脂蛋白受体相关蛋白(LRP5/6)形成的细胞表面受体复合物结合,从而激活细胞内的Wnt信号通路[47]。在本研究中,军曹鱼受低氧胁迫后,Wnt信号通路中FZD3和LRP5基因表达量显著下调,且存在多个SNP位点。目前有关鱼类中FZDs家族基因的研究主要涉及基因克隆、组织表达及在鱼类发育过程中的生理作用[48]。张丽晗等[48]研究了铜胁迫下黄颡鱼(Pelteobagrus fulvidraco)FZD家 族 基 因(FZD2、FZD3A、FZD4和FZD10)的mRNA水平。FZD3在小鼠和人的毛囊发育、细胞迁移等方面发挥着关键作用[49],已有研究者对该基因多态性位点进行分析,筛选影响性状的SNP位点。Zhao等[49]对中国美利奴羊FZD3基因的多态性进行检测,发现SNP1和SNP2与羊毛性状有显著的相关性,可作为绵羊育种的潜在遗传标记。LRP5基因在Wnt信号通路中扮演着重要角色,其突变与骨质疏松、癌症等疾病的发生密切相关[50]。已有研究表明[50],LRP5基因多态性与2型糖尿病患者的β细胞功能和脂质代谢有关。由此推测,FZD3和LRP5基因可能参与调控军曹鱼低氧应激过程中的免疫反应,具体机制有待进一步探讨,而研究这些免疫基因的SNP对低氧胁迫下军曹鱼免疫防御相关SNP位点的开发也具有潜在意义。
本研究结果表明,参与mTOR信号通路的差异基因LIPIN1表达水平上调,也存在多个SNP位点。Lipin1是由LIPIN1基因编码的磷脂酸磷脂酶,具有双向调控脂肪代谢的功能,既能催化磷脂酸去磷酸化得到二脂酰甘油,从而促进甘油三酯和磷脂的合成;还具有转录激活功能,参与调控脂肪代谢相关基因表达[51-52]。关于LIPIN蛋白家族的研究主要集中在蛋白功能和基因表达方面,多态性方面以小鼠、猪、牛等哺乳动物为主,水产经济动物较为匮乏。有报道称[53],LIPIN1基因受HIF-1调控,其表达水平上调与非脂肪细胞中的甘油三酯和脂滴的积累有关,提示LIPIN1是细胞适应低氧应激的重要中介物。He等[54]在猪的LIPIN1基因的编码区和UTR检测到5个SNP位点与猪的脂肪沉积性状存在显著相关。这些研究表明,LIPIN1基因可能对军曹鱼低氧胁迫过程中脂质代谢有一定程度的影响,可为LIPIN1基因多态性与目标性状关联研究提供了新思路。
4.3 低氧胁迫下军曹鱼HIF-1信号通路中差异基因SNP位点分析
除了免疫防御相关信号通路所涉及的差异基因外,还有多种基因是通过其他信号通路来共同应答鱼类的低氧胁迫。HIF-1信号通路是鱼类遭受低氧应激时的关键通路之一,通路中的相关基因不仅参与机体代谢的调控,而且还会通过抑制血红细胞的增殖和凋亡,提高血氧亲和力,以此来适应低氧应激[55]。在本研究结果中发现,HIF-1信号通路中存在PIK3CA、HK1、ANGPT1、EPAS1、GAPDH、ANGPT2、EDN1和ENO3等8个差异基因也同样含有多个SNP位点。
PIK3CA基因是编码I类磷脂酰肌醇3激酶(PI3Ks)的催化亚单位,其突变能激活PI3K/AKT信号通路,进而参与细胞增殖、凋亡和蛋白质合成等多种生理过程[56-57]。Zhang等[56]研究发现,SmPIK3CA基因参与大菱鲆的免疫反应,并在该基因中筛选出4个抗病相关的SNPs。EPAS1作为激活低氧调控基因表达的关键转录因子[58],在细胞代谢和氧化还原反应中起着重要作用。关于EPAS1基因SNP位点的研究多集中在藏族人和高原哺乳动物,在鱼类中的研究较少。在藏族人和高原动物低氧适应研究中发现,EPAS1基因都受到选择且信号显著。在牦牛中发现EPAS1基因多态性与血红蛋白(HGB)关系紧密[58]。在藏绵羊EPAS1基因与低氧适应相关性研究中发现,该基因第8内含子C871T 变异位点的等位基因(T)突变频率与海拔高度呈现正相关,且TT基因型能显著增加血红蛋白浓度[59]。由此推测,HIF-1信号通路中筛选出来的PIK3CA等8个显著差异基因可能对军曹鱼低氧相关SNP位点的挖掘具有重要的参考价值。
综上所述,本研究基于低氧胁迫下军曹鱼肠道转录组测序数据,获得了大量与免疫、低氧相关差异基因的SNP位点,丰富了军曹鱼分子标记的数据,这些候选标记将为今后深入了解军曹鱼响应低氧胁迫的分子机制、SNP分子标记开发和遗传连锁图谱构建等研究提供重要的理论依据。
