辅酶Q10对杜洛克猪精子冷冻保存效果的影响
2022-01-20董瑞兰韩先杰于光辉
罗 兰,崔 超,董瑞兰,韩先杰,于光辉*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.胶州市农业农村局,山东青岛 266300)
2018年8月非洲猪瘟传入我国,导致种猪活体引种受限,繁育场通过自繁自养和不引种的策略来应对疫情冲击。另一方面,我国地方猪种的种质资源也面临威胁,由于地方猪种每个品种都仅有一个或几个保种场在维持保种,一旦感染像非洲猪瘟这样的重大疾病,就会造成灭种。面对这一形势,猪精液冷冻技术成为解决猪繁育和保种问题的技术之一,该技术以冷冻精液的形式取代现有活体种猪销售,大幅降低了企业的生产和引种成本,并且对企业自身引进和自主培育的优秀种公猪的遗传资源实现有效保存,为将来猪育种工作提供丰富的遗传资源。但在超低温冷冻过程中猪精子极易受到氧化损伤,冷冻过程中产生的活性氧(ROS)会损害精子膜的通透性,由于公猪的精子膜胆固醇和磷脂比率低,并且胆固醇分子分布不对称,这种特定组成造成了公猪精子对冷休克的高度敏感性。辅酶Q具有很好的抗氧化性,在之前的研究中有提到,添加25 mmol/L辅酶Q对马冷冻精子有较好的抗氧化作用。另有研究发现,每天给种马饲喂1 g辅酶Q连续饲喂4周,可以改善种马精液冷冻后的精液质量。辅酶Q的抗氧化功能已被诸多研究证实,但其在猪冷冻精液保存中研究较少。本研究拟在猪冷冻稀释液中添加辅酶Q,通过检测精子的品质来证明添加辅酶Q对猪精冷冻技术的影响,为猪精冷冻技术在实际生产中的应用提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂 葡萄糖、柠檬酸三钠、柠檬酸、碳酸氢钠、EDTA-2Na、Tris、青霉素钠、硫酸链霉素等均为国药集团产品,细胞凋亡(Annexin V-FITC/PI)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、ATP含量等检测试剂盒均为南京建成公司产品。活性氧(ROS)、ATP、JC-1等检测试剂盒均为碧云天公司产品。辅酶Q、SYBR Green I、PI染液、AO染色试剂盒等均为索莱宝公司产品。RNAprep pure动物组织总RNA提取试剂盒、Evo M-MLV反转录试剂盒II、SYBR Green pro Taq HS qPCR试剂盒等均为青岛艾科瑞公司产品。OEP购自德国米尼图、封口粉和0.5 mL冻精细管均购自法国卡苏。
1.1.2 主要仪器设备 冷冻离心机(D-37520,Thermo)、移液枪、液氮罐、恒温箱、光学显微镜(CX21,Olympus,Japan)、水浴锅、pH计(FE20-K,梅特勒)、高压灭菌锅、冰箱、荧光定量PCR仪(CFX96,Bio-Rad,USA )、酶标仪(RZ-9618,天津瑞泽)、luminometer (GloMax 20/20,Promega,USA)、临界点干燥仪(EMS850,上海硕赛)、扫描电镜(JSM-7500F,JEOL,Japan)、分选型流式细胞仪(BD,USA)、计算机辅助精子分析系统(CASA-QH-III,中国)。
1.2 实验方法
1.2.1 稀释液配制 将Modena稀释液做为基础稀释液:称取葡萄糖2.75 g、柠檬酸三钠0.69 g、柠檬酸0.29 g、碳酸氢钠0.125 g、EDTA-2Na 0.235 g、Tris 0.565 g、青霉素钠1 000 IU/mL、硫酸链霉素0.1 g,用灭菌超纯水定容至100 mL,调整pH为7.2,然后用0.22 μm滤头过滤后置于4℃冰箱保存备用。降温稀释液(I液):11%的乳糖溶液80%、卵黄20%、不同浓度辅酶Q,置于4℃冰箱保存备用;冷冻稀释液(II液):95.5%的II液、3%甘油、1.5% OEP,置于4℃冰箱保存备用。
1.2.2 精液采集 精液来自山东省平度市环山托佩克种猪场8头体况良好、性欲旺盛且繁殖性能好的杜洛克种公猪。采用人工手握法采集中段精液并用双层纱布过滤,并将8头种猪过滤后的精液混合均匀,以消除个体差异。样品每周采集1次,经常规检测后活力达0.8以上,密度为“密”方可使用,鲜精运输前用基础稀释液1:1稀释,于2 h内17℃恒温箱保存送回实验室。
1.2.3 精液冷冻 鲜精17℃保温箱带回实验室,精液用蒸馏水按1:100的比例稀释后用血细胞计数板计数,计算精子密度。将精液与17℃保存过夜的基础稀释液按1:1等比例混合后置于17℃恒温箱平衡2 h,之后在预冷好的17℃离心机中800 ×g离心10 min,弃去上清。沉淀与I液按1:1-2稀释,并用移液枪吹打混匀,离心管用6~8层纱布包裹并放入4℃冰箱平衡约1.5 h,使之缓慢降温至4℃。平衡结束后按1:1加入II液稀释,使终浓度为每毫升5×10个精子,再放入4℃冰箱平衡30 min。平衡好后的样品需在4℃环境中快速用口吸法罐装进0.5 mL细管中,再用封口粉封口。将细管平铺到自制的细管托架上,保证每根细管相隔0.5 cm,使其更能充分熏蒸,把托架放入泡沫箱内,使其距液氮面3 cm,盖上盖子熏蒸10 min后迅速将细管投入液氮内,浸泡30 min后,按组别分别装进拇指管内并装入纱布袋中置于液氮罐中保存。解冻时将细管从液氮罐中取出,置于50℃水浴锅中解冻10 s后捞出用纸巾擦干细管表面水渍,剪开细管后与解冻液1:4混匀,于37℃水浴孵育10 min后进行检测。
1.3 检测指标与方法
1.3.1 精子活力与活率 采用计算机辅助精子分析系统(CASAS)进行精子活力检测,将精子样品解冻后600 ×g 4℃离心3 min,弃上清,PBS重复清洗3次,再用PBS重悬,将血细胞计数板置于 37℃载物台预热,再将精液样品缓慢注入,使之均匀流入整个计数室,每个样品观察5个视野,每个视野至少计数200个精子。
精子活力=直线运动精子数/总精子数
1.3.2 质膜完整率 将精子样品解冻后600 ×g 4℃离心3 min,弃上清,PBS重复清洗3次,再加入SYBR Green 1和PI染液置于37℃水浴锅中孵育10 min,随即用流式细胞仪检测,每个处理测定10 000个细胞,试验重复3次。SYBR Green I染色呈绿色荧光为质膜完整,PI染色呈红色荧光为质膜损伤。
1.3.3 顶体完整率 利用异硫氰荧光素标记的花生凝集素法(FITC-PNA)对精子顶体进行特异性染色,样品前期处理同上,并调整精子密度为每毫升2×10个精子,按试剂盒说明染色后随即进行流式分析,每个处理测定10 000个细胞,试验重复3次。FITC-PNA染料能特异性地标记在顶体膜上,其荧光强度可反映顶体大小,因此荧光强度可间接反映顶体结构的完整性。
1.3.4 DNA完整率 采用AO染色法检测精子DNA完整率。样品前期处理同上,取适量的细胞悬液和AO 染液按19:1的比例混合,轻轻混匀。室温避光染色15 min,上流式细胞仪分析。每个处理测定10 000个细胞,试验重复3次。当精子受到损伤时,其DNA在酸的作用下会变性成单链,发出红色或黄色荧光;而完整双链DNA则发出绿色荧光。
1.3.5 线粒体膜电位 采用JC-1检测试剂盒进行检测。样品前期处理同上,加入1 mL JC-1染色缓冲液(1×)重悬细胞,随即进行流式分析,每个处理测定10 000个细胞,试验重复3次。当膜电位较高时可以产生红色荧光,膜电位较低时则产生绿色荧光,用红绿荧光的相对比例来衡量线粒体去极化比例。
1.3.6 ROS水平检测 采用DCFH-DA荧光探针法进行检测,样品前期处理同上,将精子悬浮于稀释好的DCFH-DA中,调整浓度为每毫升2×10个精子,置于37℃水浴锅孵育20 min,每隔5 min颠倒混匀一下,使探针和精子细胞充分接触,随后用PBS清洗3次,以充分洗去未进入细胞内的DCFH-DA,随即进行流式分析,每个处理测定10 000个细胞,试验重复3次。
1.3.7 抗氧化相关指标的检测 精液解冻后用超声波细胞破碎仪破碎精子细胞,吸取上清液进行后续检测,CAT、SOD、GSH-Px和MDA含量严格按照试剂盒说明测定,随即用酶标仪进行检测,每个组检测3次。
1.3.8 ATP含量检测 精液前期处理同(7),采用碧云天增强型ATP检测试剂盒进行检测,用化学发光检测仪(Luminometer)进行检测,从0.1至1.0 μmol/ L的5个ATP梯度浓度中检测到ATP含量的标准曲线,试验重复3遍。
1.3.9 凋亡相关基因mRNA表达量的影响 参考NCBI获得猪精子凋亡相关基因的cDNA序列,并用Premier 5.0软件设计引物GAPDH为内参基因作为试验基因的对照,引物序列见表1。样品前期处理同上,试验过程中每个样品设置3个重复,用RNAprep pure动物组织总RNA提取试剂盒提取冻融后精子总RNA,再用Evo M-MLV反转录试剂盒II将总RNA反转录成cDNA,最后用SYBR Green嵌合荧光法进行荧光定量,反应体系为:2×SYBR Green pro Taq HS premix(1×)10 μL,上下游引物各0.4 μL,cDNA模板1.6 μL,加无RNA酶水至20 μL体系。反应条件为:预变性95℃ 30 s,变性95℃ 5 s,60℃退火30 s,重复40个循环,反应结束,得到荧光定量PCR的试验结果以及结果曲线。
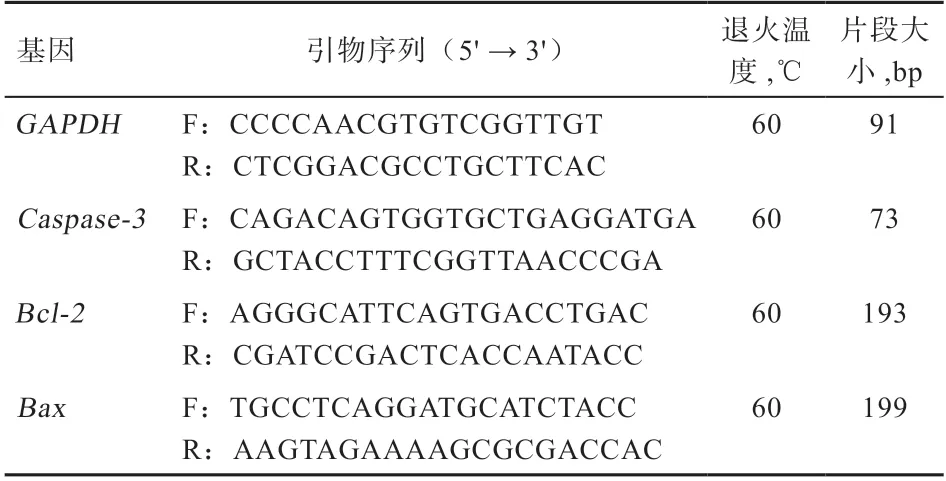
表1 4种PCR引物序列表
1.3.10 超微结构观察 精液解冻后滴于破碎的载玻片上,用2.5%戊二醛覆盖,放入4℃冰箱中固定3 h后用PBS清洗3次,每次10 min。再用30%、50%、70%、90%、100%的丙酮进行梯度脱水,随后用临界点干燥仪进行干燥处理,将干燥后的在玻片贴在贴有导电胶的喷金台上进行喷金,随后使用扫描电镜进行观察。
1.4 统计分析 采用SAS 9.4进行单因素方差分析数据显著性分析,结果用平均值±标准误来表示,<0.05为差异显著,<0.01为差异极显著。
2 结果
2.1 冷冻-解冻后辅酶Q对猪精子运动参数及活率的影响 如表2所示,与空白对照组相比,在冷冻稀释液中添加不同浓度的辅酶Q后曲线速度(VCL)提高(<0.01),150 μg/mL辅酶Q组直线速度(VSL)效果最佳。

表2 不同浓度辅酶Q10对精子运动参数及活率的影响
2.2 冷冻-解冻后辅酶Q对猪精子SOD、CAT、GSHPx、MDA、ATP的影响 由表3可知,冷冻稀释液中添加不同浓度的辅酶Q,均可提高精子解冻后SOD、CAT、GSH-Px活性(<0.01),同时提高精子ATP含量(<0.01),以及降低MDA含量(<0.01)。其中添加150 μg/mL辅酶Q时效果最佳,较空白对照组SOD酶活性提高8.76%、CAT酶活性提高0.82%、GSH-Px活性提高8.04%、ATP含量提高6.7%。而MDA含量在添加150 μg/mL辅酶Q时降低(<0.01),较空白对照组降低0.97%。所有指标在随添加量增加时均出现抑制现象。
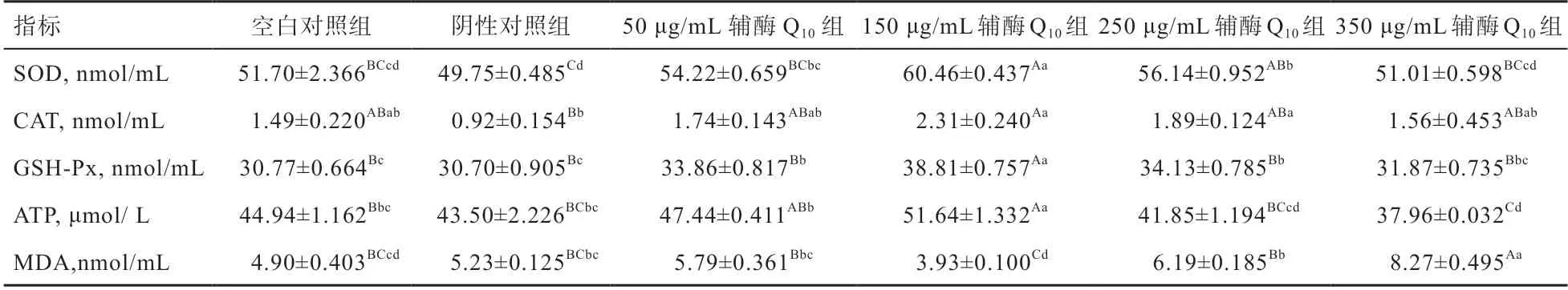
表3 不同浓度辅酶Q10对精子SOD、CAT、GSH-Px、MDA、ATP的影响
2.3 冷冻-解冻后辅酶Q对猪精子质膜完整率、顶体完整率、DNA完整率、ROS含量以及的影响 由表4可知,冷冻稀释液中添加不同浓度的辅酶Q均可提高精子解冻后质膜完整率、顶体完整率、DNA完整率和线粒体膜电位(<0.01),其中添加150 μg/mL辅酶Q时效果最佳,较空白对照组质膜完整率提高了17.42%、顶体完整率提高了14.31%、DNA完整率提高了6.73%、线粒体膜电位提高了7.59%。而ROS含量在添加150 μg/mL辅酶Q时降低(<0.01),较空白对照组降低了16.64%。所有指标在随添加量增加时均出现抑制现象,本实验中辅酶Q的最适添加量为150 μg/mL。
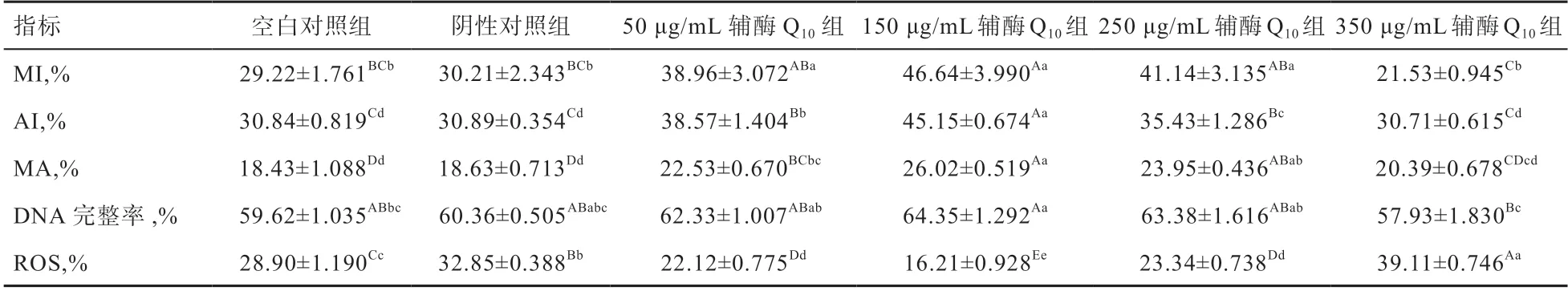
表4 不同浓度辅酶Q10对精子质膜完整率、顶体完整率、DNA完整率、线粒体膜位以及ROS含量的影响
2.4 冷冻-解冻后辅酶Q对猪精子凋亡基因表达量的影响 如图1所示,在整个扩增过程中,2种基因的熔解曲线都只有1个特异峰(高峰为目的基因,低峰为内参基因)。图2显示,基因在添加50 μg/mL和150 μg/mL辅酶Q的试验组中表达量高于空白对照组(<0.05);基因在添加辅酶Q150 μg/mL和250 μg/mL后表达量较空白对照组和阴性对照组均降低(<0.05);基因试验组表达量也低于空白对照组(<0.05)。
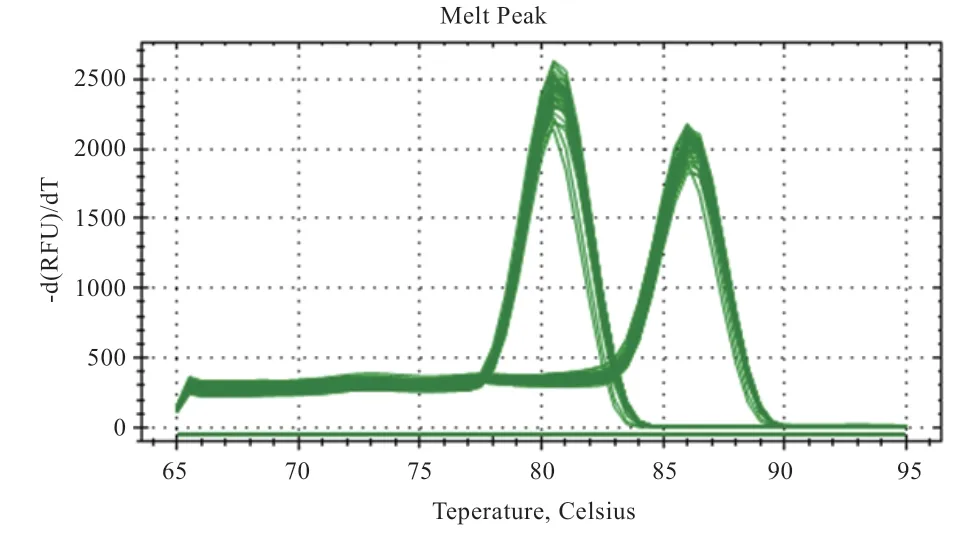
图1 Bcl-2和GAPDH基因熔解曲线
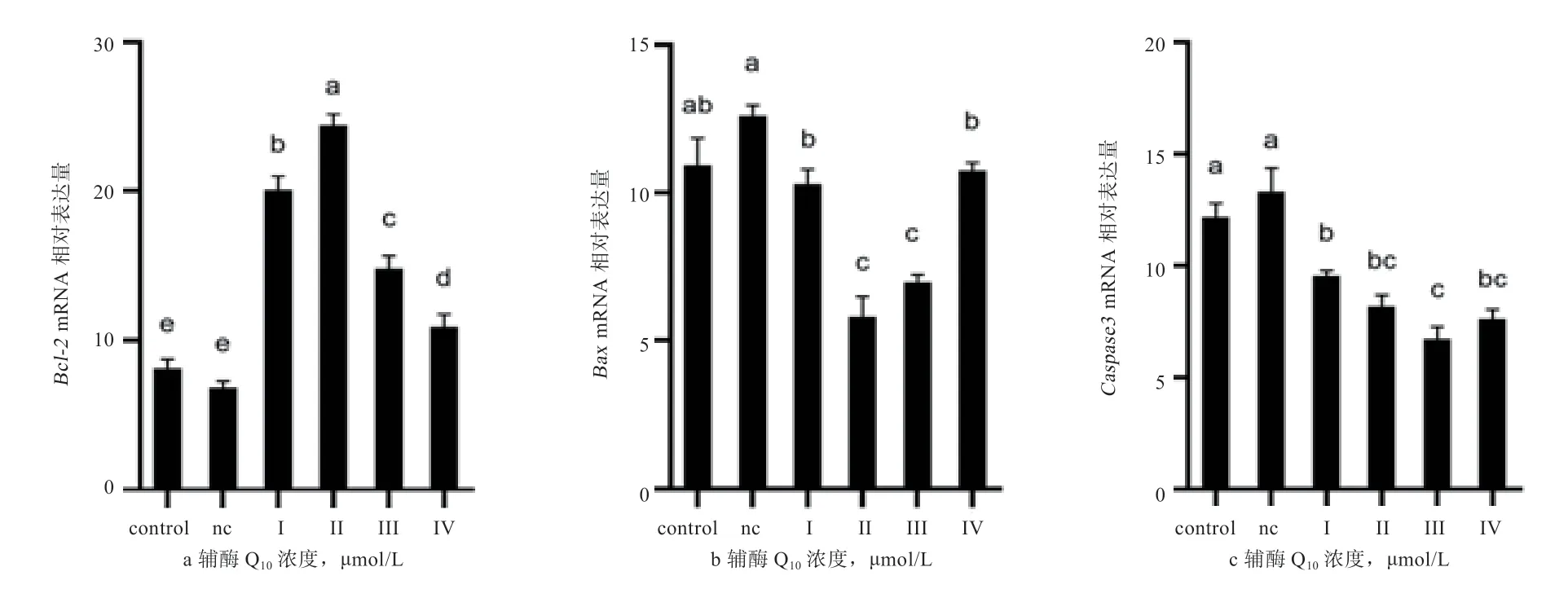
图2 辅酶Q10冻融精子后Bcl-2、Bax、Caspase3表达量
2.5 冷冻-解冻后辅酶Q对猪精子超微结构的影响SEM观察结果如图3所示,精子经冷冻后出现不同程度的损伤,主要表现在精子顶体表面粗糙,损伤大多在顶体和颈部。试验证明,经辅酶Q处理后的试验组精子较未经处理的对照组精子损伤更少,完整性更好,核均一,顶体结构完整,边界清洗,边缘整齐。

图3 猪精液冷冻-解冻后扫描电镜图
3 讨 论
抗氧化剂一直是猪冷冻精液研究中的热点,外源抗氧化剂是抵抗氧化应激并提高冷冻保存过程中精子质量的有效策略。近年来辅酶Q或泛醌等物质作为抗氧化剂研究较热,其主要作用是作为线粒体呼吸链中的电子载体在三磷酸腺苷合成中发挥作用,此外,它是天然存在的化合物,广泛分布在动物有机体和人类中。
朱振东研究发现,随着精子中ROS水平升高,ATP的产生和线粒体转录系统都受到破坏,精子呈现线性运动模式,而在低糖稀释液中添加100 nmol/L辅酶Q可显著提高精子的直线运动,直线运动速度以及精子的总活率。另有研究发现在马冻精稀释液中添加辅酶Q改善了解冻后精子的总运动能力,并且当辅酶Q与-生育酚联合使用时能更有效预防冷冻精子的脂质过氧化。本实验中,添加不同浓度辅酶Q组精子的各项运动参数和活率较空白对照组显著提高,其中添加150 μg/mL时精子的各项运动参数最好,活率最佳,说明辅酶Q对精子的活率及运动能力有所提高。精液在冷冻过程中ROS增高是引起精子脂质过氧化损伤的一个重要原因,孟佳等研究发现辅酶Q与维生素E联合使用能显著提高衰老老鼠血液中的SOD活性,并且明显降低MDA含量。在猪精液冷冻过程中,SOD、GSHPx、CAT活性变化在一定程度上能影响猪精子脂质过氧化损伤。张斌等研究表明,超低温冷冻保存会破坏姜曲海猪的精子酶系统,导致多数酶活性降低。本研究发现,添加辅酶Q可显著提高SOD、GSH-Px、CAT活性,增加ATP含量,同时也显著降低了MDA含量,由此可见,添加辅酶Q能有效改善冷冻精液品质。从结果来看,相较于空白对照组,随着辅酶Q添加量的增加,效果也在逐渐变化,其中添加150 μg/mL辅酶Q效果最好,当添加量为350 μg/mL时,效果与空白对照组没有显著差异。
霍敏等研究发现当辅酶Q添加量为40 μg/mL时能显著提高绵羊精子的质膜完整率、顶体完整率、线粒体膜电位。而精子冷冻后会破坏精子的线粒体功能并刺激精子产生过量的ROS,过量ROS导致精子的抗氧化防御系统失灵,致使精子进入氧化应激状态。ROS还通过其脂质过氧化物MDA直接氧化精子DNA碱基或与DNA的共价键,从而导致DNA双链断裂和细胞凋亡的发生。在牛冻精稀释液中补充辅酶Q可增强精子的运动性、活率、质膜完整性,并提高精子的顶体完整率。本研究中,与空白对照组相比,在稀释液中添加不同浓度的辅酶Q均能显著提高精液冷冻-解冻后的质膜完整率、顶体完整率DNA完整率、线粒体膜电位,同时ROS含量也显著降低,添加量为150 μg/mL辅酶Q时效果最好;当添加量到达350 μg/mL时的顶体完整率和DNA完整率较空白对照组降低,ROS含量升高,说明超过适宜添加量后,辅酶Q反而会破环精液品质。这可能是由于辅酶Q在脂膜中的作用类似于胆固醇,其通过脂膜的调节作用来提高细胞膜的稳定性,从而维持细胞膜结构和功能的完整性,起到提高冷冻精液质量的作用。
精子在冷冻-解冻过程中不仅DNA会受到损伤,也会受外界影响而发生精子细胞凋亡,而细胞凋亡则是由凋亡基因控制下的相关信号传导引起的。家族中的基因是一个促凋亡基因,该基因是通过激活家族蛋白酶系统和水解酶来诱导细胞凋亡,而就是家族中的一员。邓莹莹研究发现通过抑制细胞氧化损伤与凋亡发生相关因子表达能够促进凋亡抑制因子的表达量。本研究中基因在添加量为150 μg/mL辅酶Q时表达量显著升高,和表达量较空白对照组均降低。由此可见在冷冻稀释液中添加辅酶Q能有效提高抗凋亡因子的表达量,同时降低促凋亡因子和表达量,从而提高冷冻精液解冻后的精子活率。这可能是由于辅酶Q能保护线粒体DNA,维持线粒体呼吸链的的完整性,从而达到减少细胞凋亡的作用;另一方面可能是由于辅酶Q能增加线粒体ATP的产生效率,促进了细胞的新陈代谢,从而延缓了细胞凋亡;也可能跟抑制线粒体去极化的凋亡通路有关,但这方面的研究较少,还需进一步探讨。
精子进行超低温保存超微结构观察研究中,本研究发现精子冻融后主要损伤在顶体和颈部,表现为顶体表面粗糙,颈部断裂等,这与刘莉的研究结果一致。因此需要进一步探索能保护精子膜的保护剂,才能更有效地降低冷冻对精子功能和结构的损伤。
4 结 论
本研究结果表明,在猪精液冷冻过程中添加辅酶Q能显著提高解冻后精子质量,以添加150 μg/mL效果最佳。
