人参皂苷Rg1 对人脐血间充质干细胞活性和成血管分化的影响
2022-01-19周奇妙彭阿建朱芙蓉谭梅鑫王晓琴彭佳蕊
周奇妙 彭阿建 张 熙 朱芙蓉 谭梅鑫 王晓琴 彭佳蕊 熊 武
1.湖南中医药大学第一附属医院烧伤整形科,湖南长沙 410007;2.湖南中医药大学中西医结合学院,湖南长沙 410208;3.湖南中医药大学临床医学院,湖南长沙 410007
间充质干细胞(mesenchymal stem cell,MSC)是一种可以多向分化的成体干细胞,具有很强的修复重建能力,可以促进内皮细胞增殖和迁移,甚至在特定环境下可分化为内皮细胞,促进损伤部位的血管再生和内皮重建[1]。目前关于MSCs 参与血管新生的研究已成为血管新生领域的研究热点,而这与其细胞活性和增殖能力关系紧密。现已有研究发现,中药干预可提高MSCs 的活性和增殖能力,有助于MSCs 发挥促进血管新生的作用[2-3]。现代药理研究表明,人参含人参皂苷(ginsenoside,GS)Ro、Rb1、Re、Rg1 等多种皂苷类成分,以及多糖、氨基酸、黄酮类等,其中GS-Rg1 为其主要活性成分之一[4]。GS-Rg1 具有降血糖[5]、降血脂[6]、促血管新生[7]、抗氧化应激[8]、减轻炎症反应[9]等作用。目前关于GS-Rg1 发挥血管新生作用的研究主要集中在血管内皮细胞,而针对GS-Rg1 是否能通过诱导非内皮细胞促进血管新生的研究鲜有报道。本研究将GS-Rg1 联合具有血管内皮分化潜能的人脐血MSCs 进行细胞活性和体外成血管分化研究。
1 材料与方法
1.1 主要药品试剂
胎牛血清(10270-106),购自美国GIBCO;抗血小板-内皮细胞黏附分子-1(anti-platelet endothelial cell adhesion molecule-1,anti-CD31)抗体(ab28364),抗血管性血友病因子(anti-von Willebrand factor,antivWF)抗体(ab154193),山羊抗小鼠IgG H&L(异硫氰酸荧光素)(ab6785),购自英国Abcam;CCK-8 试剂盒(C0037),购自上海碧云天生物技术研究所;DMEM/F12 培养基(SH30023.01B)、磷酸盐缓冲液(SH30256.01B),购自美国Hyclone;Matrigel 基质胶(354234),购自美国BD BioCoat;成骨诱导分化培养基(HUXMA-90021),成脂诱导分化培养基(RASMD-90031),购自美国Cyagen;成软骨诱导分化培养基试剂盒(HUXUB-90042),购自美国OriCell;DAPI 染液(D9542)、油红O 溶液(O1391-250ML)、茜素红染液(130-22-3RT),购自美国Sigma;阿利新蓝染液(MAS0981),购自中国MesGen;抗人CD44 抗体(异硫氰酸荧光素)(338803)、抗人CD73 抗体(藻红蛋白)(344003)、抗人CD105 抗体(别藻蓝蛋白)(323207),购自美国Biolegend。
1.2 主要仪器
CO2培养箱(XD-101),日本SANYO;生物倒置显微镜(BX51),日本OLYMPUS;台式低速离心机(5804R),德国Eppendorf;热电酶标仪(MK3),美国Thermo;共聚焦显微镜(LSM800),德国蔡司。
1.3 研究方法
1.3.1 人脐血MSCs 的培养和鉴定 无菌条件下取足月健康新生儿脐带血10 ml(标本采集获得产妇和家属同意,签署知情同意书并获湖南中医药大学第一附属医院伦理委员会同意,批准文号:HN-LL-KY-2020-013-01),用密度梯度离心得到单个核细胞,移入含5%胎牛血清、1%双抗的DMEM/F12 培养基中,放在37℃培养箱中培养24 h 后换液,去除漂浮细胞,换培养液,继续培养至第7 天,细胞生长达90%融合时进行传代培养,每隔2 d 换液1 次。取第3 代人脐血MSCs 于光学显微镜下观察细胞形态,取第4 代分别进行成骨、成软骨和成脂诱导分化鉴定。
1.3.2 最佳浓度GS-Rg1 的确定 收集对数生长期人脐血MSCs,胰酶消化后调整细胞悬液浓度,置于96 孔板中,1×105个/孔;在37℃、5%CO2温箱中培养24 h,待细胞贴壁。在96 孔板中配制100 μl 的细胞悬液,将培养板在37℃,5%CO2的培养箱预培养24 h;然后向培养板分别加入0、5、10、20、40、80 mg/L GS-Rg1 与人脐血MSCs 进行联合培养。经孵育48 h 后,依据CCK-8 试剂盒说明书要求,用酶标仪测定各浓度下细胞在450 nm 处的光密度(optical density,OD)值,并设置对照孔,每组设定3 个复孔,筛选出GS-Rg1 促人MSCs 增殖的最佳浓度。
1.3.3 实验分组 将第4 代人脐血MSCs 分为实验组和对照组,实验组用最佳浓度的GS-Rg1 处理;对照组用等体积的磷酸盐缓冲液处理。
1.3.4 GS-Rg1 对人脐血MSCs 细胞活性的影响 将细胞置于37℃、5%CO2温箱培养24 h,使细胞贴壁。取处于指数生长期的细胞接种到96 孔板上,实验组中加入最佳浓度的GS-Rg1,对照组用等体积磷酸盐液处理,将96 孔板中配制100 μl 的细胞悬液。将培养板在培养箱预培养24 h,再孵育24 h,向每孔加入10 μl CCK-8 溶液。将培养板在培养箱内孵育4 h,同时设置空白组,用酶标仪测定各组在450 nm 处的OD 值,每组设定3 个复孔,细胞活性=[(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD 值)]×100%。
1.3.5 GS-Rg1 诱导人MSCs 体外血管生成实验 基质胶4℃过夜溶解,移液枪枪头盒、EP 管、96 孔板均4℃过夜预冷;第2 天于冰盒上铺胶,50 μl/孔加入96 孔板,37℃孵箱放置30 min;当人脐血MSCs 增殖至培养皿底部的80%~90%时,使用胰酶消化并重悬,每孔加入1 ml 重悬液,细胞密度达到1×105个/孔;实验组用最佳浓度GS-Rg1 加入基质胶,对照组用等体积磷酸盐缓冲液处理;37℃孵育,培养24 h 后,倒置显微镜下观察并拍照3 张,选取最典型的图片展示,采用Image J 分析内皮细胞形成的管腔长度,管腔长度=主干长度+分支长度,成管长度取3 次平均值。
1.3.6 内皮分化指标CD31、vWF 测定 将载玻片放入培养板里,然后将2 ml 含有1×106个/ml 第4 代人脐血MSCs 悬液滴加在玻片上,加入最佳浓度GSRg1,48 h 后取出载玻片;放入-20℃冷丙酮中固定30 min,用磷酸盐缓冲液冲洗3 次,2 min/次;滴加3%过氧化氢溶液室温孵育10 min,磷酸盐缓冲液冲洗3 次,2 min/次,0.5%Triton X-100 室温通透20 min;磷酸盐缓冲液浸洗3 次,3 min/次,吸干缓冲液,再滴加正常山羊血清,室温封闭30 min;吸掉封闭液,每孔分别滴加CD31 及vWF 一抗并放入湿盒,4℃孵育过夜;磷酸盐吐温缓冲液浸洗细胞3 次,3 min/次,吸取一抗,再滴加稀释后的荧光二抗,湿盒中孵育1 h,磷酸盐吐温缓冲液浸洗3 次;滴加DAPI 避光孵育5 min,对标本进行染核,洗去DAPI;吸干液体,荧光显微镜下观察采集图像,使用Image-Pro Plus6.0 软件进行定量分析。
1.4 统计学方法
采用SPSS 24.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t检验。多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 细胞培养结果
显微镜下可见细胞形态均一,呈长梭形的成纤维细胞样形态,是MSCs 的典型形态。见图1。
图1 光学显微镜下第3 代人脐血间充质干细胞(200×)
2.2 第4 代细胞诱导分化鉴定结果
成骨、成软骨和成脂诱导分化鉴定染色结果均可见大量深染色部分,显示其为MSCs。见图2。
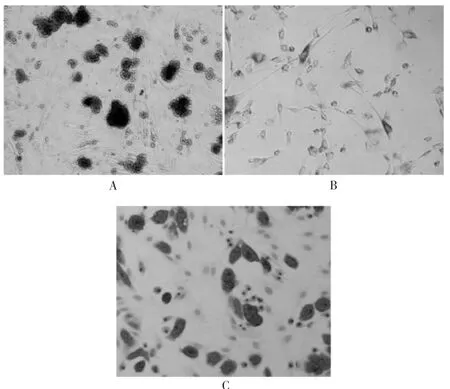
图2 人脐血间充质干细胞成骨、成软骨和成脂分化鉴定结果(400×)
2.3 不同浓度GS-Rg1 作用下人脐血MSCs 增殖能力比较
GS-Rg1 浓度为40、80 mg/L 时,人脐血MSCs OD值高于其浓度为0、5、10、20 mg/L 时,差异有统计学意义(P <0.05)。GS-Rg1 浓度为80 mg/L 时,人脐血MSCs OD 值与其浓度为40 mg/L 时比较,差异无统计学意义(P >0.05)。见图3。
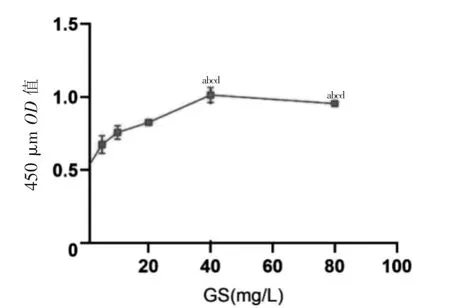
图3 不同浓度GS-Rg1 作用下人脐血间充质干细胞增殖能力比较
2.4 两组细胞活性比较
实验组细胞活性为(97.36±0.72)%,对照组细胞活性为(83.61±3.14)%,实验组高于对照组,差异有统计学意义(t=13.75,P <0.05)。
2.5 两组体外成管情况
实验组可见网状结构形成,对照组则多为细胞分散存在,见图4。实验组管腔长度长于对照组,差异有统计学意义(P <0.05),见图5。
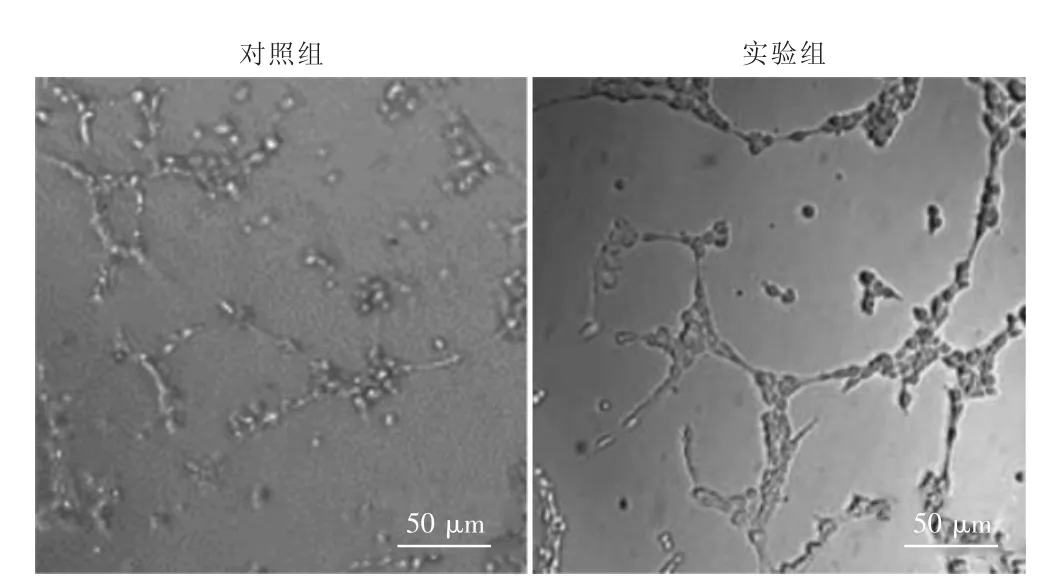
图4 两组体外成管情况
2.6 两组CD31、vWF 荧光强度比较
实验组CD31、vWF 荧光强度强于对照组,差异有统计学意义(P <0.05)。见图6。
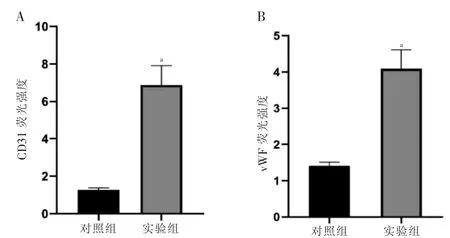
图6 两组CD31、vWF 荧光强度比较
3 讨论
GS-Rg1 是人参的重要活性组分之一,其生理活性作用极为广泛,而在细胞层面上,具有上述类似功能的MSCs 为进一步研究其相关机制开辟了新途径。目前已有研究表明,GS-Rg1 可促进人或动物组织来源的MSCs 增殖[10-11]、血管新生[12],并能诱导MSCs 在不同环境中定向分化成各种体细胞。目前研究表明,GS-Rg1 可诱导MSCs 表达神经元特异性烯醇化酶、胶质纤维酸性蛋白及神经生长因子,促进MSCs 增殖及向神经细胞分化[13]。Yin 等[14]研究发现,10 μmol/L的GS-Rg1 溶液可促进人牙周膜源MSCs 增殖,上调MSCs 碱性磷酸酶、骨桥蛋白和骨钙素等因子的表达,最终促进人牙周膜源MSCs 的成骨分化。Xu 等[15]发现,GS-Rg1 可提高第3 代人乳腺脂肪源MSCs 增殖能力,且能促进其向软骨细胞分化。GS-Rg1 可通过上调Ⅱ型胶原、酸性磷酸酶及弹性蛋白mRNA 水平来促进人乳腺脂肪源MSCs 向软骨细胞分化。由此可知,在一定条件下GS-Rg1 可诱导不同来源MSCs 向神经细胞、骨细胞及软骨细胞等定向分化。
MSCs 已经被证明在细胞实验和动物实验及临床中有促进血管生成的作用。MSCs 血管生成特性可归因于直接分化为内皮细胞[16]和旁分泌效应[17]。目前MSCs 主要的诱导分化方法包括外源性生长因子诱导MSCs 分化、基因修饰诱导MSCs 分化、将MSCs 与其他细胞共培养的方式诱导MSCs 分化等[18-19]。目前体外研究MSCs 向血管内皮细胞分化常使用的诱导因子有血管内皮生长因子、碱性成纤维细胞生长因子及表皮生长因子等。其中血管内皮生长因子是血管内皮中最具特异性的分泌性生长因子,是正常血管形成和血管新生的必需调控因子[20-21]。此外,目前有多种中药活性成分及复方能诱导MSCs 向内皮细胞分化。周细胞是血管内壁的重要构件之一,能调节内皮细胞的功能,支撑血管的管腔结构。黄芪甲苷可激活TGF/Smad2 途径介导MSCs 分化为周细胞[22]。黄芪甲苷、丹参酮ⅡA 干预MSCs 后,能提高血管壁主要连接蛋白Cx37、Cx40 和Cx43 表达,促进MSCs 分化为内皮细胞[23]。由此可知,中药可以促进MSCs 定向分化成血管相关细胞。GS-Rg1 被证实能促进血管新生,但GS-Rg1能否通过诱导MSCs 实现定向成血管分化,目前鲜见相关研究。
种宗雷等[24]通过研究不同浓度GS-Rg1 干预人脐带MSCs 发现GS-Rg1 对其增殖有显著的促进作用,可减轻H2O2对人脐带MSCs 的损伤。但该研究设置的低、中、高3 个剂量组分别为0.5、4.0、32.0 μmol/L,研究结果提示GS-Rg1 的浓度与人脐带MSCs 的增殖呈正相关,而高剂量组32.0 μmol/L 不是促进人脐带MSCs 增殖的最佳浓度。本研究通过设置GS-Rg1 浓度梯度,研究其对人脐血MSCs 增殖功能的影响,发现GS-Rg1 促人脐血MSCs 增殖的最佳浓度为40 mg/L。进一步研究结果提示GS-Rg1 对人脐血MSCs 的细胞活性有促进作用,是具有制药前景的细胞活性药物。本研究结果提示,GS-Rg1 干预后人脐血MSCs 体外成管能力及表达内皮细胞特异性标志物CD31、vWF能力增强,为进一步探寻GS-Rg1 干预人脐血MSCs 后发挥促进血管新生的分子机制做铺垫,并为未来GSRg1 更好地应用于临床提供理论依据。然而,本研究未涉及分子通路和动物实验验证,GS-Rg1 促进MSCs发挥血管新生功能的具体机制亟待更深入的研究。
