黄藤素与6种抗生素联用对禽源耐药金黄色葡萄球菌的体外抗菌作用
2022-01-18刘超怡王宇泊赵一霖张翼翔徐成竹徐海瑛许素华温盛楠
刘超怡 , 王宇泊 , 赵一霖 , 张翼翔 , 徐成竹 , 徐海瑛 , 许素华 , 温盛楠
(1.黄河科技学院医学院 , 河南 郑州 450063 ; 2.郑州澍青医学高等专科学校 , 河南 郑州 450064)
金黄色葡萄球菌(Staphylococcusaureus,SA)是一种广泛分布于自然界的革兰阳性条件致病菌,能够分泌一系列的外毒素和酶,可造成人和动物局部化脓性感染等疾病[1]。SA对营养要求不高,耐盐性较强,在自然环境中、人体皮肤表面、动物皮毛及排泄物中广为分布。近年来,随着养殖业高度集约化的发展,抗生素、消毒剂的不合理使用,导致SA耐药菌株大幅度增加,多重耐药菌的检出屡见不鲜。赵效南等对生鲜牛乳样品中分离的148株SA进行药物敏感性试验,SA对青霉素的耐药率为77.7%,对红霉素的耐药率为58.1%,对万古霉素和阿莫西林/克拉维酸的耐药率较低,分别为0.7%和1.4%[2]。刘茜等从安徽病禽肝脏分离出103株多重耐药金黄色葡萄球菌,耐药菌株从三重到八重耐药均有分布,主要集中在五重(43/103)、四重和六重耐药,药敏试验结果显示,β-内酰胺类的耐药率最高(79.6%),氨基糖苷类次之(71.8%)[3]。多重耐药菌的高耐药性可以在动物之间传播,给畜牧业的临床治疗带来困扰,更加值得关注的是动物体内的葡萄球菌可以作为耐药基因的贮存库威胁人类健康[4-5]。
黄藤素(Fibriuretinin)是我国自行研发的纯天然药物。天然黄藤素主要从防已科植物黄藤(FibraurearecisaPierre)的干燥藤茎中提取获得,是黄藤的主要药效成分之一,主要化学成分为巴马汀,属生物碱类[6]。随着2010年版《中华人民共和国兽药典》黄藤素提取物质量标准的颁布,黄藤素在畜牧业中广泛用于治疗菌痢、肠炎。但是对动物源致病菌的抑菌作用报道较少,对于多重耐药菌的抗菌作用未见报道。本试验通过体外抑菌试验观察黄藤素与抗生素联用对耐药金黄色葡萄球菌的抑菌效果,为黄藤素防控禽源多重耐药菌的感染与流行提供参考。
1 材料与方法
1.1 试验药品 黄藤素,购自山西易多利动物药业有限公司,批号:2014(041036146);药敏纸片:红霉素、青霉素、四环素、万古霉素、庆大霉素、克林霉素、头孢西丁,均购自杭州天和微生物有限公司。
1.2 试验菌株 金黄色葡萄球菌标准菌株(ATCC25923),购自中国典型培养物保藏中心;金黄色葡萄球菌临床分离菌株来源于规模养禽场,经药敏试验测定,选择编号为RS1、RS2、RS3的3株标本进行试验。
1.3 主要试剂与仪器 LB、MH(B)、MH(A)营养琼脂培养基,均购自北京奥博星生物技术有限公司。立式高压灭菌器(型号为BXM-30R)及干燥箱(型号为BGZ-246),上海博讯实业有限公司医疗设备厂制造;隔水保温箱(型号为GH-500BC),北京市永光明医疗仪器有限公司制造;超净台(型号为SW-CJ-1FD),上海锦昱科学仪器有限公司制造;电子分析天平(型号为FA2004 N),上海箐海仪器有限公司制造。
1.4 菌株活化 菌种自然解冻,吸取10 μL放入4 mL LB 液体培养基中,37 ℃ 振荡培养 18 h,转接 MH (B)平板,无菌操作挑取孵育 16 h 的单菌落,置于MH(B) 肉汤中,校正至 0.5 麦氏浓度。
1.5 临床分离菌株的耐药性检测 采用美国临床实验室标准化委员会(CLSI) 推荐的 K-B 法进行药敏试验[7],游标卡尺测量药敏纸片抑菌圈直径,每次试验用ATCC25923质控,重复3次取平均值,结果参照CLSI标准判读。
1.6 黄藤素最小抑菌浓度的测定 采用微量稀释法测定黄藤素最小抑菌浓度(Minimum inhibitory concentration,MIC),评价其抗菌活性。
1.6.1 药液制备 黄藤素注射液原液的初始浓度为10 mg/mL,经生理盐水2倍倍比稀释后备用。
1.6.2 菌液制备 活化后的标准菌株及耐药菌株校正浓度至0.5麦氏单位,取MH肉汤将上述菌悬液进行1∶100稀释后备用,含菌量约为1.5×106CFU/mL。
1.6.3 抑菌试验 取无菌96孔板,按照由低浓度到高浓度的顺序,将配制好的药物稀释液50 μL,相应加入到9号孔到1号孔。将标准菌株及3株耐药菌株的菌液按每孔50 μL分别接种到9号孔至1号孔。空白对照加100 μL培养基,阴性对照加菌悬液和培养基的混合物100 μL。每种菌种及其对照均设 3 次重复。完成后加盖置湿盒内,置37 ℃恒温培养箱中孵育16~18 h后观察结果。参照对照孔观察,孔内澄清无细菌生长的药物最低浓度,即为药物对待测菌的MIC。
1.7 黄藤素与抗生素的联合抑菌试验 采用改良的纸片扩散法,测定耐药菌株对黄藤素与6种抗菌药物联合抑菌后的敏感程度,标准菌株ATCC25923进行质控。
1.7.1 黄藤素平板的制备 按配方制备MH培养基,高压灭菌后冷却至65 ℃左右,以黄藤素对待检菌1/2MIC为浓度比例,针对4种菌株分别加入相应含量的黄藤素,MH培养基与黄藤素药液搅拌均匀后倾注12 mL于60 mm的培养皿中,静置凝固后备用。
1.7.2 K-B法检测菌株对联合药物的敏感性 标准菌株及耐药菌株校正浓度至0.5麦氏单位,无菌操作接种于相应黄藤素平板上,静置后贴抗生素纸片,37 ℃培养18 h,游标卡尺测量并记录结果,重复3次取平均值,结果参照CLSI标准判读。
1.8 数据处理 采用SPSS 21.0对试验数据进行统计处理。
2 结果
2.1 抗生素对临床分离菌株的药敏试验 结果见表1,标准菌株的抑菌圈直径均在质控范围内,临床分离株RS1对6种抗生素中的3种耐药,RS2、RS3对其中的4种抗生素耐药,均为多重耐药。3株菌株对万古霉素敏感,对青霉素、红霉素、克林霉素耐药,其中对克林霉素耐药严重,没有出现抑菌圈。此外,RS2对四环素耐药,RS3对庆大霉素耐药。
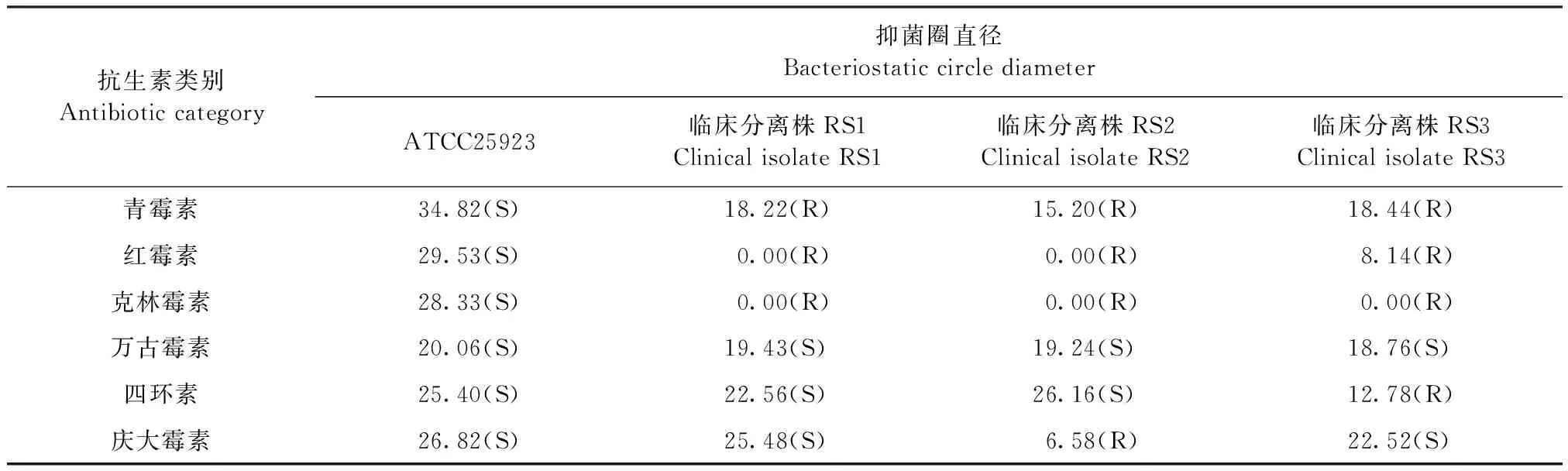
表1 6种抗生素对金黄色葡萄球菌的药敏试验结果Table 1 The susceptibility test results of 6 antibiotics against SA (mm)
2.2 黄藤素对金黄色葡萄球菌的MIC测定 黄藤素对金黄色葡萄球菌标准菌株的MIC为0.156 mg/mL,对临床分离株RS1、RS2、RS3的MIC测定结果分别是0.078 mg/mL、0.625 mg/mL和0.078 mg/mL。
2.3 黄藤素与抗生素联合对金黄色葡萄球菌的药敏试验 将金黄色葡萄球菌标准菌株及3株临床分离株分别接种在含有1/2MIC浓度的黄藤素平板上,抑菌圈平均值较普通MH平板均有不同程度的增大,具体结果见表2、表3。其中标准菌株抑菌圈相较于处理前增幅2~10 mm不等;临床分离株RS1对红霉素、克林霉素的抑菌圈无变化,对青霉素、万古霉素、庆大霉素的抑菌圈有小量增幅,对四环素的抑菌圈增幅达到9.54 mm;临床分离株RS2除克林霉素外均出现抑菌圈直径的增幅,其中对青霉素的增幅达到27.13 mm,该菌株对青霉素恢复了药物敏感性;临床分离株RS3也是除克林霉素外,对另5种抗生素的抑菌圈直径均有增幅,其中对四环素的药敏程度由耐药恢复到了中介。

表2 黄藤素与6种抗生素联合对金黄色葡萄球菌的药敏试验结果Table 2 The susceptibility test results of fibriuretinin combined with 6 antibiotics against SA (mm)
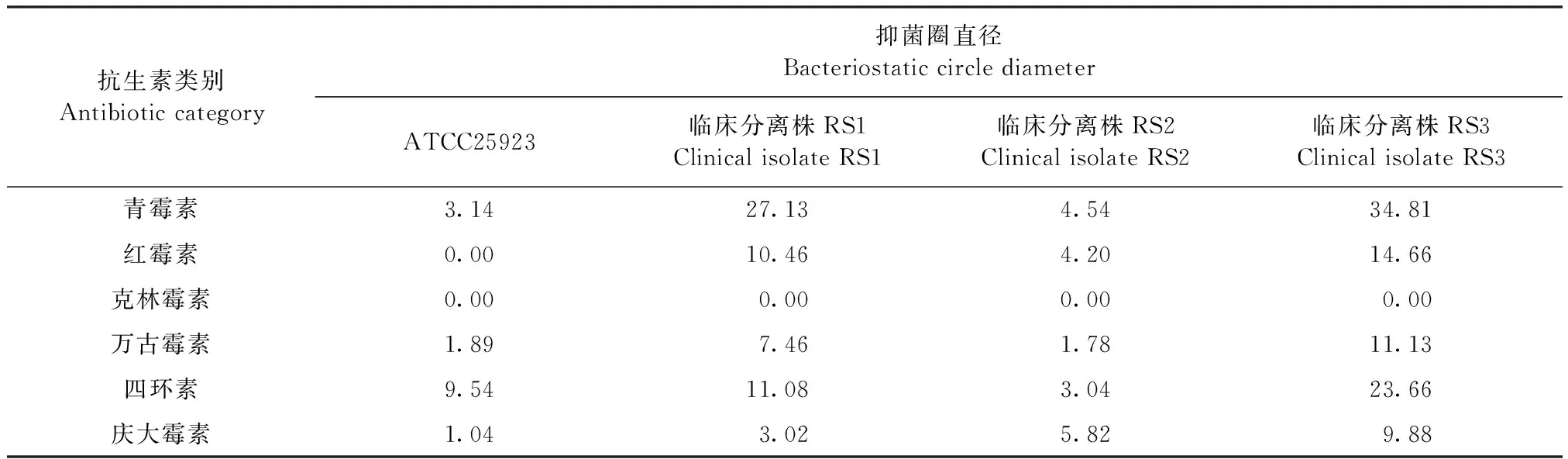
表3 黄藤素与6种抗生素联合用药后抑菌圈直径增幅Table 3 The diameter increase in bacteriostatic circle after the combined treatment (mm)
3 讨论
金黄色葡萄球菌是畜牧临床常见的致病菌,分离率较高,可引起多种疾病。本试验选择6种抗生素对3株禽源金黄色葡萄球菌分离株进行检测,药敏试验结果显示3株临床分离株均具有较高的耐药性。禽源多重耐药菌产生的原因可能是畜牧业在养殖管理或感染治疗过程中非标准的使用了抗生素,凭借经验用药,使用种类、剂量不合理,使其选择压力较大,从而产生广泛耐药性。此外耐药还可以通过遗传因子的转移和传播获得,遗传因子主要包括耐药质粒、转座子、整合子和噬菌体,它们可以通过融合、转导和转化等方式在不同致病菌的遗传物质之间转移或集聚重排,引起多重耐药菌发生率大幅上升[8]。
中药毒副成份少,具有清热解毒、清热燥湿、利湿通淋的功效,研究表明黄藤素对多种革兰阳性和阴性菌有不同程度的抑制作用,尤其具有抗真菌作用[9]。王建涛等用微量量热法研究发现,黄藤素对金黄色葡萄球菌的抑菌效果优于黄连素、荷叶碱和异汉防己碱[10]。陈熙等试验结果表明,黄藤素体外抗阴道毛滴虫的作用与甲硝唑相当,可作为抗阴道毛滴虫的候选药物[11]。但是黄藤素对多重耐药菌的抑菌作用未见报道。
本试验选用黄藤素在相应菌株的1/2MIC浓度下,分别与6种抗生素联用,在体外检测其对多重耐药禽源金黄色葡萄球菌的抑菌作用。青霉素是β-内酰胺类抗生素,3株临床分离株菌均对青霉素耐药,与黄藤素联用后抑菌圈直径均增大,其中临床分离株RS2抑菌圈增加27.13 mm,药物敏感程度由耐药恢复到了敏感;红霉素、克林霉素是大环内酯类抗生素,3株临床分离株菌对其耐药现象严重到不出现抑菌圈的程度,黄藤素与红霉素联用后,RS2、RS3抑菌圈分别增加到10.46 mm、12.34 mm,但是药物敏感程度依旧在耐药的范围内;黄藤素与克林霉素霉素联用后,抑菌圈没有任何变化。
万古霉素是糖肽类抗生素,3株临床分离株菌均对万古霉素敏感,在与黄藤素联用后,抑菌圈均增加;临床分离株RS1、RS2对四环素类抗生素敏感,RS3对四环素类抗生素耐药,在与黄藤素联用后抑菌圈增幅从3 mm到11.08 mm不等,RS3对四环素的药物敏感程度恢复到了中介;庆大霉素是氨基糖苷类抗生素的典型代表,在与黄藤素联用后,抑菌圈增幅从1.04 mm到5.82 mm不等,药物敏感程度没有变化。
从以上结果可知,黄藤素与抗菌药物联合后,临床分离菌对抗生素的药物敏感程度有不同的增高,其中与青霉素联用的效果最好,与四环素次之,但是与克林霉素联用对药物敏感程度没有任何变化。这可能与细菌本身的耐药机制相关,动物源性金黄色葡萄球菌已经被检测出50多种耐药基因,主要有细胞壁增厚、抗生素受体失活、主动外排作用、更换靶点等耐药机制[12],不同菌株的耐药基因、耐药机制各不相同,与黄藤素联用的抑菌结果各有差异,联合用药的具体抑菌机制还有待进一步研究。
黄藤素有良好的抗菌作用,与抗生素联用可减少临床兽药的使用剂量,对防控阻断耐药菌的传播具有一定意义。但是菌体耐药机制复杂,药物作用后耐药基因发生哪些变化有待进一步研究,如何提高联合用药的抑菌效果有待进一步探索,以此提高抗生素的治疗效果,为防控感染性疾病提供科学依据。
