姜味草中齐敦果酸和熊果酸的含量测定
2022-01-17田树兴丁艳谱周崇富刘红光李军山2
田树兴 丁艳谱 周崇富 刘红光 李军山2,
1.云南神威施普瑞药业有限公司,云南 楚雄 675000;2.楚雄神威施普瑞药物研究有限公司,云南 楚雄 675000;3.神威药业集团有限公司,河北 石家庄 051430
姜味草为唇形科植物姜味草MicromeriabifloraBenth.的干燥全草,别名地生姜、小姜草、小香草,味苦,辛,性温,具有温中散寒、理气止痛的功效[1-3],分布于贵州、云南、西藏等地[4],是云南常用草药。已有报道通过水蒸气蒸馏法和超临界CO2提取姜味草中的挥发油,并采用CG-MS联用法对其化学成分进行分析[5];采用气相色谱法对姜味草挥发油中橙花醛与香叶醛的含量进行测定[6];采用薄层色谱扫描法对云南不同产地姜味草中齐敦果酸的含量进行测定[7];采用高效液相色谱法对姜味草中非挥发性成分齐敦果酸和熊果酸的含量进行测定[8]。齐墩果酸和熊果酸具有抗氧化、抗癌、降血脂、降血糖和保肝等功效[9-12]。通过实验建立高效液相色谱法测定姜味草中齐墩果酸和熊果酸含量的方法,为姜味草的质量控制提供依据。
1 仪器与材料
1.1 仪器 LC-2030 Plus高效液相色谱仪(日本Shimadzu公司);SK250LH超声波清洗器(上海科导超声仪器有限公司);MS105DU 电子天平(d=0.00001 g)(瑞士梅特勒公司)。
1.2 药品与试剂 姜味草购自云南禄丰县勤丰镇恒康中药经营部(产地为云南禄丰及云南华宁)、四川南部县旭丰中药材农民专业合作社(产地为四川都江堰),经河北省药品检验研究院孙宝惠主任中药师鉴定为唇形科姜味草属植物姜味草MicromeriabifloraBenth.的干燥全草。齐敦果酸对照品(中国食品药品检定研究院,批号:110709-20188,纯度91.1 %);熊果酸对照品(中国食品药品检定研究院,批号:110742-201823,纯度99.9 %);甲醇(色谱纯,德国 Merck 公司);乙醇(分析纯);冰醋酸(分析纯);三乙胺(分析纯);实验室用水为纯化水。
2 方法与结果
2.1 对照品溶液的制备 分别精密称取齐敦果酸对照品10.80 mg和熊果酸对照品24.64 mg,置100 mL的量瓶中,加甲醇溶解并稀释至刻度,作为混合对照品溶液(其浓度分别为 98.39 μg·mL-1和246.15 μg·mL-1)。
2.2 供试品溶液的制备 精密称取姜味草粉末(过三号筛)约1.0 g,置150 mL的量瓶中,加入90 %乙醇25 mL超声(功率250 W,频率40 kHz)处理30 min,取出放至室温,用90 %乙醇补足减失的重量,摇匀,用0.45 μm的微孔滤膜过滤,取续滤液作为供试品溶液。
2.3 色谱条件与系统适应性试验 色谱柱为Thermo C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水-冰醋酸-三乙胺(85∶15∶0.3∶0.5);柱温为 15 ℃;检测波长为210 nm;流速为 0.8 mL·min-1;进样量为10 μL。在色谱条件下齐敦果酸和熊果酸可达到基线分离,齐敦果酸和熊果酸的分离度大于1.5。如图1所示。
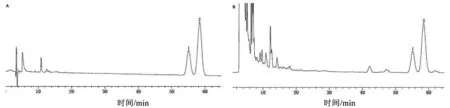
1.齐敦果酸;2.熊果酸图1 齐敦果酸和熊果酸对照品(A)和样品(B)的HPLC色谱图
2.4 线性关系考察 精密吸取混合对照品溶液2、5、10、15、20、25 μL,分别注入液相色谱仪中,按上述“2.3”项下的色谱条件测定峰面积,以测定峰面积为为纵坐标(Y),对照品进样量为横坐标(X)绘制标准曲线,得齐敦果酸回归方程Y=62036.97X+2180.27,R=0.9997表明齐敦果酸进样量在0.20~2.46 μg范围内与峰面积呈良好的线性关系。得熊果酸回归方程Y=146338.20X-1848.62,R=0.9999表明熊果酸进样量在0.49~6.15 μg范围内与峰面积呈良好的线性关系。
2.5 精密度实验 精密吸取混合对照品溶液 10 μL,分别注入液相色谱仪中,按上述“2.3”项下的色谱条件连续测定6次,结果,齐敦果酸和熊果酸峰面积的RSD分别为0.17 %和0.09 %。表明本方法精密度良好。
2.6 重复性实验 取同一批样品(云南-禄丰)6份,按“2.2”项下的方法制备并进行测定。结果表明齐敦果酸和熊果酸含量的RSD分别为1.57 %和1.63 %。表明本方法重复性好。
2.7 稳定性实验 取“2.6”项下同批的样品在0、4、8、12、16、20 h分别进行测定,结果20 h内齐敦果酸和熊果酸峰面积无明显变化,RSD分别为1.33 %和1.31 %,表明被测样品在20 h内稳定性良好。
2.8 加样回收率实验 取已知含量的样品(云南-禄丰),齐敦果酸和熊果酸的含量分别为:2.08 mg·g-1和5.58 mg·g-1适量,约1 g,共6分,精密称定,分别加入0.488 mg/mL齐敦果酸和0.912 mg/mL熊果酸的混合对照品溶液1.5、2.5和5.0 mL,挥干溶剂,按“2.2”项下方法制备供试品溶液。按上述色谱条件进样测定,计算回收率,结果见表1。
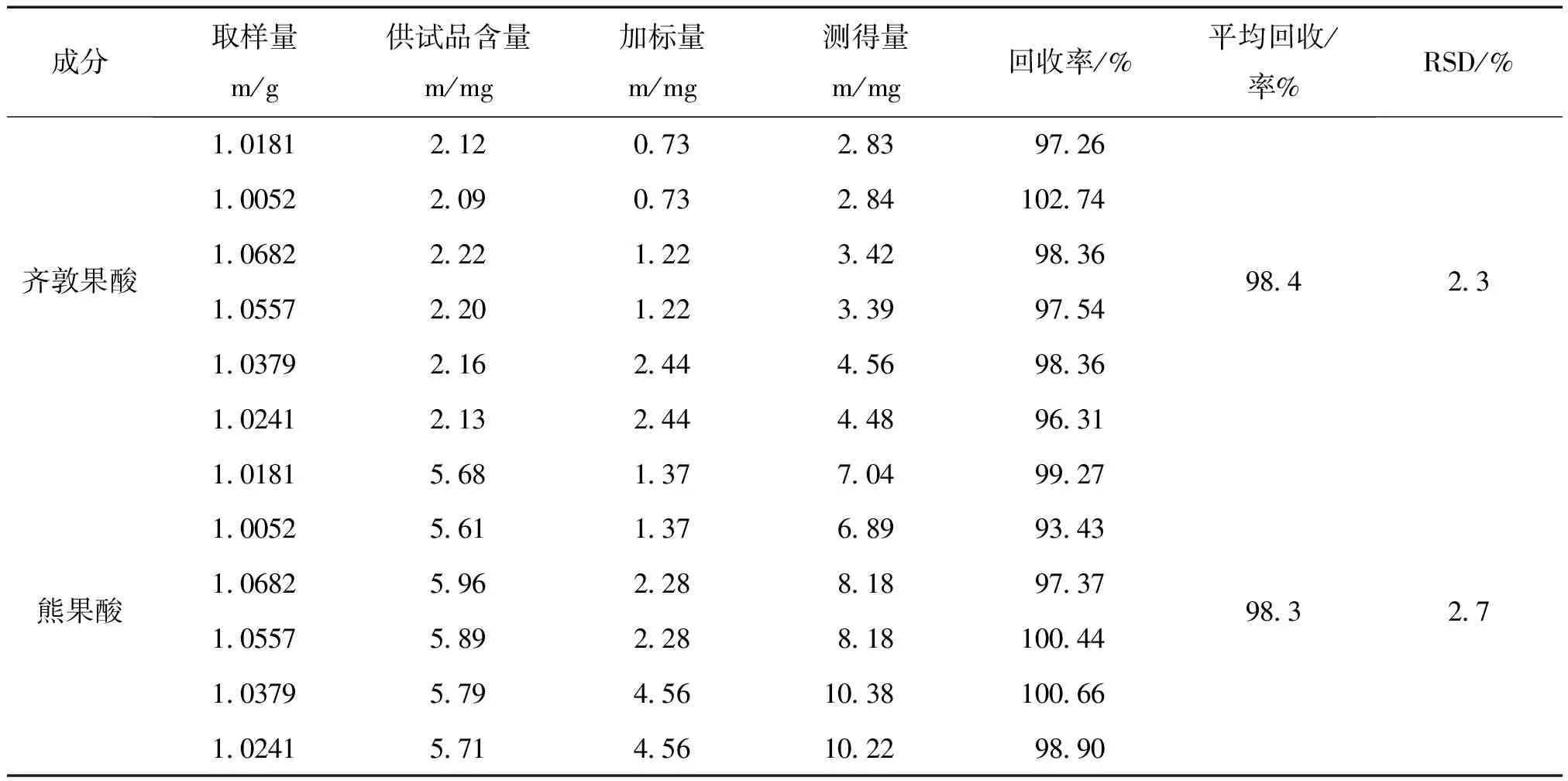
表1 加样回收率实验结果
2.8 样品含量测定 分别取不同产地的姜味草,按供试品溶液制备方法制备,并进行进样测定,结果见表2。
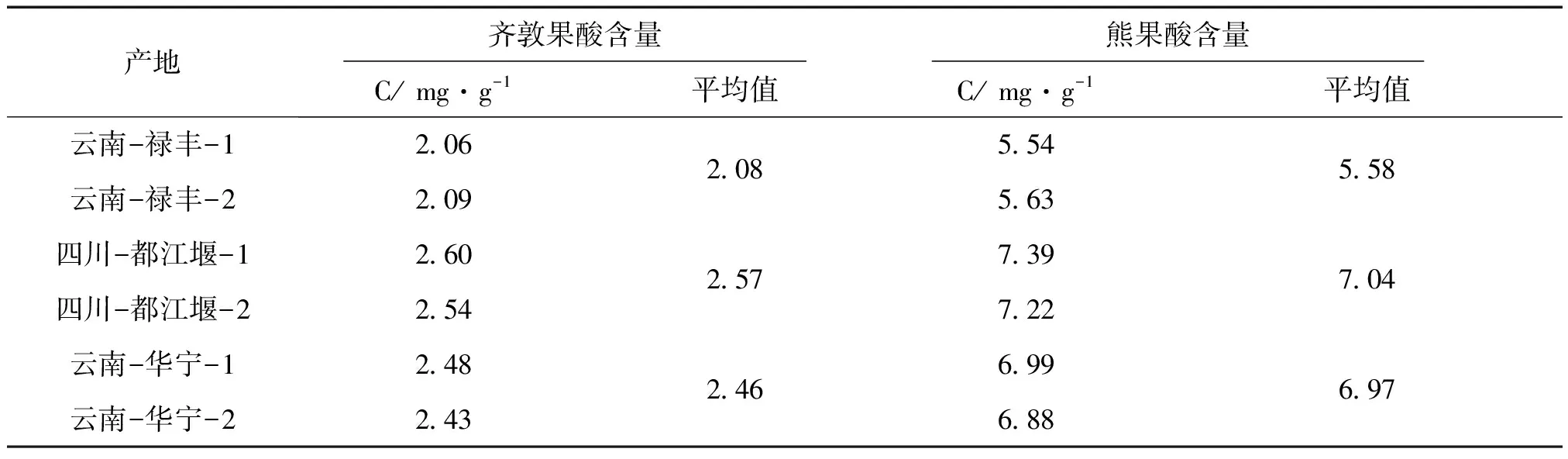
表2 样品含量测定结果
3 讨论
3.1 提取方式的选择 本实验结合李坤平等[13]用体积分数90%乙醇作为溶剂超声提取,对提取溶剂、提取方法、提取时间三方面进行优化。①提取溶剂:对50%乙醇、70%乙醇、95%乙醇、无水乙醇和甲醇5种溶剂的提取效进行比较,结果95%乙醇、无水乙醇和甲醇3种溶剂的提取率相近,50%乙醇和70%乙醇提取率较低;由于95%乙醇的毒性低且实验室较为常用,且无需提前对提取溶剂进行配置。同时对齐敦果酸和熊果酸的测定无干扰,基线平稳,故选用95%乙醇作提取溶剂;②提取方法:对加热回流和超声2种方法提取,提取率相近,考虑实验提取的快捷方便,故采用超声提取作为提取方法;③提取时间:对供试品超声时间20、30、45和60 min进行考察,结果超声20 min的提取率较低,30、45和60 min的提取率相近,故选择30 min为提取时间。
3.2 检测条件的选择 齐敦果酸和熊果酸属于五环三萜类化合物,极性相似,较难分离。选用甲醇-水-冰醋酸-三乙胺(85∶15∶0.03∶0.06),柱温箱温度25 ℃,流速1 mL·min-1时,齐敦果酸和熊果酸的保留时间较为接近,无法有效分离。继而考察柱温箱温度15 ℃,流速0.8 mL·min-1;柱温箱温度15 ℃,流速0.5 mL·min-1时。结果两种方法均能使齐敦果酸和熊果酸达到良好分离,分离度大于1.5。由于柱温箱温度15 ℃,流速 0.8 mL·min-1保留时间远远早于柱温箱温度 15 ℃,流速0.5 mL·min-1。故选择甲醇-水-冰醋酸-三乙胺(85∶15∶0.03∶0.06),柱温箱温度 15 ℃,流速0.8 mL·min-1为检测条件。
由表2可知3个不同产地的姜味草中均含有齐敦果酸和熊果酸,但不同产地的姜味草中齐敦果酸和熊果酸含量的差别较大,其原因有待进一步探讨。
本研究建立了同时测定姜味草中齐敦果酸和熊果酸含量的方法,其结果准确可靠,且具有分离度好、灵敏度高、准确性高、供试品制备简单等优点,为姜味草质量评价及标准提升提供了良好的方法和依据。
