肝癌条件培养基对血管内皮细胞形貌和超微结构的影响
2022-01-15杨尚霖陈俊鹏谢学羿温顺前
巫 青,杨尚霖,陈俊鹏,谢学羿,温顺前
(佛山市第二人民医院肝胆外科,佛山 528000)
恶性肿瘤通过血管吸收营养和氧气以支持肿瘤快速生长,同时也利用血管进行扩散转移,其转移关键取决于肿瘤细胞穿透内皮层进入和移出脉管系统的速度,即内渗和外渗[1]。肿瘤细胞与内皮细胞是肿瘤微环境的主要细胞,其相互作用贯穿于肿瘤发生发展的整个过程[2]。尽管有证据表明肿瘤细胞可以通过细胞间的相互作用和旁分泌效应,以及释放多种可以增强肿瘤侵袭性的生长因子、趋化因子和基质降解酶,来与局部微环境相互作用[3],但是在这个过程中肿瘤细胞将诱导内皮细胞出现什么样的变化并不清楚。因此,研究这个过程中内皮细胞的形态和功能是非常重要的。本试验将人肝癌细胞条件培养基(HepG2 conditioned medium,HepG2-CM)与人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)共培养,模拟肿瘤微环境,观察HepG2-CM对HUVEC细胞形貌和超微结构的变化。
1 材料与方法
1.1 试剂与材料
人肝癌细胞株HepG2和HUVEC细胞为本实验室冻存,胎牛血清、胰蛋白酶购自Gibco公司,M199培养液、L-谷氨酰胺、青链霉素购自美国Hyclone公司,培养板、培养瓶购自美国Corning公司。倒置显微镜购自日本Olympus公司,原子力显微镜(atomic force microscopy,AFM)购自美国Thermo microscope公司,扫描电镜(scanning electron microscopy,SEM)购自日本日立高新技术有限公司。
1.2 方法
1.2.1 HUVEC细胞培养
用含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的M199培养液,在含5% CO2、37℃的培养箱中对HUVEC细胞进行培养。
1.2.2 HepG2-CM的制备
参考Pan等[4]的方法,收集处于对数生长期的HepG2细胞,调节细胞浓度至2×106个/mL,用含10%胎牛血清、青霉素100 U/mL、链霉素100 mg/mL的M199培养液于37℃、5% CO2培养箱中培养48 h后,弃去原培养基,用PBS缓冲液清洗3遍后加入无血清培养基过夜饥饿处理,次日收集HepG2细胞培养上清液,2 000 r/min离心5 min,经直径为0.22 μm的微孔滤膜过滤,以除去漂浮的肿瘤细胞,配成50%的体积比备用。
1.2.3 HepG2-CM诱导HUVEC细胞的形态学观察
取对数生长期的HUVEC细胞,调整细胞浓度至2×105个/mL接种于6孔培养板,每孔2 mL,贴壁生长12 h后加入2 mL HepG2-CM,对照组只加无血清培养液。将其分别作用HUVEC细胞24 h,用倒置显微镜观察各组细胞的生长状况和形态变化,并拍照记录。
1.2.4 SEM观察HUVEC细胞的形貌
在6孔板内放入22 mm×22 mm的无菌云母玻片,每孔加入1×104个/mL的HUVEC细胞悬液2 mL,使细胞均匀爬片。贴壁生长12 h后,试验组加入2 mL HepG2-CM,对照组只加无血清培养液,继续培养24 h。将玻片从培养孔取出,用PBS缓冲液于摇床上轻轻洗3遍,每遍5 min,然后用2.5%的戊二醛浸没玻片,置于4℃冰箱固定过夜,超纯水清洗细胞3次,每次5 min,以除去固定液;使用30%、50%、70%、90%、100%的梯度乙醇脱水,每级梯度处理10 min;样品经由无水乙醇与醋酸异戊酯(体积比为1∶1)的混合液过渡,并转入纯醋酸异戊酯以置换酒精,每次约10 min;按“进气-浸泡-置换(3次)-升温-放气”等步骤进行CO2临界点干燥;将干燥后的样品转移到铜台上,置于离子溅射仪中,抽真空20 min,喷金10 min。
1.2.5 AFM观察HUVEC细胞的超微结构
在6孔板内放入22 mm×22 mm的无菌云母玻片,每孔加入1×104个/mL的HUVEC细胞悬液2 mL。细胞均匀爬片后,试验组加入2 mL HepG2-CM,对照组只加无血清培养液,继续培养24 h后将玻片取出,用PBS于摇床上轻轻洗3遍,然后用4%的多聚甲醛固定15 min,蒸馏水轻轻冲洗3次,室温自然干燥后立即进行AFM扫描。将载有细胞样品的玻片固定在AFM的扫描台上,用监视器定位待扫描的样品区域,对样品进行扫描成像。采用100 μm扫描器和UL2.0B硅探针,力常数为2.8 N/m,在空气中室温下进行扫描,以接触模式成像。所有图像仅经仪器配置软件(IP 2.1)平滑处理,以消除扫描方向上的低频背景噪音。
1.3 统计学分析
2 结果与分析
2.1 倒置显微镜观察HUVEC细胞形态
在倒置显微镜下观察各组HUVEC细胞形态的变化(图1)。正常情况下,HUVEC细胞呈梭形致密排列,细胞间紧密连接,镶嵌形成“铺路石”样结构;HepG2-CM诱导的HUVEC细胞伸长,呈长梭形,黏附减弱,细胞间隙更疏松。
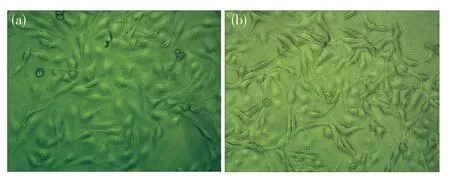
图1 倒置显微镜观察HUVEC细胞形态(200×)Fig.1 The morphology of HUVEC cells was observed by inverted microscope (200×)
2.2 SEM观察各组HUVEC细胞形貌
利用高分辨率SEM对HUVEC细胞成像,观察细胞形貌的变化,结果如图2所示:对照组HUVEC细胞呈梭形,细胞膜表面有颗粒样物质;HepG2-CM刺激后HUVEC细胞伸长,细胞膜向四方伸展,细胞表面有很多颗粒样物质突起,“伪足”样突起明显增多。
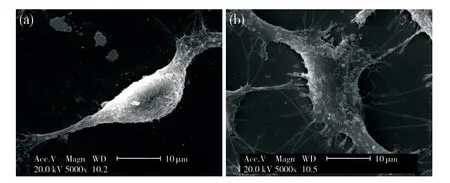
图2 SEM观察HUVEC细胞形貌(5 000×)Fig.2 The morphology of HUVEC cells was observed by SEM (5 000×)
2.3 AFM观察HUVEC细胞形貌
通过AFM观察各组HUVEC细胞形貌图和对应的拓补图可发现(图3),对照组HUVEC细胞呈梭形,细胞核突出,细胞饱满,边缘相对平整,无明显细胞膜延伸,相邻细胞之间紧密依靠,细胞黏附排列致密,这是无HepG2-CM刺激状态下HUVEC细胞的形貌特征。由于HepG2-CM的刺激,细胞运动活跃,HUVEC细胞伸长,呈长梭形,细胞核塌陷,黏附减弱,细胞膜向四方伸展,边缘模糊,与相邻细胞之间连接疏散,边缘可见明显“伪足”样突起(图3b黑色箭头)。

图3 AFM观察HUVEC细胞形貌Fig.3 The morphology of HUVEC cells was observed by AFM
2.4 细胞超微结构分析
图4为各组细胞的超微结构图和细胞膜表面粒径分布图。结果显示,对照组细胞边缘相对平整,表面颗粒较小(图4a),HepG2-CM作用后细胞边缘不平整,出现“伪足”样突起(图4b箭头所示),表面颗粒变大,粒径分布明显右移(图4c、4d)。

图4 各组HUVEC细胞的超微结构图和细胞膜表面粒径分布图Fig.4 Ultrastructural and particle size distribution of cell membrane surface of HUVEC in each group
2.5 细胞膜表面粗糙度分析
用AFM自带软件对上述细胞膜表面超微结构进行测量,得到超微结构几何参数值的不同数值:高低差(peak to valley roughness,Rp-v)、均方根粗糙度(root-mean-square roughness,Rq)、平均粗糙度(Average roughness,Ra)、平均高度(Meant Ht)、中位数高度(Median Ht)均反应细胞膜表面粗糙度的变化。分别测量每组4个细胞的不同区域,对这些数值进行统计分析,结果显示(图5),HepG2-CM处理前后几何参数均发生明显变化,Rp-v分别为(454.83±29.99)nm和(501.28±11.78)nm,P=0.028;Rq分别为(32.84±4.70)nm和(45.03±3.84)nm,P=0.007;Ra分别为(25.06±4.09)nm和(34.39±3.58)nm,P=0.014;Meant Ht分别为(204.03±11.65)nm和(301.48±12.80)nm,P=0;Median Ht分别为(206.55±7.46)nm和(313.25±5.89)nm,P=0。结果表明,HepG2-CM处理后细胞表面粗糙度明显增加。
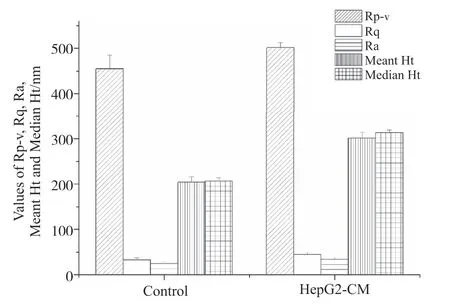
图5 各组HUVEC细胞膜表面粗糙度的分析Fig.5 Analysis of surface roughness of HUVEC cell membrane in each group
3 讨论
转移是癌症患者死亡的首要原因,其过程包括原位浸润、肿瘤细胞内渗、循环系统存活、肿瘤细胞外渗、转移灶形成等[5]。移行的肿瘤细胞通过内渗进入血管内离开原发肿瘤,通过循环扩散到全身,最后定植到提供适当微环境的远处器官中[6]。其中,肿瘤细胞穿透内皮层进入和移出脉管系统,即内渗和外渗是重要步骤[1]。在这个过程中必然引起内皮细胞形态和超微结构的变化,许多研究焦点都集中于肿瘤细胞如何穿透内皮层,而未观察内皮细胞形态的变化。因此,研究肿瘤细胞诱导下血管内皮细胞形貌和超微结构的变化具有很重要的意义。
肿瘤细胞与内皮细胞在肿瘤微环境中的相互作用始终贯穿于肿瘤发生发展的全过程,内皮细胞可以向肿瘤细胞提供一些信号来促进肿瘤细胞的转移[7],肿瘤细胞也可以通过多种方式诱导内皮细胞通透性增加。一方面,来自肿瘤细胞的外泌体通过触发内皮细胞中的内质网应激和减少紧密连接相关蛋白破坏血管完整性,从而促进肿瘤转移的发生[6]。Lin等[6]不仅在体外试验中用外泌体处理单层内皮细胞,使其通透性增加,而且在体内试验中将其注射到小鼠体内,也增加了血管通透性和肿瘤转移。另一方面,肿瘤细胞条件培养基中富含促血管内皮生长因子,能诱导内皮细胞的迁移[8-10]。Jean等[11]将释放血管内皮生长因子(vascular endothelial growth factor,VEGF)的肿瘤细胞与体外培养的内皮细胞一起培养,发现这些肿瘤细胞先黏附到内皮细胞层,然后再从中穿过。我们之前的研究也显示,HepG2-CM内丰富的VEGF能诱导HUVEC细胞迁移,且引起细胞骨架重排[4]。VEGF又称血管通透因子(vascular permeability factor,VPF),是目前发现特异性最高、促血管作用最强的促血管生成可溶性因子。它通过直接与内皮细胞上相应受体(如Flt-1和VEGFR-2)高亲和力结合,启动其下游的信号转导,进而激活内皮细胞,不仅可以诱导内皮细胞增殖、迁移和管腔形成,还可以增加血管通透性[12]。
为了更好地模拟体内肿瘤组织复杂的微环境,试验采用间接共培养的方法构建了HepG2-CM和HUVEC细胞的体外共培养模型,通过高分辨率的SEM及AFM初步观察了HepG2-CM诱导HUVEC细胞形貌及超微结构的变化,并对其细胞膜表面粗糙度进行分析。结果表明,HepG2-CM诱导HUVEC细胞膜向四方伸展,出现明显“伪足”样突起,细胞膜表面粗糙度增加,减弱了细胞的黏附及细胞之间的紧密连接效果。这些是内皮细胞运动活跃的表现,表明HepG2-CM刺激了HUVEC细胞的活性[13]。研究表明,细胞间紧密连接蛋白与胃肠道肿瘤和肝脏疾病密切相关[14],尤其是肿瘤细胞的侵袭和转移,紧密连接蛋白的下调或丢失会改变细胞迁移、增殖、极性和分化,从而促进癌症的进展[15]。血管内皮细胞间的连接结构有紧密连接、黏附连接、缝隙连接等,其中紧密连接在血管完整性中起重要作用,并控制单层内皮的通透性[6]。高剂量贝伐单抗通过TGF-β1信号通路降低紧密连接蛋白CLDN5的表达,从而增强内皮细胞的迁移、侵袭和渗漏能力[16],而纳米金通过上调内皮细胞上的VE-钙黏蛋白水平来加强紧密连接,降低血管通透性[17]。Escribano等[1]通过建立内皮细胞单层计算模型来研究内皮细胞间隙形成的机制,结果显示,机械力的平衡驱动内皮间隙的形成,从而导致癌细胞的外渗。他认为,力学作用让细胞结构发生变化,细胞会被这样的力量沿着不同的方向拉扯推动,最终导致细胞之间发生裂痕,出现了暂时的空隙,且随着内皮细胞连接变得稳定,缝隙打开的频率会降低。
综上所述,HUVEC出现上述形貌和超微结构的变化可能是这个过程中HepG2-CM诱导细胞迁移引起力学的变化导致细胞之间出现了暂时的空隙,破坏了内皮细胞的紧密连接,增加了血管通透性。肿瘤转移时肿瘤细胞如何穿越内皮细胞屏障是关键,也是防治肿瘤转移的靶点[18]。因此,对内皮细胞形貌和超微结构的研究将有助于我们进一步理解肿瘤微环境中血管内皮细胞的生物学行为,为抗肿瘤血管生成的研究提供思路。
