基于FRET原理构建AtLHT1转运底物筛选探针
2022-01-14李志伟李本杰刘志兵徐汉虹
李志伟,李本杰,刘志兵,林 菲,徐汉虹,舒 薇
(1 华南农业大学 天然农药与化学生物学教育部重点实验室,广东 广州510642;2 华南农业大学 测试中心,广东 广州510642)
导向农药是将农药有效成分与导向载体偶联后使其能在植物体内特定部位(果实、叶、芽或病虫害造成的伤口)定向累积的新型农药[1]。在大多数情况下,农药是通过被动扩散或离子捕获机制跨生物膜运输。此外,一些小的农用化学分子可以通过植物质膜转运系统转运[2],这表明这些转运蛋白的特异性并不严格受限于它们的天然生理底物[3]。在制药领域,一些转运蛋白被广泛认为是药物动力学的重要决定因素,在某些药物进入靶器官的过程中起着至关重要的作用[4]。因此,农药分子定向修饰后,可以被植物体内的转运蛋白识别并转运,从而提高农药分子在植物体内的靶向输导能力。选择合适的植物转运蛋白并分析其结构与底物之间的构效关系,是导向农药化学结构设计和优化的关键。潜在的农药转运蛋白应具有相对较高的通量和较宽的底物特异性,并且不影响韧皮部组织液的循环[5]。由于糖、氨基酸和寡肽的植物转运系统在植物组织中的表达和功能,它们被认为是新农药创制的可能靶标。其中一些转运蛋白已经被证明具有广泛的底物特异性,例如拟南芥蔗糖转运蛋白AtSUT2,除转运蔗糖外,还能够转运一系列糖苷,包括天然存在的香豆素糖苷[6];拟南芥组氨酸/赖氨酸转运蛋白AtLHT1可以转运L-谷氨酰胺-氟虫腈等一系列保留α氨基的电中性共轭物[7];蓖麻单糖转运蛋白RcSTP1可以转运葡萄糖基一氟虫腈(GTF)等一系列糖基偶合物[8]。
LHT1属于拟南芥氨基酸转运蛋白家族(Amino acid transporter family,ATF),ATF 是植物中最先报道的氨基酸转运蛋白家族。ATF在植物对氨基酸的吸收、转运、长距离运输及“源”和“库”再分配过程中扮演着重要角色。在植物根部吸收氨基酸的转运蛋白研究中,Chen等[9]报道了拟南芥第1个参与植物根部吸收氨基酸的转运蛋白-AtLHT1,后续研究表明其对中性氨基酸和酸性氨基酸有很高的亲和力,是植株在自然浓度下从土壤中吸收氨基酸的关键性转运蛋白[10]。在以氨基酸或氨基酸衍生为导向农药的研究中,Chen 等[11]利用电生理技术证明了甘氨酸甲酯-氯虫苯甲酰胺(CAP-Gly-2)会引起表达有AtLHT1的爪蟾卵母细胞的膜电位变化,并且在植株水平上,AtLHT1转录水平的变化会影响拟南芥对甘氨酸甲酯-氯虫苯甲酰胺的吸收,从而证明了该药物可能被AtLHT1转运。Xie 等[12]在植株水平和爪蟾卵母细胞异源水平均证明了AtLHT1可以影响甘氨酸甲酯-氯虫苯甲酰胺的吸收。由于AtLHT1转运底物的广谱性,以其为基础设计开发一种简单快速的导向农药输导性的检测方法,有可能得到在植株中具有良好输导性的化合物,从而加快导向农药的研发进程。
如果2个荧光团相距为1~10 nm,且1个荧光团(供体)的发射光谱与另1个荧光团(受体)的吸收光谱有重叠,当供体被入射光激发时,可通过偶极-偶极耦合作用将其能量以非辐射方式传递给受体分子,供体分子衰变到基态而不发射荧光,受体分子由基态跃迁到激发态,再衰变到基态同时发射荧光,这一过程称为荧光共振能量转移(Fluorescence resonance energy transfer, FRET)[13]。FRET 现象最早由Förster[14]阐明,在绿色荧光蛋白发现后基于荧光蛋白的FRET探针在生命科学领域已广泛应用,如蛋白质与蛋白质相互作用、蛋白质构象的变化、酶类活性研究、细胞信号通路的研究等[15],常用的FRET荧光基团有CFP-YFP、CFP-dsRED、BFPGFP、Cy3-Cy5、YFP-TRITC、YFP-Cy3 等[16]。FRET探针被用于蛋白与底物的检测,如基于麦芽糖结合蛋白与底物结合后的构象变化构建出麦芽糖检测的FRET探针,其探针构建是在麦芽糖结合蛋白的两端分别添加YFP和CFP形成“三明治”融合蛋白。当麦芽糖结合蛋白与底物结合后,使蛋白构象发生变化,FRET探针的荧光效率发生变化[17]。本研究基于FRET原理,将氨基酸转运蛋白AtLHT1两端添加青色荧光蛋白(Cyan fluorescence protein CFP)和黄色荧光蛋白 (Yellow fluorescence protein,YFP)基团构建FRET探针,拟通过酵母细胞或原核表达蛋白的荧光比率变化来验证AtLHT1参与多种氨基酸的转运功能,并运用于农药的筛选。
1 材料与方法
1.1 材料
1.1.1 供试药物 草甘膦 (Glyphosate)、谷氨酸(Glutamic acid)、精氨酸 (Arginine)、甘氨酸(Glycine)均购于Sigma-Aldrich公司。
1.1.2 质粒与菌株 含有CFP和YFP基因序列的Ubi-YFP-CFP-SV40-NOS载体由华南农业大学生命科学学院陈乐天教授课题组惠赠,大肠埃希菌DH5α、BL21(DE3)感受态细胞购自天根生物试剂公司,pREST系列载体购于Takara公司。BY4741酵母和pDR196载体由华南农业大学天然农药与化学生物学教育部重点实验室保存。
1.1.3 主要仪器 PCR Thermal Cycler Dice TP600(Takara),Power Pac Universal型恒压恒流电泳仪(Biorad),ND1000核算蛋白定量仪 (Eppendorf),Tanon 1600凝胶成像仪(广州誉维),荧光显微镜(日本 Olympus),Leica TCS SP8 STED 3X 激光共聚焦显微镜(德国Leica),FLx800荧光分析仪(美国BioTek)。
1.2 方法
1.2.1 表达载体构建 在CFP的C端和YFP的N端分别添加linker序列GGTACCGGAGGCGCC和GGCGCCGGTACCG[18],构建的 CFP-LHT1-YFP 三明治探针,分别连接到pRSET-A原核表达载体和pDR196酵母表达载体,构建方法如图1所示。

图1 CFP-LHT1-YFP三明治探针表达载体的构建Fig. 1 Construction of expression vector of CFP-LHT1-YFP sandwich probe
1.2.2 原核表达及酶标仪荧光检测 将测序结果正确的pDR196-CFP-linker-LHT1-YFP质粒转入BL21(DE3)感受态细胞中,挑取经氨苄青霉素抗性LB平板筛选的阳性克隆接种于5 mL SOB液体培养基,30 ℃ 摇床培养至D600nm= 0.4~0.6,取 1 mL菌液至100 mL新鲜SOB培养基,加入终浓度为0.05 mmol/L的IPTG诱导剂,30 ℃摇床继续培养。加入 IPTG 时的时间记为 0 h,间隔 1 h 取 1 mL菌液,试验进行 6 h,所取样品经 SDS-PAGE 电泳后用考马斯亮蓝染色确定表达时间,通过Western blot验证该条带是否为目的条带。采用全式金公司的ProteinIso Ni_NTA 填料柱对诱导表达后的蛋白进行纯化。
在96孔黑色底部不透光的酶标板内,加入经BL21表达后纯化的蛋白探针和待测底物,选择430 nm激发光激发,检测 480 ± 20 nm 和 535 ± 20 nm 2 个波段的光强变化及 FRET 比率(D535nm/D480nm)。如果有明显的FRET发生,CFP的能量会通过FRET传递给YFP,从而使YFP荧光强度增加,最终导致FRET比率升高。在不同底物浓度对LHT1-FRET探针光强变化影响试验中,作为阳性对照的甘氨酸加入浓度为 0.5、5 和 100 mmol/L,谷氨酸加入浓度为5和50 mol/L,草甘膦加入浓度为1、5和30 mmol/L,作为阴性对照的精氨酸、2,4-二氯苯氧乙酸、乙氧氟草醚,加入浓度均为10 mmol/L。
1.2.3 酵母真核表达及共聚焦检测 把保存的BY4741酵母在固体YPDA培养基上划线活化用于制备酵母感受态,利用酵母转化试剂盒(Takara)将pRSET-A-CFP-linker-LHT1-YFP质粒转入BY4741酵母感受态细胞后涂板。设置序列扫描,序列1的激发光波长为405 nm,发射光检测波长范围为450 ~490 nm,序列2的激发光波长为514 nm,发射光检测波长范围为525~570 nm。挑选阳性克隆至载玻片,分序列扫描确定YFP和CFP在酵母中的表达是否正确,筛选表达正确的克隆。将转入质粒的酵母单克隆转至YPD培养基中,30 ℃、250 r/min培养至D600nm= 1,取 1 mL 菌液离心后去上清液,沉淀用 20 mmol/L pH 7.0 的 PBS 缓冲液漂洗 3 次后,在PBS缓冲液中处理24 h后,加入浓度均为10 mmol/L的药物处理,取处理液10 μL至多聚赖氨酸处理后的共聚焦培养皿,设置供体激发光波长为405 nm,受体激发光波长为514 nm,选定发光区域后,用100%的514 nm激光漂白YFP,观察CFP的荧光强度是否增加,根据FRET效率公式计算:

1.2.4 统计分析 数据整理和分析采用 IBM SPSS Statistics 25 和 ExceL 2003 软件,结果用 3 次重复的平均值±标准误表示。用Duncan’s法比较分析各处理间的差异显著性。
2 结果与分析
2.1 目的基因片段的获取及表达载体的构建
在CFP的C端和YFP的N端分别添加linker序列,第1轮PCR扩增分别得到760 bp的CFP-linker和 linker-YFP片段(图2A)。经第2轮融合PCR扩增拼接获得1.5 kb的CFP-linker-YFP片段。再以第2轮产物为模板,进行第3轮融合PCR,大量扩增CFP-linker-YFP片段(图2B),胶回收后的CFP-linker-YFP片段与经双酶切、胶回收后的线性pDR196空载体经infusion酶连接后转化,挑选阳性克隆,经测序验证成功获得6.7 kb的载体pDR196-CFP-linker-YPF(图 2C)。

图2 目的基因片段的获取及表达载体的构建Fig. 2 Acquisition of target gene fragment and construction of expression vector
2.2 原核表达分析
CFP-LHT1-YFP融合蛋白理论相对分子质量为 125 000。BL21(DE3) 经诱导后,分别对诱导后不同时间点取样,SDS-PAGE分析结果表明,在加入IPTG后4 h内融合蛋白表达不明显,5 h后融合蛋白的表达明显(图3A),且6 h后表达量增加。为避免BL21过量表达融合蛋白后形成包涵体,时间没有继续延长。蛋白电泳检测融合蛋白的表观相对分子质量大小与理论接近。用抗GFP兔源抗体的Western blot验证,融合蛋白带有GFP,且相对分子质量与理论值接近(图3B)。

图3 原核表达分析Fig. 3 Prokaryotic expression analysis
2.3 不同底物对LHT1-FRET探针的光强变化
取纯化后的原核表达蛋白,分别与PBS缓冲液、精氨酸、甘氨酸、谷氨酸、草甘膦混合后检测YFP和CFP的荧光比率变化。试验结果(图4)显示,在加入不同底物后,D535nm/D480nm的变化会有明显差异。其中加入阳性对照的甘氨酸和谷氨酸后,D535nm/D480nm明显升高,在加入药物 10 min 后,甘氨酸的D535nm/D480nm增加 13%,谷氨酸的增加6%;在加入药物 20 min 后,甘氨酸的D535nm/D480nm增加17%,谷氨酸的增加12%;在加入药物40 min后,甘氨酸的D535nm/D480nm增加 20%,谷氨酸的增加15%;随着时间推移,比率变化趋缓。草甘膦处理同样使D535nm/D480nm升高,其趋势与甘氨酸和谷氨酸接近,在 10、20、40 min 分别增加 7%、10%和12%。加入用作阴性对照的精氨酸后,D535nm/D480nm没有变化。仅含PBS缓冲液的空白对照组的D535nm/D480nm同样没有明显变化 (图 4A)。不同底物的光强比率最大变化(图4B)也进一步表明,所构建的LHT1的FRET探针对甘氨酸、谷氨酸、草甘膦光强有较大影响,说明对底物有较强的转运能力;而对PBS缓冲液和精氨酸影响较小,说明对该底物的转运能力低或不转运。
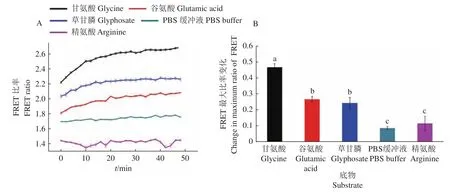
图4 不同底物对LHT1-FRET探针光强变化Fig. 4 Changes in light intensity of the LHT1-FRET probe with different substrates
2.4 不同底物浓度对LHT1-FRET探针光强变化的影响
为了检测LHT1-FRET探针的检测域和灵敏度,以不同浓度底物对LHT1-FRET探针光强比率影响进行检测。加入不同浓度底物后,D535nm/D480nm变化会有明显差异。其中阳性对照的甘氨酸分别按照 0.5、5 和 100 mmol/L 加入后,20 min 后D535nm/D480nm分别升高 3%、3% 和10%(图 5B);阳性对照的谷氨酸分别按照5 和50 mmol/L加入后,20 min 后的D535nm/D480nm分别升高 2% 和 9%(图 5C);草甘膦处理同样以 1 、5 和 30 mmol/L 浓度加入后,20 min 后的D535nm/D480nm分别升高 3%、1%和13%(图5A)。而加入浓度为10 mmol/L的阴性对照精氨酸2,4-二氯苯氧乙酸(2,4-D)、乙氧氟草醚,D535nm/D480nm没有升高 (图 5D)。由此说明,FRET变化明显受底物浓度影响。底物浓度越高,FRET比率变化越明显,在较低底物浓度下,FRET比率变化会较小,说明该探针在灵敏度方面需要进一步改进。

图5 不同底物浓度对LHT1-FRET探针光强变化(D535 nm/D480 nm)的影响Fig. 5 Effects of substrate concentrations on the light intensity (D535 nm/D480 nm) of the LHT1-FRET probe
2.5 酵母真核表达的共聚焦检测
当供体荧光分子和受体荧光分子存在能量转移时,对受体荧光分子进行光漂白后,供体荧光分子的荧光会升高,通过检测其漂白前、后的光强变化来计算FRET效率。结果显示,在加入浓度均为10 mmol/L的不同底物后,漂白前(图6A)、后(图6B),FRET效率变化会有明显差异。其中加入阳性对照的甘氨酸和谷氨酸后,FRET效率变化比较明显,其中甘氨酸的FRET效率达到30%,谷氨酸的FRET效率也达到26%。加入草甘膦处理的FRET效率与谷氨酸接近,也达到26%。含PBS缓冲液的空白对照组没有明显的FRET效率变化(图7)。与原核表达的探针检测结果一致。

图6 荧光分子漂白(514 nm激光)前、后的光强变化Fig. 6 Changes of light intensity in fluorescent molecules before and after 514 nm laser bleaching

图7 光漂白法测定不同底物处理后的FRET效率Fig. 7 FRET efficiencies of treatments with different substrates measured by photobleaching method
3 讨论与结论
自被报道参与拟南芥根部氨基酸的吸收以来,LHT1已有大量研究。对唯一氨基酸氮源的筛选证明,LHT1对中性氨基酸和酸性氨基酸有较高亲和力,而对碱性氨基酸亲合力最低[19-20]。Chen等[11]证明拟南芥LHT1可以转运氨基酸衍生物CAP-Gly-2。本研究结果显示,在原核表达中LHT1-FRET探针可以与中性氨基酸甘氨酸和酸性氨基酸谷氨酸、谷氨酰胺结合,而不结合碱性氨基酸精氨酸,结果与文献报道的一致。另外,本文试验证明了LHT1可能与草甘膦发生结合,进一步拓展了LHT1转运底物的范围。
本研究以LHT1转运蛋白为主要研究对象,选用CFP 和YFP结合FRET技术,构建基于LHT1的FRET探针,进一步研究LHT1对多种氨基酸的转运。本文构建了2种表达系统质粒,分别在原核细胞和酵母细胞中表达,用作阳性对照的氨基酸处理后,FRET比率均有明显的变化,说明成功构建了FRET探针。LHT1是拟南芥氨基酸转运蛋白,为跨膜转运蛋白,其在低等的原核细胞BL21中表达的蛋白结构与拟南芥天然LHT1蛋白有所差异,在试验中表现出较低灵敏度,但原核细胞BL21表达系统操作简单,且通过酶标仪即可检测,方便实验室快速操作,但Vanoaica等[21]报道Arg-FRET探针检测到μmol级别,有可能是不同的表达体系造成的,说明更高级的表达系统HEK293T细胞对FRET探针的灵敏度有帮助,可以通过更高级的表达系统获得高灵敏度的LHT1-FRET探针,从而用于筛选体外药物。利用酵母体系表达LHT1-FRET探针,灵敏度似乎要高于原核表达体系。但酵母表达的探针进行单细胞检测需要在激光共聚焦显微镜下操作,光漂白处理对细胞有影响,不利于在单细胞中多次测量,同时也不能进行实时动态检测[22]。另一方面也可以在LHT1-FRET探针结构上尝试更多的组合,改变蛋白之间的linker,来提高探针的灵敏度[23]。
综上所述,本研究成功构建了基于拟南芥氨基酸转运蛋白LHT1的FRET探针,并分别在原核细胞和真核细胞中成功表达,证明LHT1确实参与了多种氨基酸的转运,同时证明了草甘膦能够被氨基酸转运蛋白LHT1转运,为氨基酸导向农药的设计提供了理论依据,为导向农药的快速筛选提供了平台。
