基于脲酶诱导碳酸钙沉积固化土体的研究进展
2022-01-13赖汉江崔明娟
赖汉江,崔明娟
1. 福州大学 紫金地质与矿业学院,福州 350108;2. 福州大学 土木工程学院,福州 350116
1 引言
基于诱导碳酸钙沉积固化土体是近年来岩土工程领域新兴起的一种高效、绿色、低成本的新型环保地基处理技术。该技术主要基于尿素(CO(NH2)2)的水解产生碳酸根(CO32-)(如式1所示),在引入钙离子(Ca2+)的条件下析出具有胶结作用的碳酸钙晶体(CaCO3)(如式2所示),将松散的土体颗粒胶结成为整体,从而达到提高土体抗剪强度的目的。目前,基于尿素水解诱导产生碳酸钙晶体的方式主要有2种:(1)基于产脲酶菌的微生物诱导碳酸钙沉积(Microbially Induced Calcite Precipitation,以下简称MICP技术)(van Paassen et al.,2010;Al Qabany and Soga,2013;Zhao et al.,2014;Cui et al.,2017;Cheng et al.,2019;Liu et al.,2020);(2)基于脲酶的酶诱导碳酸钙沉积(Enzyme Induced Carbonate Precipitation,以下简称EICP技 术)(Almajed et al.,2018,2019;Hoang et al.,2019,2020;吴林玉等,2020;Cui et al.,2020)。
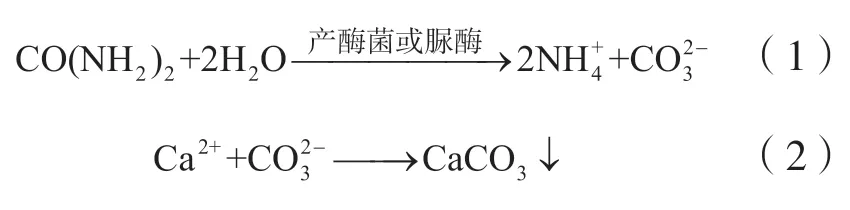
近20年,国内外学者对基于诱导碳酸钙沉积固化土体技术开展了大量的研究工作。然而,目前大部分的研究都主要集中在MICP技术方面,而对于EICP技术的研究则相对较少。尽管如此,如图1所示,关于EICP固化土体技术研究的文献近年来呈显著增长趋势,其中超过60%的文献是近3年(2018~2020年)所发表。由此可见,近年来国内外研究学者对于EICP固化土体技术的关注度逐渐提高,分析其原因可能是:EICP技术是直接利用脲酶进行尿素水解,因此一般不涉及生物安全问题,也不需要考虑是否有氧。此外,脲酶的尺寸约为12 nm(Blakely and Zerner,1984),远小于细菌的尺寸,约0.5~3 μm(Tsesarsky et al.,2016)。也就是说,相比于MICP技术,EICP技术可适用于粒径更小土体的处理。因此,本文从脲酶类型及来源、EICP固化土体处理方法及EICP固化土体强度增长等方面,对近20年基于脲酶诱导碳酸钙沉积固化土体的研究进行回顾与总结。
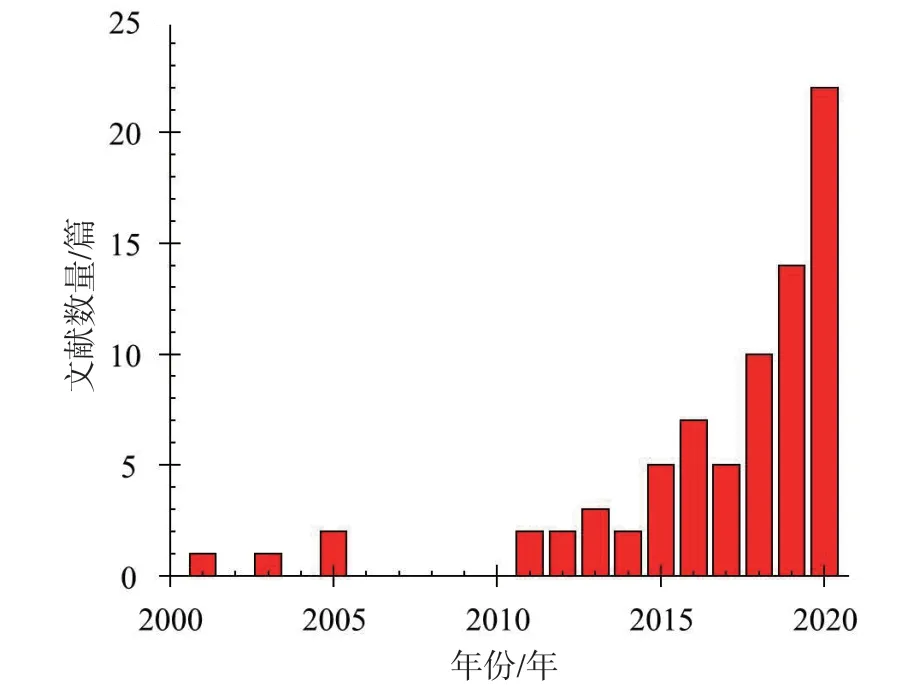
图1 近20年EICP文献发表数量统计Fig. 1 Statistics of the number of publications about the EICP in the past 20 years
2 脲酶类型及来源
如图2所示,根据所用脲酶的类型及来源对近20年关于EICP固化土体研究的文献进行了分类统计。脲酶的类型主要包括植物脲酶和细菌脲酶两类。其中,植物脲酶的来源主要包括商业购买和自提取两种方式,而细菌脲酶则主要是通过自提取获得。
图2 EICP文献按所用脲酶类型及来源分类统计Fig. 2 Classification of the literatures abut the EICP according to the type and source of urease used
从图2中可看出,目前大多关于EICP的研究采用的是商业购买的植物脲酶。这类脲酶活性高(一般都在1500 U/g以上),但价格昂贵,对于大规模的现场应用而言,过高的成本将是主要限制之一。为减小采用EICP技术进行地基处理的成本,一些学者提出可以从黄豆(Gao et al.,2019;吴林玉等,2020;Lee and Kim,2020;Miao et al.,2020;Wu et al.,2020)、刀豆(Park et al.,2014;Nam et al.,2015)、西瓜籽(Dilrukshi et al.,2016,2018;Javadi et al.,2018)等植物种子中提取粗脲酶溶液。其提取过程一般较为简便,主要包括以下步骤:(1)将植物种子晾晒或低温下烘干并磨成粉;(2)将一定量的植物种子粉溶解在蒸馏水或其他溶剂中,搅拌一段时间后放置在4℃条件下;(3)静置一段时间后,取其上清液进行离心获得粗脲酶溶液。需要说明的是,自提取的植物粗脲酶溶液的活性一般都较低,尽管能够通过提高植物种子的用量来提高活性,但随着用量的提高,所提取粗脲酶溶液的粘稠度也会随之升高,会显著增加注浆的时间及难度。
此外,Hoang等(2019,2020)、Cui等(2020)及He等(2020)提出采用超声破碎法,从产脲酶菌中提取粗脲酶溶液。其中,Hoang等(2019,2020)、Cui等(2020)采用“运行—冷却”的循环方法提取脲酶,即运行超声破碎仪对细菌进行超声破碎,一段时间后停止设备运行以冷却细菌溶液,并且在此过程中保证细菌溶液温度不超过35℃。He等(2020)则将细菌溶液放置在冰水中,并采用间断运行设备的方式(运行5 s,暂停5 s),以确保脲酶提取过程中溶液温度不会过高。需要说明的是,细菌脲酶溶液的活性一般取决于细菌溶液的活性,通常为细菌活性的2~3倍(Hoang et al.,2019,2020;Cui et al.,2020),但其活性衰减要比细菌的快。而细菌的活性则与取决于细菌类型、接种量、培养时间等诸多因素。此外,细菌脲酶的获取还涉及菌种的活化、接种、培养、保存的诸多问题,需要较好的生物操作技能。同时,与植物脲酶的提取相比,细菌脲酶提取的过程较为复杂、耗时较长,且所需的设备较多。上述问题在一定程度上可能会限制采用细菌脲酶进行大规模的实际工程应用。
3 EICP固化土体处理方法
既有EICP固化土体技术的研究中,所采用的处理方法主要包括两种:(1)预混合法(Yasuhara et al.,2012;Oliveira et al.,2014;Simatupang and Okamura,2017;Almajed et al.,2018,2019);(2)渗透注浆法(Nemati et al.,2003;Neupane et al.,2015;Handley-Sidhu et al.,2013;Hoang et al.,2019,2020;吴林玉等,2020)。其中,预混合法是将脲酶粉或EICP处理液(氯化钙、尿素与脲酶的混合液)与待固化土体搅拌混合均匀后,装入模具中进行养护。该方法可制备碳酸钙分布相对较为均匀的试样,但一般不适用于原位处理。渗透注浆法则是将脲酶溶液与胶结液(即氯化钙与尿素的混合液)先后(先注脲酶溶液并静置一定时间,而后注入胶结液)或同时通过渗透的方式从待固化土体表面注入土体中。其中,前者一般称为二阶段注浆法(two-phase injection method),后者称为一次注浆法(One-phase injection method)。
二阶段注浆法被广泛应用于基于MICP技术的土体固化,既有文献报道(Al Qabany等,2012,Cui et al.,2020),采用该方法进行MICP处理的钙离子转化效率相对较高。然而,对于EICP技术而言,采用二阶段法进行处理的钙离子转化效率则相对较低。譬如,Hoang等(2019)采用二阶段注浆法对MICP和EICP处理进行了对比研究,发现在相同处理条件下,EICP固化砂柱的碳酸钙含量仅为MICP固化砂柱的一半。Cui等(2020)也报道,采用二阶段注浆法,EICP技术的钙离子转化效率要远比MICP技术的要小,并指出这是由于脲酶尺寸小且吸附能力差,采用二阶段注浆法很难将脲酶保留在试样内。
对于一次注浆法,由于细菌(或脲酶)与胶结液混合后,会立即产生大量的絮凝物,导致固化试样内沉积碳酸钙的晶体出现不均匀分布的现象。为此,Cheng等(2019)提出了一种一相低pH注浆法(one-phase-low-pH),即将细菌溶液与胶结液混合后,采用1.0 M的盐酸将其pH值调低,而后再将其注入到试样内。Cui等(2020)借鉴了Cheng等(2019)提出的一相低pH注浆法,采用2.0 M的盐酸先将细菌脲酶溶液pH值调至6.5后,将其与胶结液和蒸馏水按一定的体积比例混合制备EICP处理液对砂土进行固化。研究结果显示,采用这种一相低pH注浆方法,对于钙离子浓度为1.0 M的EICP处理液,在间隔24小时条件下,钙离子转化效率几乎能达到100%,且沉积的碳酸钙沿试样高度方向分布也较为均匀。
4 EICP固化土体强度增长
在强度方面,如图3所示,最近发表的文献基本上均一致认为,EICP固化试样的强度要比相同碳酸钙含量条件下MICP固化试样的要高。譬如,Hoang等(2019)发现,在相同处理次数条件下,EICP固化试样的无侧限抗压强度要比MICP固化试样的高,尽管EICP固化试样的碳酸钙含量较低。Cui等(2020)采用一相低pH注浆法制备了EICP和MICP固化试样,发现在相同处理条件下,两者的碳酸钙含量基本相同,且碳酸钙含量沿试样高度方向的分布也都较为均匀,但EICP固化试样的强度明显要比MICP固化试样的高,且两者的差异随胶结水平的提高而呈增长趋势。Nafisi等(2019)也指出,要达到相同剪切波速(用于表征试样刚度),EICP固化试样所需的碳酸钙含量要比MICP固化试样的低。
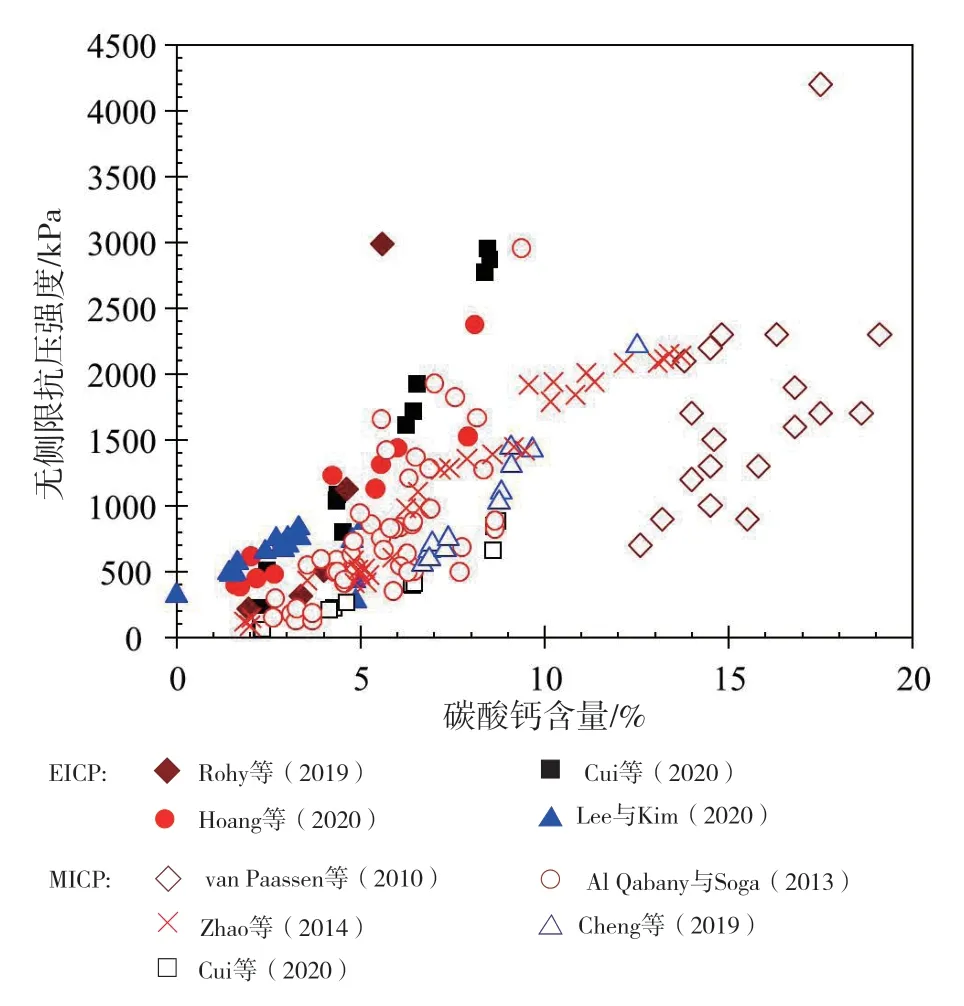
图3 EICP和MICP固化试样无侧限抗压强度与碳酸钙含量关系对比Fig. 3 Comparison of the relationship between unconfined compressive strength and calcium carbonate content of the EICP and MICP treated samples
在强度增长机理方面,Hoang等(2019)认为EICP试样和MICP试样之间强度的差异是由碳酸钙沉积位置的差异造成的,EICP固化试样内碳酸钙晶体主要沉积在颗粒接触位置(即倾向性沉积现象明显)(图4a),而在MICP固化试样内则相对均匀地分布在颗粒表面及颗粒接触位置(图4b)。另一方面,Nafisi等(2019)、Cui等(2020)的试验结果则显示,碳酸钙晶体在EICP固化试样内并没有明显的倾向性沉积,如图4c—图4f所示, EICP与MICP固化试样内的碳酸钙晶体均相对均匀地分布在颗粒表面及颗粒接触位置。同时,Nafisi等(2019)和Cui等(2020)均认为,EICP和MICP强度之间的差异是由于碳酸钙晶体的形态和尺寸之间的差异造成的。Nafisi等(2019)发现EICP固化试样内的碳酸钙以球形的球霰石为主(图4c),而MICP固化试样内的碳酸钙则以菱形的方解石为主(图4d)。相反,Cui等(2020)则发现,EICP试样内的碳酸钙以方解石为主(图4e),而MICP试样内球霰石的比例较高(图4f)。综上所述,目前对于造成EICP与MICP固化土体之间强度差异的原因尚未达成共识。

图4 文献报道的EICP和MICP固化试样SEM图Fig. 4 SEM images of the EICP and MICP treated sample reported in previous studies
5 研究展望
与MICP技术相比,EICP技术具备无生物安全风险、不需考虑是否有氧、固化强度更高等诸多优势。尽管如此,对于EICP技术在实际岩土工程中的应用,以下2个方面的问题尚需解决:
(1)固化土体的均匀性。目前关于EICP处理的研究,主要都是基于实验室小尺寸试样的固化,而实际岩土工程中一般都是大范围的地基处理。既有的处理方法,在大规模处理时能否保证固化土体的均匀性尚需进一步研究。
(2)脲酶的提取。植物种子中提取的脲酶活性低,而从产脲酶菌中提取脲酶,则条件较为严苛且极为耗时。因此,基于目前的脲酶提取方法,较难满足大规模工程应用中对脲酶活性及用量的要求。因此,对于脲酶提取的方法尚需进一步研究。
6 结论
本文对近20年基于脲酶诱导碳酸钙沉积固化土体的研究进行了回顾与总结。主要得到以下结论:
(1)脲酶类型主要包括植物脲酶和细菌脲酶,植物脲酶来源包括商业购买和自提取两种,而细菌脲酶则主要通过自提取获得。商业购买脲酶活性高,但价格昂贵;自提取植物脲酶价格便宜、提取过程也较为简便、但活性相对较低;自提取细菌脲酶活性相对较高,但提取过程较为复杂且耗时,同时还要求具备一定的生物操作技能。
(2)EICP固化土体处理方法主要包括预混合法和渗透注浆法。其中,预混合法一般不适用于原位处理,渗透注浆法中的二阶段注浆法则因不利于脲酶保留在土体内而导致钙离子转化效率较低,而采用一相低pH注浆法能够将有效地将脲酶保留在土体中,进而显著提高钙离子转化效率。
(3)EICP固化试样的强度要比相同处理条件下MICP固化试样的强度要高,但是对于造成EICP和MICP固化试样强度差异的原因目前尚未达成共识,有待开展更多的研究。
