基于初级胆汁酸合成探讨乳香醋炙对溃疡性结肠炎的增效机制
2022-01-13彭诗涛刘振丽张琳琳万晓莹宋志前宁张弛
彭诗涛,刘振丽,王 淳,张琳琳,万晓莹,宋志前*,宁张弛*
• 药理与临床•
基于初级胆汁酸合成探讨乳香醋炙对溃疡性结肠炎的增效机制
彭诗涛1,刘振丽1,王 淳1,张琳琳2,万晓莹1,宋志前1*,宁张弛1*
1. 中国中医科学院 中医基础理论研究所,北京 100700 2. 浙江省食品药品检验研究院 国家药品监督管理局中成药质量评价重点实验室,浙江 杭州 310052
从对初级胆汁酸合成的影响,探讨醋炙增强乳香改善溃疡性结肠炎(ulcerative colitis,UC)的作用机制。基于2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)法建立UC大鼠模型,采用超高效液相色谱-质谱联用(UPLC-TQ-MS)法测定大鼠血浆中6种初级胆汁酸含量;进一步借助L-02肝细胞模型,围绕初级胆汁酸合成场所肝脏,探究乳香醋炙前后及醋炙前后差异成分3-乙酰-9,11-去氢-β-乳香酸(3-acetyl-9,11-dehydro-β-boswellic acid,ADHBA)的干预作用,以ELISA法考察胆汁酸前体胆固醇变化,采用qRT-PCR法测定游离型初级胆汁酸合成酶胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,)、甾醇12α-羟化酶(sterol 12α-hydroxylase,)、甾醇-27-羟化酶(27‑hydroxycholesterol,)、氧甾醇-7α-羟化酶(oxysterol-7α-hydroxylase,)、结合型初级胆汁酸合成酶胆汁酰基辅酶A合成酶(bile acyl-CoA synthetase,)和胆汁酸-辅酶A:氨基酸正酰基转移酶(bile acid-CoA: amino acid‑acyltransferase,)mRNA表达水平。乳香醋炙后,对UC模型大鼠血浆中的初级胆汁酸总量和游离型、结合型初级胆汁酸总量的回调水平更接近正常组。乳香、醋乳香、醋炙前后差异成分ADHBA均可降低胆汁酸合成前体胆固醇水平,但以醋乳香及ADHBA的调控作用更加明显。醋乳香对游离型初级胆汁酸合成经典途径中CYP7A1的抑制和CYP8B1的上调作用以及对结合型初级胆汁酸合成酶BACS、BAAT的上调作用强于乳香组,乳香联合ADHBA组同醋乳香组上调作用一致。乳香醋炙后对初级胆汁酸合成调控作用主要是基于其对游离型初级胆汁酸经典合成途径中限速酶CYP7A1的抑制,回调机体在UC病理状态下的初级胆汁酸水平,进而增强乳香对UC的改善作用;ADHBA可能为乳香醋炙增效的物质基础之一。
乳香;醋炙;初级胆汁酸;溃疡性结肠炎;增效;胆固醇-7α-羟化酶;3-乙酰-9,11-去氢-β-乳香酸
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不明确的结肠和直肠慢性非特异性疾病。临床主要表现为腹泻、腹痛及黏液脓血便[1]。近年来,UC发病率呈逐年增高趋势[2],已成为严重威胁人类健康的疾病之一。中医学将UC归属于“肠澼”“泄泻”“痢疾”等范畴。刘元素的《素问玄机原病式》对其病机进行了阐述,指出:“诸泻痢皆属于湿,湿热甚于肠胃之内,而肠胃怫郁,以致气液不得宣通而成”。湿热滞留于大肠,与气血相搏结,使肠道传导失司、脂络受伤、气凝血滞,继而血败肉腐化脓。“化瘀行气”是中医临床治疗遵循的法则之一[3]。
乳香具有活血行气化瘀、消肿止痛的功效,为橄榄科植物乳香树Birdw.及同属植物–Birdw.树皮渗出的树脂[4]。临床研究证实,乳香醇制剂对UC有很好的疗效,80%的患者服用后病情得到缓解[5],其对慢性结肠炎II、III级患者有效率分别为100%和60%[5-6]。炮制是中医临床用药特色。传统炮制理论认为,乳香经过醋炙后,可以增强其活血行气止痛的功效,降低刺激性[7]。本课题组前期研究显示,乳香和醋乳香均可改善UC模型大鼠结肠病变和炎性细胞因子水平,且醋炙后作用增强[8],并从醋炙前后化学成分的变化[9-12]、醋中活性成分作用[13]以及醋炙后活性成分吸收增强角度[14],对增效原因进行了研究。其中,3-乙酰-9,11-去氢-β-乳香酸(3-acetyl-9,11-dehydro-β-boswellic acid,ADHBA)在乳香醋炙后含量增加10倍以上[9],是值得关注的主要差异成分之一。
胆汁酸与UC等肠道疾病关系密切[15]。肠道UC状态可扰动机体内初级胆汁酸水平发生变化[16-17]。肝脏是胆汁酸合成的主要部位。在肝脏中,胆固醇在胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、甾醇12α-羟化酶(sterol 12α-hydroxylase,CYP8B1)、甾醇-27-羟化酶(27‑hydroxycholesterol,CYP27A1)、氧甾醇-7α-羟化酶(oxysterol-7α-hydroxylase,CYP7B1)作用下生成游离型初级胆汁酸,即胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA)。CA、CDCA再通过结合型初级胆汁酸合成酶胆汁酰基辅酶A合成酶(bile acyl-CoA synthetase,BACS)和胆汁酸-辅酶A:氨基酸正酰基转移酶(bile acid-CoA: amino acid‑acyltransferase,BAAT)作用与甘氨酸或牛磺酸结合,产生结合型初级胆汁酸牛磺胆酸(taurocholic acid,TCA)、甘氨胆酸(glycocholic acid,GCA)、牛磺鹅去氧胆酸(taurochenodeoxycholic acid,TCDCA)和甘氨鹅去氧胆酸(glycochenodeoxycholic acid,GCDCA)[18]。
为探究醋炙增强乳香对UC改善作用的本质,本研究基于2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)法构建UC模型,建立初级胆汁酸含量测定方法,明确乳香醋炙前后对机体初级胆汁酸水平的影响。通过探究乳香醋炙前后对胆固醇、初级胆汁酸合成酶CYP7A1、CTP27A1、CYP7B1、CYP8B1、BACS与BAAT的作用,从初级胆汁酸合成角度揭示乳香醋炙增效的机制。
1 材料
1.1 血浆样本
血浆样本来自于正常、UC模型、乳香(0.45 g/kg,临床等效剂量)、醋乳香(0.45 g/kg,临床等效剂量)组大鼠,为本课题组前期进行乳香醋炙前后对UC大鼠抗炎作用对比研究实验所收集[8]。
1.2 饮片
乳香购自北京同仁堂药店,经北京中医药大学刘春生教授鉴定为橄榄科植物乳香树Birdw.树皮渗出的树脂。醋乳香为实验室自制,经检查符合《中国药典》2020年版标准[4]。
1.3 药品与试剂
ADHBA为实验室自制(质量分数≥95%);对照品CA(批号T16J8Q28663)、CDCA(批号Z01011LA14)、TCA(批号M26A8E42428)、GCA(批号Y08O7K22248)、TCDCA(批号DST180920-031)、GCDCA(批号Y29M9K57235)均购自上海源叶生物科技有限公司,质量分数均≥98%;对照品GCA-d4(批号739723)、CA-d4(批号614149)、DCA-d4(批号614130)均购自美国Sigma公司,质量分数均≥98%;、、、、、、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,)引物由生工生物工程(上海)股份有限公司设计合成;DMEM高糖培养基(批号11965092)、胎牛血清(批号10099141)均购自美国Gibco公司;胆固醇ELISA测定试剂盒(批号CEB701Ge)购自武汉云克隆科技股份有限公司;Trizol试剂(批号ET101-01)、Trans Script First-Strand cDNA Synthesis Super Mix for qPCR试剂盒(批号AT341-01)、Trans Script Top Green qPCR Super Mix试剂盒(批号AT131-01)均购自北京全式金生物技术有限公司。
1.4 仪器
Waters Xevo TQ-S micro质谱仪(美国Waters公司);CP225D型电子天平(德国Sartorius公司);LWFS31310T型实验室水纯化系统[颇尔富迪生物分析仪器(上海)有限公司];VORTEX2型涡旋振荡器(德国IKA公司);TGL-16B型高速离心机(上海安亭科学仪器厂);3111型CO2培养箱、−80 ℃ Freezer超低温冰箱、NANODROP 2000c型分光光度计(美国Thermo Fisher Scientific公司);CFX-96型qRT-PCR仪(美国Bio-Rad公司)。
2 方法
2.1 乳香醋炙前后对UC大鼠血浆中初级胆汁酸含量的影响
2.1.1 系列混合对照品溶液的制备 分别取CA、TCA、GCA、CDCA、TCDCA、GCDCA对照品适量,精密称定,加甲醇制成各对照品溶液浓度为30 mmol/L的储备液。精密吸取适当体积的各储备液,混匀,制成上述各成分浓度分别为2 716.79、2 365.72、2 083.33、2 445.36、2 055.23、2 513.23 μmol/L的混合对照品溶液。通过对混合对照品溶液进行倍比稀释,得系列混合对照品溶液。此外,设定混合对照品溶液浓度的1/2、1/4、1/8为高、中、低3个浓度,进行后续方法学考察。
2.1.2 内标混合溶液的制备 分别取GCA-d4、CA-d4、DCA-d4对照品适量,精密称定,加甲醇制成终浓度为100 μmol/L的内标储备液。分别精密吸取各储备液1 mL于10 mL量瓶中,加甲醇至刻度,混匀,得内标混合溶液。
2.1.3 血浆供试品前处理方法 精密吸取各组大鼠待测血浆50 μL,分别精密加入甲醇200 μL及内标混合溶液50 μL,涡旋30 s,充分混合,4 ℃、14 000 r/min离心10 min。精密吸取上清液200 μL,氮吹干燥后,精密加入甲醇50 μL,充分溶解,即得。
2.1.4 质控系列样品制备
(1)质控样品制备:精密等量吸取各组血浆供试品于离心管中,涡旋混匀,即得。
(2)提取前加入对照品的质控样品制备:精密吸取50 μL质控样品,共6份,分别精密加入50 μL内标混合溶液及50 μL高、中、低3个浓度的混合对照品溶液、150 μL甲醇,涡旋10 s,4 ℃、14 000 r/min离心10 min。取200 μL上清液,氮吹干燥后,精密加入50 μL甲醇,充分溶解,即得。
(3)提取后加入对照品的质控样品制备:精密吸取50 μL质控样品,共6份,分别精密加入50 μL内标混合溶液及200 μL甲醇,涡旋混合10 s,4 ℃、14 000 r/min离心10 min。取200 μL上清液,氮吹干燥后,分别精密加入50 μL高、中、低3个浓度的混合对照品溶液,充分溶解,即得。
2.1.5 色谱条件 Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~6.0 min,25%~40% B;6.0~20.0 min,40%~70% B;20.0~20.1 min,70%~100% B;20.1~23.0 min,100% B;23.0~23.1 min,100%~25% B;23.1~25.0 min,25% B;弱洗溶剂为水-乙腈(95∶5),强洗溶剂为异丙醇;体积流量为0.2 mL/min;柱温为40 ℃;自动进样器温度为10 ℃;进样量为2 μL。
2.1.6 质谱条件 质谱采用电喷雾电离源(ESI);毛细管电压为3.5 kV;离子源温度为150 ℃;去溶剂温度为550 ℃;去溶剂气体体积流量为1000 L/h;碰撞气体体积流量为0.25 mL/h。采用多反应监测(multi-reaction monitoring,MRM)模式进行扫描。各胆汁酸成分的主要质谱检测参数见表1。
2.1.7 方法学考察
(1)专属性考察:取“2.1.4”项下质控样品,按照“2.1.3”项下的血浆供试品前处理方法制备,采用“2.1.5”项下色谱方法及“2.1.6”项下质谱方法进行分析。
表1 胆汁酸成分的质谱检测参数
Table 1 Mass spectrometric parameters of bile acids
序号胆汁酸成分定量离子对(m/z)锥孔电压/V碰撞能量/eVtR/min内标 1CA407.52>69.10403519.74CA-d4 2TCA514.42>514.4210010.53GCA-d4 3GCA464.80>74.0053014.36GCA-d4 4CDCA391.06>391.0640024.59DCA-d4 5TCDCA498.34>80.031205015.21GCA-d4 6GCDCA448.34>73.76406020.90CA-d4
(2)线性关系、定量下限(LLOQ)和检测下限(LLOD)考察:取“2.1.4”项下质控样品,加入活性炭,配制成活性炭质量浓度为0.053 g/mL的血浆混悬液,涡旋1 h使其充分接触吸附,4 ℃、14 000 r/min离心10 min,取上清,得到空白基质溶液。精密吸取空白基质50 μL,制备6份,依次精密加入“2.1.1”项下系列混合对照品溶液50 μL,甲醇150 μL和内标混合溶液50 μL,涡旋10 s,振荡3 min,4 ℃、14 000 r/min离心10 min。取上清液200 μL,氮吹干燥后,精密加入甲醇50 μL,充分溶解,进样测定。以峰面积()为纵坐标,进样量()为横坐标,得含基质对照品溶液线性关系。将对照品浓度不断稀释,测定峰面积,以信噪比(/)=10确定为本方法的LLOQ,以/=3确定为本方法的LLOD。
(3)精密度和重复性考察:取“2.1.4”项下质控样品,按照“2.1.3”项下的血浆供试品前处理方法配制低、中、高3个浓度样品,重复进样6次,考察本方法的日内、日间精密度。取“2.1.4”项下质控样品,制备6份,按照“2.1.3”项下的血浆供试品前处理方法配制低、中、高3个浓度样品,进行测定,考察方法的重复性。
(4)加样回收率和基质效应考察:在低、中、高3个浓度下,将相同体积“2.1.4”项下质控样品进样测定并计算各胆汁酸成分峰面积比值,得到回收率。
将“2.1.7(2)”项下的线性关系用含血浆基质的对照品溶液进行分析,得到标准曲线的斜率,即血浆基质,将“2.1.1”项下的系列混合对照品溶液进行分析,得到标准曲线的斜率,即溶剂;采用回收因子(recovery factors,RF)评价基质效应。
RF=血浆基质/溶剂
(5)稳定性考察:取“2.1.4”项下质控样品,按照“2.1.3”项下方法分别配制低、中、高浓度样品,平行制备6份。分别于室温下放置24 h、于−20 ℃保存2个月、连续“冷冻-融化”3个循环后,进行分析,测定血浆中目标成分的实际浓度,考察样品的短期室温稳定性、长期稳定性及冻融稳定性。
(6)残留考察[19]:精密吸取“2.1.7(2)”项下含基质对照品溶液的最高浓度样品进行分析后,对空白溶剂进行分析,测定各成分的残留浓度(残留),计算残留率。
残留率=残留/LLOQ
2.1.8 含量测定 取各组大鼠血浆,按照“2.1.3”项方法制备,测定各组大鼠血浆胆汁酸含量。
2.1.9 统计分析 运用SPSS 22.0软件对数据进行正态性检验和方差齐性检验。若两项检验均符合,则进一步采用单因素方差分析进行统计学处理。组间比较采用LSD-检验。
2.2 乳香醋炙前后及主要差异成分ADHBA对胆固醇水平的影响
2.2.1 药物制备
(1)乳香溶液和醋乳香溶液的制备:各取乳香、醋乳香粉末约0.5 g,精密称定,分别加入95%乙醇75 mL,超声处理30 min,滤过,滤液减压回收溶剂至干,残渣用无水乙醇溶解并定容于10 mL量瓶中,摇匀,即得。
(2)ADHBA溶液的制备:取ADHBA约4 mg,精密称定,以无水乙醇溶解,定容于10 mL量瓶中,摇匀,即得。
(3)乳香+ADHBA溶液的制备:取乳香粉末约0.5 g,精密称定,加入95%乙醇75 mL,超声处理30 min,滤过,滤液减压回收溶剂至干,得乳香残渣。另取ADHBA约4 mg,精密称定,与乳香残渣混合,用无水乙醇溶解并定容于10 mL量瓶中,即得。
吸取0.5 mL 10%聚山梨酯80的PBS溶液于15 mL离心管中,将离心管置于涡旋振荡器上,开启振荡器,使溶液始终保持涡旋状态。分别吸取上述各溶液100 μL,逐滴缓慢加入离心管中,边涡旋边滴加,然后各加入DMEM培养基至10 mL混合均匀后,用针头滤器除菌,即得。
2.2.2 L-02细胞培养 复苏L-02细胞,用含13%胎牛血清的DMEM培养基,于37 ℃、5% CO2恒温培养箱中培养。待细胞融合度为70%~80%时,进行消化传代,培养3~4代后用于实验,实验时采用对数生长期细胞。
2.2.3 CCK-8实验 取处于对数生长期的细胞,以1×104/孔接种至96孔板中,于37 ℃、5% CO2培养箱中培养48 h。弃去培养基,PBS清洗2遍后,加入不同质量浓度(5、10、25、50、100、200 μg/mL)醋乳香溶液,孵育48 h。每孔加入10 μL CCK-8试剂,于37 ℃、5% CO2培养箱中孵育3 h,采用酶标仪测定450 nm处吸光度()值。
2.2.4 ELISA法检测胆固醇水平 取处于对数生长期的细胞,以1×106/孔接种至6孔板中,于37 ℃、5% CO2培养箱中培养24 h。设置空白溶剂组、乳香组、醋乳香组、ADHBA组和乳香+ADHBA组。用含0.5%胎牛血清的DMEM培养基饥饿处理24 h后,再分别用“2.2.1”项下制备的含药物溶液的DMEM培养基培养24 h,取上清,按ELISA试剂盒说明书检测胆固醇含量。
2.3 乳香醋炙前后及主要差异成分ADHBA对游离型初级胆汁酸合成酶CYP7A1、CYP8B1、CYP27A1和CYP7B1 mRNA表达的影响
细胞培养方法同“2.2.4”项,收集细胞待测。取细胞约1×106个,加入1 mL裂解液,按说明书提取总RNA,超微量核酸蛋白测定仪测定RNA浓度。根据反转录试剂盒说明书将RNA反转录为cDNA,根据SYBR Premix Dimer Eraser试剂盒说明书进行扩增。、、、和引物序列见表2。反应体系为20 μL,反应条件为94 ℃、30 s,94 ℃、5 s,55 ℃、15 s,72 ℃、10 s,共40个循坏,以2−ΔΔCt法计算mRNA表达量。
表2 CYP7A1、CYP8B1、CYP27A1、CYP7B1和GAPDH引物序列
Table 2 Primers sequence of CYP7A1, CYP8B1, CYP27A1, CYP7B1 and GAPDH
引物序列 (5’-3’) CYP7A1F: GGAAAACCTCCAACGTATCATG R: GGAAAGACTTTGTCGAATTGCT CYP8B1F: GTATTTGGATACCGTTCAGTGC R: TTTGGACGTCAGCATTACAAAG CYP27A1F: AAGGCTGATCCAGAAGTACAAG R: GCCCACTTTCTTATTGGGAAC CYP7B1F: ACATACCCATTGAGCTTCTAGG R: AAAAACTTCTGACCATCCTTGC GAPDHF: TATGACAACAGCCCTCAAGAT R: AGTCCTTCCACGATACCA
2.4 乳香醋炙前后及主要差异成分ADHBA对结合型初级胆汁酸合成酶BACS、BAAT mRNA表达的影响
细胞培养方法同“2.2.4”项,收集细胞待测。提取总RNA、反转录cDNA、扩增方法同“2.3”项。、和引物序列见表3。
表3 BACS、BAAT和GAPDH引物序列
Table 3 Primers sequence of BACS, BAAT and GAPDH
引物序列 (5’-3’) BACSF: TCCCGAAGCCAGCCATCCTC R: GATCCCAACGACAAGTCCCATCAC BAATF: GGTCTTTGGCTCAGGCGTTGG R: ACCGTGGCTGTGACTTGCTTTAG GAPDHF: TATGACAACAGCCCTCAAGAT R: AGTCCTTCCACGATACCA
3 结果
3.1 乳香醋炙前后对UC大鼠血浆中初级胆汁酸含量的影响
3.1.1 方法学考察结果
(1)专属性:如图1所示,目标成分在相应保留时间处无杂质或其他内源性物质干扰。
(2)线性关系、LLOQ和LLOD:6个初级胆汁酸成分的线性方程见表4,为0.999 0~0.999 6,表明其在线性范围内线性关系良好,可以满足血浆中胆汁酸灵敏检测的要求。
(3)精密度和重复性:6个胆汁酸成分的精密度和准确度分别为1.35%~6.93%、1.32%~5.00%,均<15%[20],表明该方法的精密度和准确度良好。
(4)回收率和基质效应:各成分在低、中、高3个浓度下的回收率均为85.61%~113.86%,RSD值均低于15%,表明回收率结果符合检测要求[19]。基质效应结果表明,CA、TCA、GCA、CDCA、TCDCA和GCDCA的RF值分别为0.87、1.24、0.92、1.32、0.87、1.14,基质效应可在接收范围内[19]。
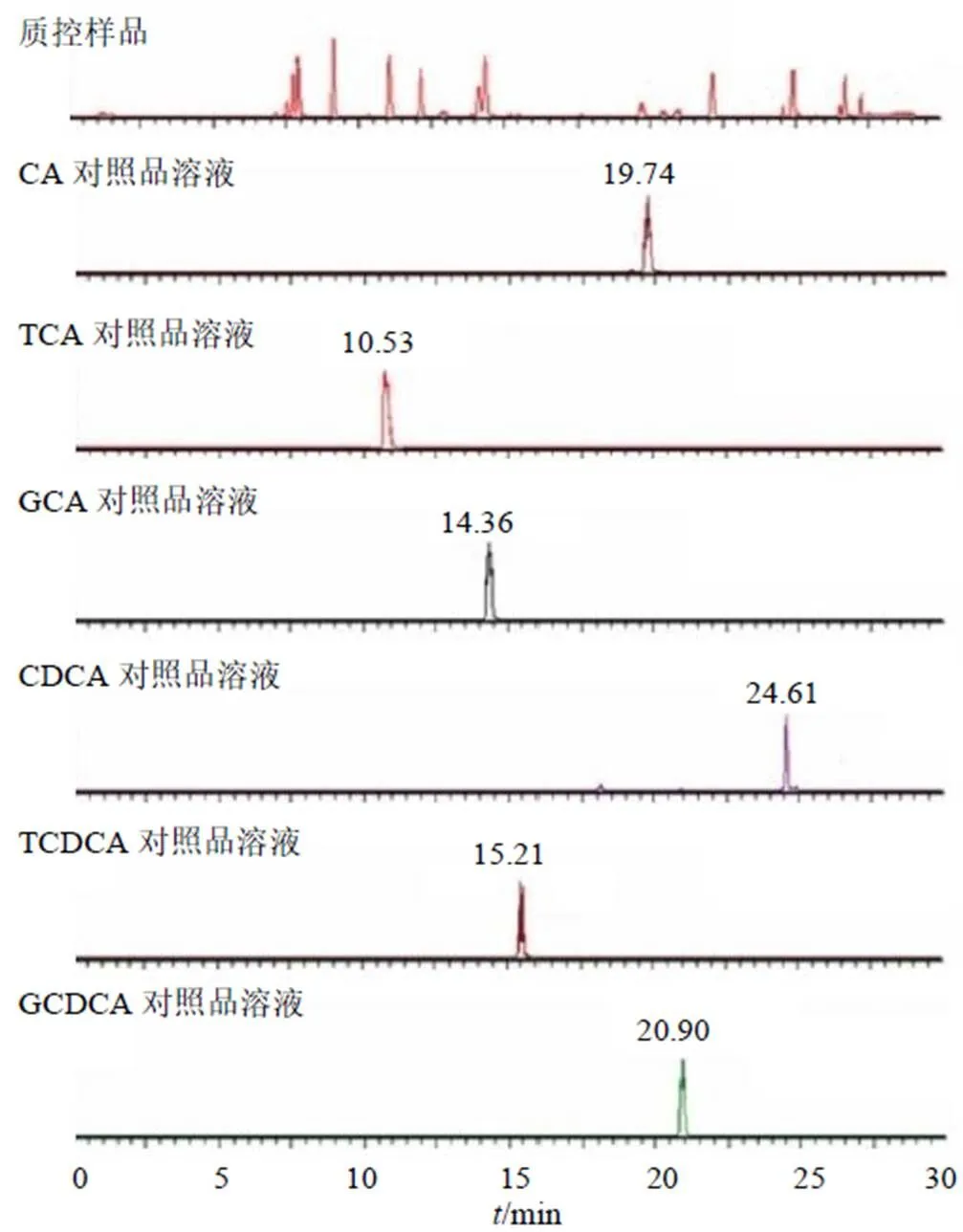
图1 胆汁酸成分的MRM色谱图
(5)稳定性:质控样品各胆汁酸成分的含量变化为−14.07%~14.05%,均小于15%,表明质控样品短期稳定性、长期稳定性及冻融-循环稳定性均符合标准[20]。
(6)残留考察:TCA、TCDCA和CA-d4存在残留,残留率分别为18.64%、1.65%和1.45%,符合待测成分残留小于LLOQ的20%,内标成分残留小于LLOQ的5%的标准[20]。
3.1.2 UC大鼠血浆中初级胆汁酸含量测定 如表5所示,与正常组相比,模型组大鼠血浆中初级胆汁酸总量以及游离型、结合型初级胆汁酸总量均显著升高(<0.01),CA、GCA、CDCA和GCDCA含量显著升高(<0.05、0.01),而TCA和TCDCA含量显著降低(<0.05)。乳香、醋乳香给药后对各胆汁酸表现出扰动作用,两者均对GCA、CDCA和GCDCA表现出明显的回调作用(<0.05、0.01),醋乳香组对于CA、CDCA和TCDCA、胆汁酸总量以及游离型、结合型初级胆汁酸总量的回调作用更趋近正常组。
表4 胆汁酸成分线性关系、LLOD及LLOQ
Table 4 Linear relationship, LLOD and LLOQ of bile acids
序号成分标准曲线r线性范围/(μmol·L−1)LLOD/(μmol·L−1)LLOQ/(μmol·L−1) 1CAy=0.01 x-12.380.999 521.22~2 716.790.742.81 2TCAy=0.67 x-2 052.850.999 218.48~2 365.720.060.19 3GCAy=4.83×10−3 x-3.160.999 316.28~2 083.330.150.48 4CDCAy=1.35 x+349.410.999 019.10~2 445.362.438.91 5TCDCAy=0.03 x-134.780.999 616.05~2 055.232.179.72 6GCDCAy=0.41 x-6 653.690.999 319.64~2 513.230.180.35
表5 大鼠血浆中胆汁酸成分含量(, n = 6)
Table 5 Bile acids concentration in rat plasma samples(, n = 6)
组别质量浓度/(μg·mL−1) CATCAGCACDCATCDCA 正常1 469.59±183.8346.20±2.5578.22±6.4017.60±1.8470.02±3.57 模型4 665.71±417.49▲20.66±1.05▲1 124.23±54.45▲▲84.08±6.49▲47.81±2.06▲ 乳香8 965.81±826.86#30.16±2.80645.39±41.79##64.46±6.93#812.23±5.15## 醋乳香1 528.72±102.91##**25.39±1.55658.54±44.92##25.15±1.85#*95.31±8.22#** 组别质量浓度/(μg·mL−1) GCDCA初级胆汁酸总量游离型初级胆汁酸总量结合型初级胆汁酸总量 正常98.86±18.421 780.49±216.611 487.19±185.67293.30±30.94 模型547.95±42.63▲▲6 490.44±524.17▲▲4 749.79±423.98▲▲1 740.65±100.19▲▲ 乳香99.19±4.32##10 617.24±887.85##9 030.27±833.79##1 586.97±54.06 醋乳香225.34±20.65#**2 558.45±180.1##**1 553.87±104.76##**1 004.58±75.34##**
CA、CDCA为游离型初级胆汁酸 TCA、GCA、TCDCA、GCDCA为结合型初级胆汁酸 与正常组比较:▲<0.05▲▲<0.01;与模型组比较:#<0.05##<0.01;与乳香组比较:*<0.05**<0.01
CA, CDCA are free primary bile acid TCA, GCA, TCDCA, GCDCA are combined primary bile acid▲< 0.05▲▲< 0.01normal group;#< 0.05##< 0.01model group;*< 0.05**< 0.01group
3.2 乳香醋炙前后及主要差异成分ADHBA对胆固醇水平的影响
3.2.1 CCK-8实验结果 醋乳香溶液质量浓度≥25 μg/mL时会对L-02细胞活力造成显著影响,故确定醋乳香溶液给药质量浓度为10 μg/mL。为保证乳香、ADHBA和醋乳香用于对比研究给药浓度的平行,对10 μg/mL乳香溶液和0.05 μg/mL的ADHBA溶液(10 μg/mL醋乳香当量)[21]进行了CCK8细胞毒性检测,结果表明两者对L-02细胞活力无显著影响,故确定乳香、醋乳香和ADHBA给药质量浓度分别为10、10、0.05 μg/mL。
3.2.2 胆固醇水平测定结果 如图2所示,各给药组中胆固醇含量均显著低于空白溶剂组(<0.01),可见乳香、醋乳香、ADHBA和乳香+ADHBA均能够有效地降低肝脏细胞胆固醇水平。醋乳香组胆固醇含量较乳香组显著减少(<0.05),表明与乳香比较,醋乳香降低胆固醇效果更强。乳香+ADHBA组胆固醇含量较乳香组显著减少(<0.05),ADHBA对胆固醇的降低确有作用,提示其为醋乳香中降低胆固醇水平的关键成分之一。
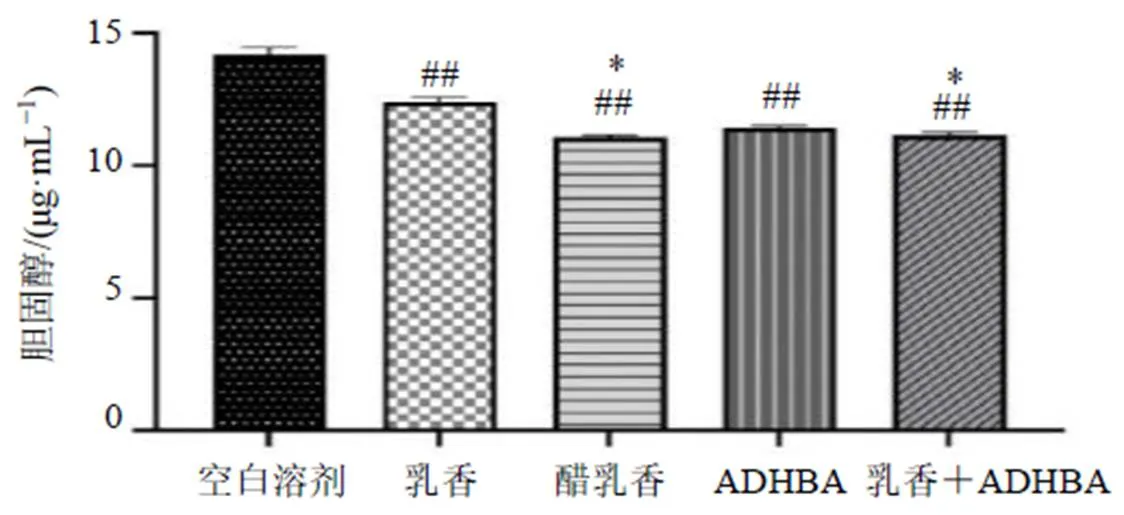
与空白溶剂组比较:#P<0.05 ##P<0.01;与乳香组比较:*P<0.05 **P<0.01,下图同
3.3 乳香醋炙前后及主要差异成分ADHBA对游离型初级胆汁酸合成酶CYP7A1、CYP8B1、CYP27A1和CYP7B1mRNA表达的影响
如图3所示,mRNA表达结果显示,与空白溶剂组相比,乳香、ADHBA组表达显著升高(<0.05、0.01),而醋乳香、乳香+ADHBA组表达显著降低(<0.05、0.01);与乳香组相比,醋乳香、乳香+ADHBA组表达均显著降低(<0.01)。mRNA表达结果显示,与空白溶剂组相比,ADHBA组表达显著升高(<0.05);与乳香组相比,醋乳香、ADHBA和乳香+ADHBA组表达均显著升高(<0.05、0.01)。mRNA表达结果显示,与空白溶剂组相比,乳香组表达显著降低(<0.05),ADHBA组表达显著升高(<0.05);与乳香组相比,ADHBA组表达显著升高(<0.05)。mRNA表达结果显示,与空白溶剂组相比,乳香、醋乳香、ADHBA和乳香+ADHBA组表达均显著升高(<0.05、0.01);与乳香组相比,醋乳香组表达显著升高(<0.05)。
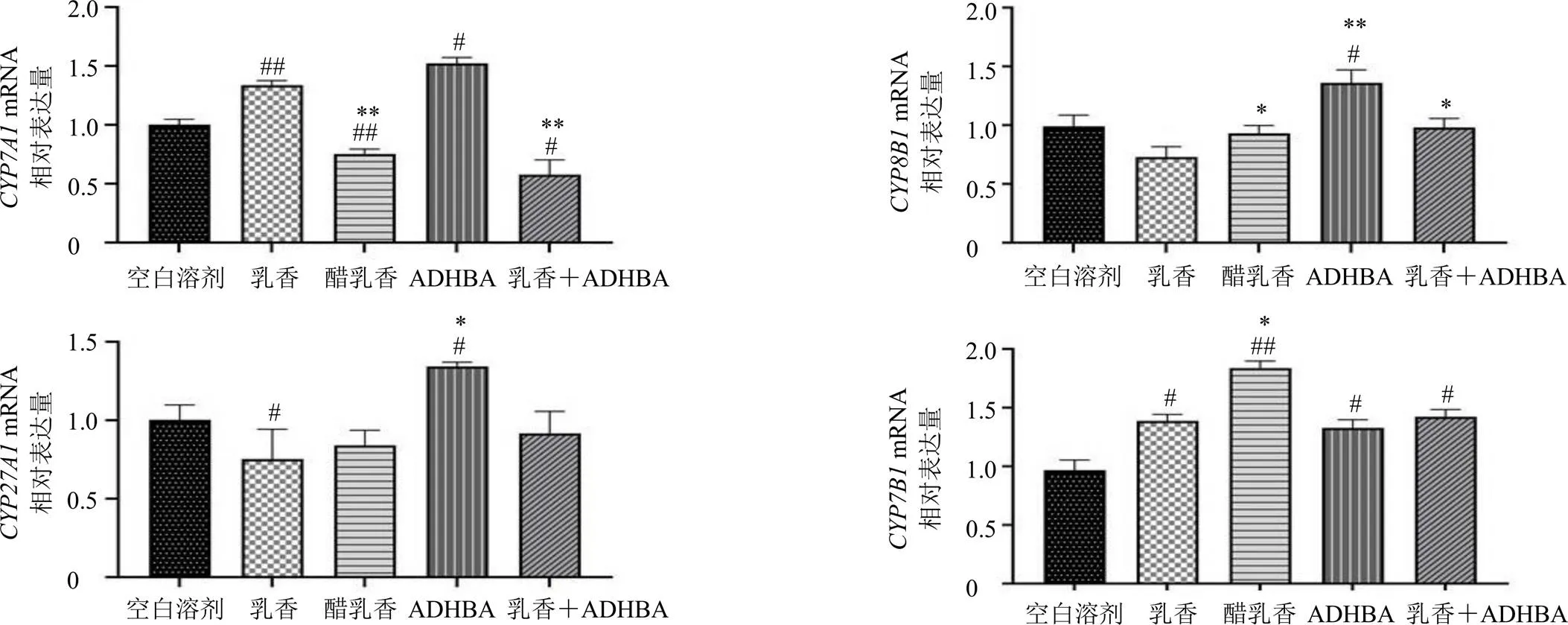
图3 乳香醋炙前后及主要差异成分ADHBA对游离型初级胆汁酸合成酶CYP7A1、CYP8B1、CYP27A1和CYP7B1 mRNA表达的影响(, n = 6)
3.4 乳香醋炙前后及主要差异成分ADHBA对结合型初级胆汁酸合成酶BACS、BAAT mRNA表达的影响
如图4所示,与空白溶剂组相比,乳香组、醋乳香、ADHBA、乳香+ADHBA组、mRNA表达水平均显著升高(<0.05、0.01);与乳香组相比,醋乳香组、乳香+ADHBA组、mRNA表达水平均显著升高(<0.05)。
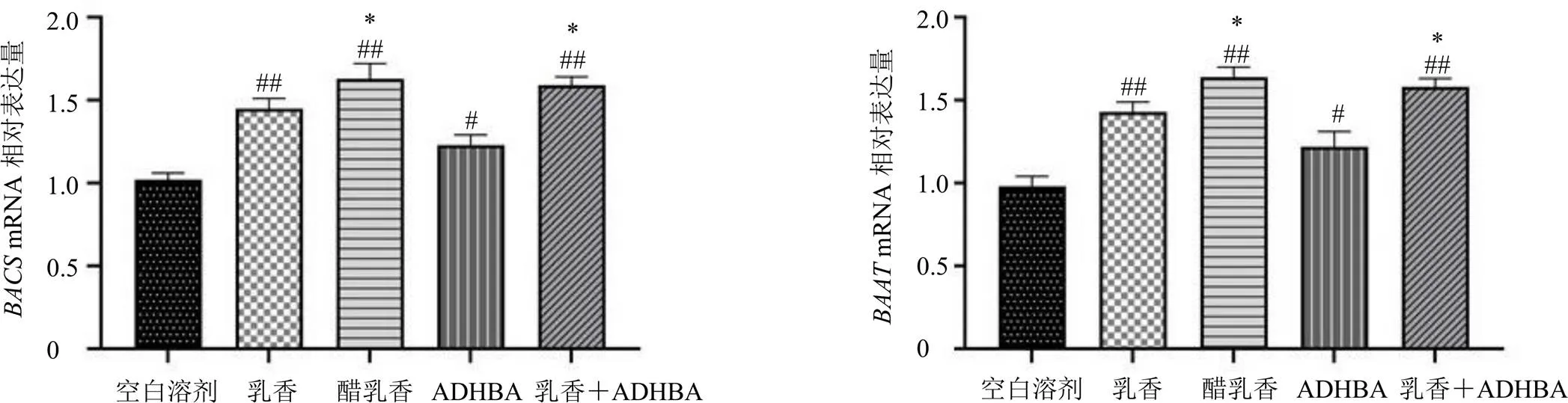
图4 乳香醋炙前后及主要差异成分ADHBA对结合型初级胆汁酸合成酶BACS、BAAT mRNA表达的影响(, n = 6)
4 讨论
尽管UC的发病机制尚不完全清楚,但随着代谢组学研究的深入,基于胆汁酸代谢角度对UC发病机制进行了探索。研究表明,相比于正常小鼠,UC小鼠肝脏中游离型初级胆汁酸和甘氨结合型初级胆汁酸含量呈上升趋势,而牛磺结合型初级胆汁酸含量呈下降趋势[22]。临床研究显示,与正常人群胆汁酸含量比较,UC患者血液中游离型胆汁酸、甘氨结合型胆汁酸含量显著升高,而牛磺结合型胆汁酸含量显著降低[17]。本研究结果表明,与正常大鼠相比,UC大鼠游离型初级胆汁酸CA和CDCA、甘氨结合型初级胆汁酸GCA和GCDCA含量显著升高,而牛磺结合型初级胆汁酸TCA和TCDCA含量显著降低,与文献报道一致[22]。给予乳香和醋乳香进行干预,发现乳香醋炙后,对UC大鼠血浆中的初级胆汁酸总量和游离型初级胆汁酸、结合型初级胆汁酸总量的回调水平更接近正常组。
中医药通过调节机体胆汁酸信号对UC表现出了良好的疗效,如白头翁汤可通过调控胆汁酸相关信号通路改善UC[23];干姜与炮姜干预UC的机制可能与胆汁酸合成及调节胆汁酸代谢的相关受体有关[24];补骨脂可以显著改善UC小鼠肠道病理状态和血清细胞因子水平,其机制可能与调节CYP7A1等胆汁酸合成信号通路有关[25]。肝脏是初级胆汁酸合成的主要部位,为探讨乳香醋炙前后及醋炙前后差异成分ADHBA对胆汁酸回调作用明显差异的原因,本研究采用L-02正常人体肝细胞,对比乳香醋炙前后及醋炙前后差异成分ADHBA对胆汁酸合成原料胆固醇以及游离型初级胆汁酸合成酶、、、mRNA和结合型初级胆汁酸合成酶、mRNA的干预作用。ADHBA是乳香醋炙后含量显著增加的主要差异成分,为了更好地阐明ADHBA对初级胆汁酸调控环节的作用,探究乳香醋炙增效机制,本研究设立乳香联合ADHBA干预组,使联合体系中ADHBA的含量同醋乳香相等,以明确乳香醋炙增效的物质基础。
本研究结果表明,乳香和醋乳香均具有降低胆汁酸合成原料胆固醇的作用,且醋炙后降低作用更强,主要差异成分ADHBA与乳香联合ADHBA的调控水平与醋乳香相似。胆汁酸主要通过2种途径在肝脏中合成,经典途径由CYP7A1催化胆固醇发生7α-羟基化作用,随后甾核进一步转化并由CYP8B1催化侧链发生氧化裂解,该途径产生的胆汁酸成分约占总胆汁酸的75%[18];替代途径由CYP27A1催化胆固醇27-羟基化,该反应经由CYP7B1进一步催化羟基化。经典途径中的CYP7A1是胆汁酸合成的限速酶,CYP8B1消耗或抑制可导致替代途径合成更多胆汁酸[26]。本研究结果显示,乳香及ADHBA对于mRNA表达显示出明显的促进作用,而对胆固醇表现出明显的降低作用,表明乳香及ADHBA可能主要通过促进CYP7A1的表达而加速了胆固醇的消耗,并表现为游离型初级胆汁酸的增多。乳香醋炙后对初级胆汁酸合成回调作用与抑制经典途径限速酶以及上调mRNA表达有关,乳香联合ADHBA组与醋乳香的调控作用一致。即使醋乳香对胆汁酸合成原料胆固醇水平下调的作用明显,但是研究表明,其对游离型初级胆汁酸合成的过程并没有提升,表明乳香醋炙后对于机体的脂质代谢也有一定的贡献,但是其调控机制还有待进一步深入研究。在肝细胞中,游离型初级胆汁酸通过BAAT和BACS的作用与甘氨酸和牛磺酸结合形成结合型初级胆汁酸[18],虽然乳香醋炙后对二者的上调作用更强,但是由于醋乳香对游离型初级胆汁酸合成经典途径限速酶CYP7A1的抑制,导致游离型初级胆汁酸的含量大大降低,使后续结合型初级胆汁酸合成的底物减少,因此,醋乳香干预后,机体结合型初级胆汁酸的总量大大降低。由此可见,游离型初级胆汁酸合成经典途径的限速酶CYP7A1对乳香醋炙前后在初级胆汁酸调控环节中起到了决定性作用,一方面它决定了游离型初级胆汁酸合成环节,另一方面,该过程的产物是结合型初级胆汁酸合成的底物,同时决定了结合型初级胆汁酸的合成。此外,在初级胆汁酸合成的各个环节中,乳香联合ADHBA组表现出与醋乳香相近的作用趋势,提示乳香醋炙前后主要差异成分ADHBA可能是发挥调节作用的关键成分之一。ADHBA在乳香醋炙后含量显著增加,且在细胞层面表现出良好的抗炎活性[9],但基于动物水平ADHBA改善UC的相关研究,仍有待深入探讨。
本研究从初级胆汁酸合成角度初步阐释了乳香醋炙对UC增效的作用机制。采用超高效液相色谱-质谱联用(UPLC-TQ-MS)技术,探究了乳香醋炙前后对UC大鼠血浆胆汁酸的扰动差异。进一步从胆固醇、游离型初级胆汁酸合成和结合型初级胆汁酸合成3个关键环节,初步阐释了乳香醋炙增效机理。UC不仅与初级胆汁酸关系密切,而且也受到次级胆汁酸的影响。次级胆汁酸是初级胆汁酸进入肠道后,在肠道菌群作用下经过脱羟基、络合反应等生成的胆汁酸。在人类研究和动物模型中,次级胆汁酸与肠道疾病和肝脏疾病也有密切的联系[27-28],关于乳香醋炙前后如何介导次级胆汁酸调节UC的作用机制,仍需要进一步的研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 沈洪. 溃疡性结肠炎: 中西医的过去、现在与未来 [M]. 南京: 东南大学出版社, 2012: 3.
[2] 沈洪, 唐志鹏, 唐旭东, 等. 消化系统常见病溃疡性结肠炎中医诊疗指南 (基层医生版) [J]. 中华中医药杂志, 2019, 34(9): 4155-4160.
[3] 周青, 吴本升, 商洪涛, 等. 具有研发前景的治疗炎症性肠病的中草药述评 [J]. 广州中医药大学学报, 2018, 35(4): 764-768.
[4] 中国药典 [S]. 一部. 2020: 233.
[5] 李继成, 余振喜, 杨丽嘉. 齿叶乳香树胶脂对慢性结肠炎的疗效 [J]. 国外医药 (植物药分册), 2002, 17(4): 167.
[6] Gupta I, Parihar A, Malhotra P,. Effects ofgum resin in patients with ulcerative colitis [J]., 1997, 2(1): 37-43.
[7] 龚千锋. 中药炮制学 [M]. 第4版. 北京: 中国中医药出版社, 2016: 208.
[8] 梁东蕊, 宋志前, 宁张弛, 等. 乳香与醋乳香对溃疡性结肠炎大鼠抗炎作用的对比研究 [J]. 世界科学技术—中医药现代化, 2020, 22(1): 101-107.
[9] Ning Z, Wang C, Liu Y,. Integrating strategies of herbal metabolomics, network pharmacology, and experiment validation to investigate frankincense processing effects [J]., 2018, 9: 1482.
[10] 宁张弛, 宋志前, 刘元艳, 等. 不同提取方式对醋乳香中主要乳香酸类成分含量及其抗炎活性的影响 [J]. 中国实验方剂学杂志, 2017, 23(22): 14-19.
[11] 宁张弛, 宋志前, 王淳, 等. 炮制温度和时间对醋乳香外观颜色及6种乳香酸含量的影响 [J]. 世界科学技术—中医药现代化, 2017, 19(3): 508-515.
[12] 董运茁, 张弋, 刘振丽, 等. 乳香醋炙前后13种乳香酸成分含量变化及活性比较研究[J]. 中草药, 2021, 52(23): 7128-7137.
[13] Ning Z, Liu Z, Song Z,. Application of a strategy based on metabolomics guided promoting blood circulation bioactivity compounds screening of vinegar [J]., 2017, 11(1): 38.
[14] Liang D R, Ning Z C, Song Z Q,. The effects of vinegar processing on the changes in the physical properties of frankincense related to the absorption of the main boswellic acids [J]., 2019, 24(19): 3453.
[15] Bennet J D. Ulcerative colitis: The result of an altered bacterial metabolism of bile acids or cholesterol [J]., 1986, 20(2): 125-132.
[16] Kühn T, Stepien M, López-Nogueroles M,. Prediagnostic plasma bile acid levels and colon cancer risk: A prospective study [J]., 2020, 112(5): 516-524.
[17] Gnewuch C, Liebisch G, Langmann T,. Serum bile acid profiling reflects enterohepatic detoxification state and intestinal barrier function in inflammatory bowel disease [J]., 2009, 15(25): 3134-3141.
[18] Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis [J]., 2018, 15(2): 111-128.
[19] Nandania J, Peddinti G, Pessia A,. Validation and automation of a high-throughput multi-targeted method for semi-quantification of endogenous metabolites from different biological matrices using tandem mass spectrometry [J]., 2018, 8(3): 44.
[20] Zimmer D. New US FDA draft guidance on bioanalytical method validation versus current FDA and EMA guidelines: Chromatographic methods and ISR [J]., 2014, 6(1): 13-19.
[21] 宁张弛. 基于乳香酸成分变化探索乳香醋炙抗炎活性增强的机理研究[D]. 北京: 中国中医科学院, 2019.
[22] 亓云鹏, 张天, 王仁萍, 等. 雷公藤红素对炎症性肠病小鼠血清中胆汁酸代谢谱的影响 [J]. 药学服务与研究, 2018, 18(6): 429-433.
[23] Hua Y L, Jia Y Q, Zhang X S,. Baitouweng Tang ameliorates DSS-induced ulcerative colitis through the regulation of the gut microbiota and bile acids via pathways involving FXR and TGR5 [J]., 2021, 137: 111320.
[24] 陈琛. 基于代谢组学方法的干姜和炮姜活性组分对溃疡性结肠炎干预作用的研究 [D]. 广州: 广东药科大学, 2020.
[25] 周植星. 补骨脂治疗溃疡性结肠炎活性物质筛选及机制研究 [D]. 沈阳: 沈阳药科大学, 2020.
[26] Jia W, Wei M, Rajani C,. Targeting the alternative bile acid synthetic pathway for metabolic diseases [J]., 2021, 12(5): 411-425.
[27] Sinha S R, Haileselassie Y, Nguyen L P,. Dysbiosis-induced secondary bile acid deficiency promotes intestinal inflammation [J]., 2020, 27(4): 659-670.
[28] Li M, Cai S Y, Boyer J L. Mechanisms of bile acid mediated inflammation in the liver [J]., 2017, 56: 45-53.
Study on efficiency enhancing mechanism of vinegar processedon ulcerative colitis via primary bile acids synthesis
PENG Shi-tao1, LIU Zhen-li1, WANG Chun1, ZHANG Lin-lin2, WAN Xiao-ying1,SONG Zhi-qian1, NING Zhang-chi1
1. Institute of Basic Theory, China Academy of Chinese Medical Sciences, Beijing 100700, China 2. Zhejiang Institute for Food and Drug Control, NMPA Key Laboratory of Quality Evaluation of Traditional Chinese Patent Medicine, Hangzhou 310052, China
To investigate the efficiency enhancing mechanism for ulcerative colitis (UC) of vinegar processed Ruxiang () from the aspect of primary bile acids synthesis.UPLC-TQ-MS was used to determine the contents of six primary bile acids in plasma of UC rats induced by 2,4,6-trinitrobenzenesulfonic acid (TNBS). At the cellular level, L-02 cell line was applied to compare the effects of, vinegar processedand the different components of 3-acetyl-9,11-dehydro-β-boswellic acid (ADHBA) on synthesis of primary bile acids. The content of bile acid synthesis precursor cholesterol was measured by ELISA. mRNA expressions of cholesterol 7α-hydroxylase (), sterol 12α-hydroxylase (), 27‑hydroxycholesterol (), oxysterol-7α-hydroxylase (), bile acyl-CoA synthetase () and bile acid-CoA: amino acid‑acyltransferase () were determined by qRT-PCR.Level of total amount of primary bile acids and free and conjugated primary bile acids in the plasma of UC rats fed with vinegar processedwas closer to that of normal rats., vinegar processedand ADHBA could reduce cholesterol level, but the effect of vinegar processedand ADHBA were more obvious. The inhibition of vinegar processedon the classical pathway of free primary bile acid synthesis CYP7A1, the up-regulation of CYP8B1, BACS and BAAT were higher than those of.combined with ADHBA exhibited the same effect with vinegar processed.The inhibition of rate-limiting enzyme CYP7A1 in the classical synthesis pathway plays a significant role on regulation of primary bile acid synthesis by vinegar processed, which resulted in the reduction of primary bile acid level in pathological state of UC. ADHBA is proved to be one of the material foundations of processing efficiency.
; vinegar processed; primary bile acids; ulcerative colitis; efficiency enhancing; CYP7A1; ADHBA
R285.5
A
0253 - 2670(2022)01 - 0107 - 10
10.7501/j.issn.0253-2670.2022.01.014
2021-07-23
国家自然科学基金资助项目(81873009);国家自然科学基金资助项目(82003950);中国中医科学院优秀青年科技人才(创新类)基金资助项目(ZZ14-YQ-035);中国中医科学院中医基础理论研究所中央级科研院所自主选题(YZ-202023,YZ-202045);中国中医科学院科技创新工程项目(CI2021A04201)
彭诗涛(1993—),女,在读博士生,研究方向为中药炮制原理研究。Tel: 18810820973 E-mail: pst082073@163.com
宁张弛,女,博士,助理研究员,主要从事中药药效物质基础与质量评价研究。Tel: (010)64089020 E-mail: yizhangyichi1573@sina.com
宋志前,男,副主任技师,主要从事中药药效物质基础和炮制原理研究。
[责任编辑 李亚楠]
