选择性多聚腺苷酸化及microRNAs对绵羊ACSL1基因表达的影响
2022-01-10张立春于永生马惠海
曹 阳 张立春 于永生 马惠海 刘 宇 曹 阳*
(1.吉林省农业科学院 动物生物技术研究所,吉林 公主岭 136100;2.浙江省农业科学院 畜牧兽医研究所,杭州 310021)
许多基因在转录过程中存在多个多聚腺苷酸化位点,从而形成不同长度的3′UTR现象,称为选择性多聚腺苷酸化(Alternative polyadenylation,APA)。APA在高等真核生物的转录中是一种普遍存在的现象,人类中50%以上、小鼠30%以上的基因存在APA现象,APA调控基因表达,从而调控该基因的特定生物学功能。基因不同长度的3′UTR 会调控蛋白表达,较短3′UTR的转录本会逃避可能与长3′UTR结合的microRNAs的抑制,并且不同长度的3′UTR转录本的亚细胞定位不同。研究表明,APA对转录活性的调控似乎是一种广泛机制,细胞外刺激同样能诱导APA现象的发生,因此,APA在调控基因稳定、翻译和转运过程中有重要作用,特别是3′UTR上与microRNAs结合的位点。MicroRNA是指长度为22个核苷酸的非编码单链RNA,通过基因3′UTR 上的结合位点调控基因表达,在细胞受到刺激和增殖过程中都会发生变化。MicroRNAs同样被证明是潜在脂肪形成的调节剂,通过与靶向基因结合调控基因表达,这一特征在脂肪细胞分化和脂滴的生成这些脂质代谢中有调节作用,miR-27a、miR-22、miR-335、miR-122和miR-155等microRNAs都被证明对脂肪的生成存在抑制作用。因此,APA和microRNAs在基因表达过程中的作用值得更深入研究。
ACSLs是酯酰CoA合成所必需的酶。它能够活化游离脂肪酸合成脂酰CoA将并引导到特定的代谢通路中。ACSL
1含有多个启动子,导致ACSL1
存在多个转录本,不同转录本在不同组织中具有不同的功能。许多microRNAs会通过与ACSL1
基因结合来影响脂肪沉积。有研究表明miR-205能通过靶向ACSL1
基因来调节肝癌细胞的脂代谢,破坏肝癌细胞的脂肪生成。Bta-miR-181a通过靶向ACSL
1基因促进牛乳腺上皮细胞中TAG的合成,从而调节牛乳脂肪的合成。在肉鸡腹部脂肪沉积的研究中发现miR-19b-3P能够靶向ACSL1
基因,使ACSL1
基因下调并促进脂肪细胞的增殖。因此,microRNAs对绵羊ACSL1
基因表达的影响同样值得探究。本研究通过对ACSL1
基因3′UTR克隆和双荧光素酶检测确定microRNAs对ACSL1
基因表达的影响,明确绵羊ACSL1
基因表达规律,以期为分析ACSL1
基因在绵羊脂肪代谢的作用提供理论依据。1 材料与方法
1.1 试验材料
试验所用绵羊前体脂肪细胞、293T细胞和脂肪组织储存于吉林省农业科学院动物生物技术研究所。
1.2 试验方法
1
.2
.1
cDNA末端快速扩增技术根据Genbank公布的ACSL1
基因序列信息(登录号:XM_015104562.2),依照RACE引物设计原则,使用Primer Premier 6.0设计引物SP1、SP2、SP3和SP4。使用 RACE试剂盒(Takara)进行扩增。1
.2
.2
RT-
PCR根据克隆测序所得的序列设计引物,检测不同长度的3′UTR在诱导分化过程中表达量的变化。引物序列如下表1所示。
表1 本研究中用到的引物信息
Table 1 Information of primers used in the study
引物名称Primername引物序列(5′-3′)Sequence(5′-3′)目的片段长度/bpProductsizeSP1CCTTGGCAGCCAGATAATTCASP2GGACAAGCAAACACCACGCTGA450SP3CTGGCACAAGGGGAGTACATAGCTCC750SP4TTCGGAATTATTTCAGGTCACAGATCGATG1570ACSL1-as-FACSL1-as-RCAGTGAAGCAAAGGGCAGAGGCGACAGATGGAGGAA160ACSL1-al-FACSL1-al-RAACTGTCCACTTTTCCTTTGGCATTTATTTATCACCATCC215
荧光定量PCR反应体系及条件:2×PCR Mix 10 μL,上下游引物各10 mmol/L,cDNA 1 μL,ddHO补齐至20 μL。95 ℃5 min,95 ℃ 10 s,60 ℃ 15 s,72 ℃ 20 s,从第二步开始40个循环。95 ℃ 5 s,65 ℃1 min,然后温度以5 ℃/s的速率从65 ℃增加到97 ℃,最后温度降到40 ℃。
1
.2
.3
载体构建microRNAs模拟物、抑制物购自上海吉玛制药技术有限公司。通过克隆得到不同长度的3′UTR,分别构建pmiR-GLO 载体,载体构建由上海吉玛制药技术有限公司完成。在ACSL1
基因3′UTR 1 264~1 271 bp处定点突变,突变序列由上海吉玛制药技术有限公司生物合成和测序,并连接到pmiR-GLO载体上。ACSL
1基因过表达载体构建:以绵羊前体脂肪组织为模版,RT-PCR扩增目的片段,与pbi-CMV3载体双酶切后(Bam
HI和Not
I),经T4连接酶(Transgen)连接,转化后挑取阳性克隆,PCR鉴定,送生工生物工程(上海)有限公司测序。1
.2
.4
双荧光素酶活性检测microRNAs模拟物与上述表达载体利用脂质体法分别共转染至293T细胞,细胞转染后24 h,收集细胞检测细胞内双荧光素酶活性(Promega)。去除旧培养基,PBS清洗2次,加入250 μL稀释好的1×Passive lysis buffer,置于水平摇床室温下晃动15 min,使细胞被动裂解。在管中加入100 μL Luciferase assay buffer Ⅱ,加入20 μL细胞裂解液,混合均匀后,检测萤火虫荧光素酶的活性。检测后,在原管中迅速加入100 μL Stop&GloReagent,混匀检测海肾荧光素酶活性。计算比值(萤火虫荧光素酶的活性RULs1/海肾荧光素酶活性RULs2)。
1
.2
.5
Western blot使用裂解缓冲液(RIPA,Thermo Scientific)收集细胞蛋白质,并使用增强型BCA蛋白质测定试剂盒(Beyotime)测定蛋白质质量浓度。蛋白质样品在95 ℃下变性10 min,在12%SDS-PAGE凝胶中分离,并在200 mA转膜(PVDF)90 min。将膜用TBST洗涤3次,然后在室温下用5%脱脂乳封闭2 h。加入一抗(兔抗,ACSL1,Bioss,货号:bs5022R,1∶1 000)在4 ℃下孵育过夜,并与相应的二抗(羊抗兔,anti-rabbit,CST,货号:14708,1∶2 000)在室温下孵育1.5 h。将膜用TBST洗涤3次,并通过ECL-Plus试剂盒(Beyotime)处理后拍照。
1
.2
.6
统计分析进行3次独立的生物学实验,并计算相应的平均值。所有数据均以平均值±标准误差的形式计算,所有统计分析进行t
检验。P
<0.05的差异为显著差异,P
<0.01为极显著差异。2 结果与分析
2.1 诱导分化不同时期ACSL1基因3′RACE扩增
通过3′RACE检测ACSL1
3′UTR在诱导分化不同时期的表达,并克隆3′UTR序列,发现ACSL1
基因存在2个不同长度的3′UTR,长度分别为1 579和748 bp(图1(a)),2个不同转录本具有相同的编码区。ACSL1
基因2个长度的3′UTR在不同诱导分化时期都有表达。比对不同长度的3′UTR的核苷酸序列,两者相差831 bp。带有不同长度的3′UTR的ACSL1
基因分别命名为ACSL1-
al和ACSL1-
as(图1(b))。
Lane M:DL2000 Plus DNA Marker; Lane 1、2、3:诱导分化0、4和8 d绵羊脂肪细胞引物SP4 3′RACE
qRT-PCR检测不同长度3′UTR表达变化,绵羊ACSL1
基因2个不同长度的3′UTR表达量变化与ACSL1
基因趋势相一致,随着绵羊前体脂肪细胞被诱导分化,在诱导分化第4天达到最高值(图2(a))。根据2种不同长度的3′UTR在诱导分化过程中表达量的比值发现在分化前期表达量比值下降(图2(b)),所以ACSL1-
as的3′UTR表达量比ACSL1-
al增长速度更快,这表明ACSL1-
as在诱导分化前期更活跃。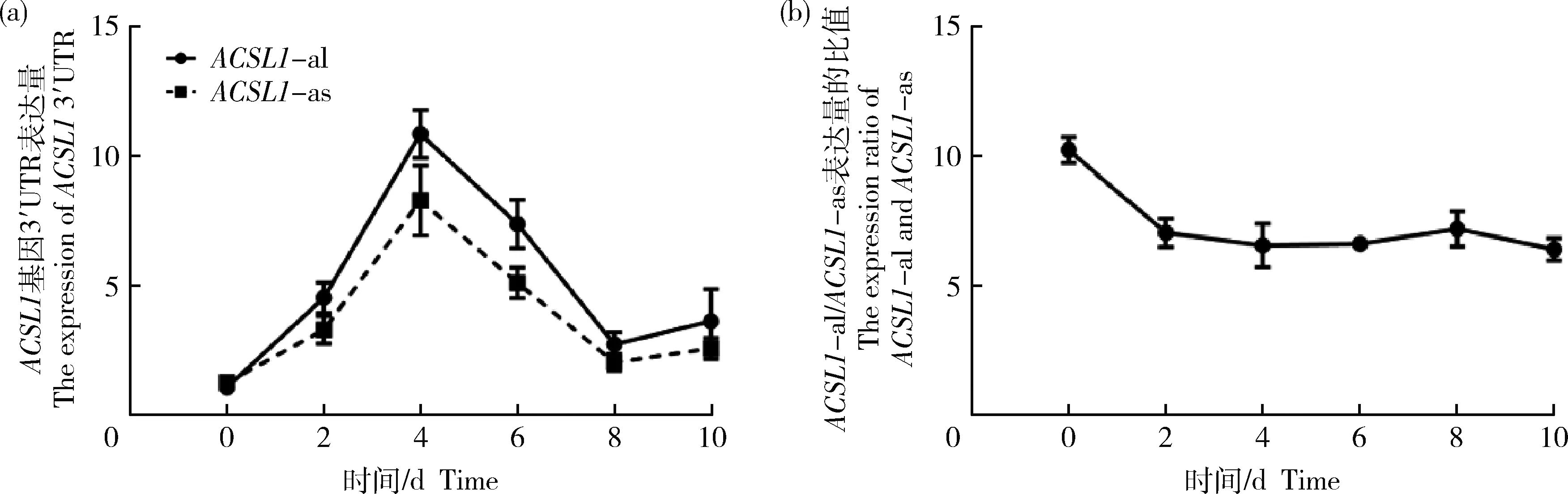
图2 诱导分化不同时期ACSL1不同3′UTR表达量(a)和ACSL1-al与ACSL1-as表达量比值(b)
2.2 ACSL1不同长度3′UTR对基因表达的影响
为确定不同长度的3′UTR对ACSL1蛋白表达的影响,将过表达ACSL1-
al和ACSL1-
as 3′UTR 的pmiR-GLO载体转染至293T细胞,24 h后检测双荧光素酶活性,结果显示与ACSL1-
al 3′UTR 相比,ACSL1-
as 3′UTR具有更高的荧光素酶活性(图3(a))。克隆不同长度3′UTR的ACSL1
基因,CDS区和3′UTR总长度分别为3 670和2 848 bp,并连接到pBI-CMV3载体中,转染载体至293T细胞中,Western blotting检测细胞内ACSL1蛋白的表达。结果显示,ACSL1-as蛋白表达量高于ACSL1-al(图3(b)和(c))。表明因APA所产生的短3′UTR与长3′UTR相比更有助于ACSL1蛋白的表达。
*表示差异极显著(P<0.05);**表示差异极显著(P<0.01)。下同。
2.3 诱导分化不同时期microRNAs表达量的检测
通过Targetscan预测ACSL1
3′UTR可能结合的microRNAs,挑选5个microRNAs进行验证(图4(a))。其中miR-202、miR-449a和miR-124a在ACSL1
-as 3′UTR、ACSL1
-al 3′UTR均存在结合位点,miR-218、miR-205只在ACSL1-
al 3′UTR存在结合位点。检测microRNAs在诱导分化过程中表达量的变化,miR-449a和miR-124a的表达量在诱导分化前期(0~4 d)下降,后期(4~8 d)明显上升,miR-218和miR-205表达量先下降后上升,与ACSL1
mRNA表达趋势相反(图4(b))。提示这些microRNAs可能与ACSL1
表达存在相关性。
图4 microRNAs与ACSL1 3′UTR预测结合位点(a)和诱导分化不同时期绵羊脂肪细胞内microRNAs表达量变化(b)
2.4 MicroRNAs对不同长度3′UTR和ACSL1表达的影响
为确定microRNAs对ACSL1
表达的影响,分别将miR-202 mimics、miR-449a mimics、miR-124a mimics、miR-218 mimics和miR-205 mimics与ACSL1-
al 3′UTR pmiR-GLO载体共转染至293T细胞中,检测双荧光素酶活性,结果显示共转染miR-202、miR-449a、miR-124a和miR-218后细胞内荧光素酶活性均显著降低,其中与miR-218共转染后活性降低极显著(图5(a))。然后将miR-202 mimics、miR-449a mimics、miR-124a mimics和ACSL1-
as 3′UTR pmiR-GLO载体共转染至293T细胞中,检测双荧光素酶活性结果显示共转染后重组体的荧光素酶活性显著降低(图5(b))。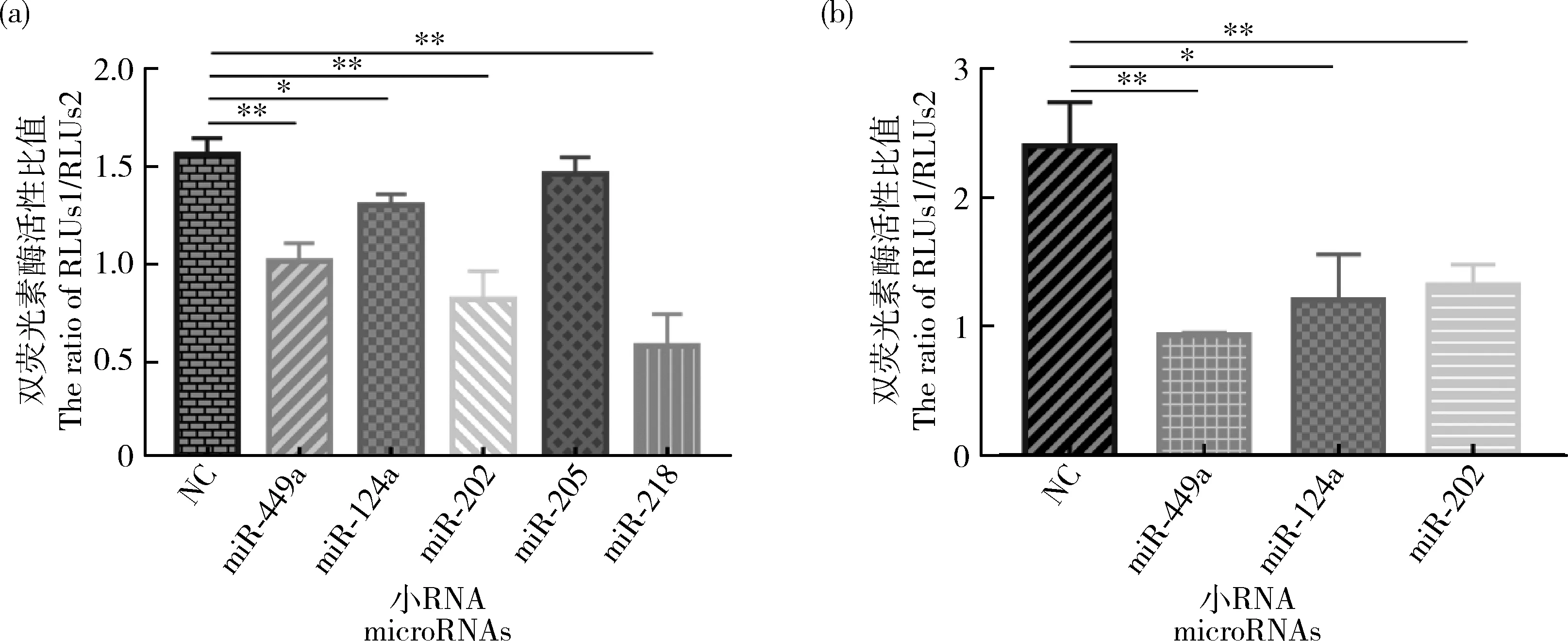
图5 MicroRNAs与ACSL1-al(a)、ACSL1-as(b)3′UTR共转染双荧光素酶活性检测
为了进一步确定miR-218是否是通过预测结合位点1 264~1 271 bp处与ACSL1
基因3′UTR结合,将ACSL1-
al 3′UTR表达载体中预测位点进行定点突变(图6(a)),然后将突变后的载体与miR-218 mimics共转染293T,突变后荧光素酶活性不再降低(图6(b)),与转染对照组荧光素酶活性几乎相同,表明miR-218是通过该位点与ACSL1
3′UTR结合。综上,结果显示,ACSL1
-as 3′UTR具有较高的荧光素酶活性,并且更有助于ACSL1
的表达,同时miR-202、miR-449a、miR-124a和miR-218能够与ACSL1
基因3′UTR结合,显著降低细胞内的荧光素酶活性。
图6 miR-218预测结合位点(a)和ACSL1-al 3′UTR MUT与miR-218共转染双荧光素酶活性检测(b)
为进一步确定在脂肪组织中miR-218对ACSL1
基因表达的影响,将miR-218 mimics和miR-218 inhibitor分别转染至绵羊前体脂肪细胞中,检测ACSL1 mRNA表达量和蛋白表达量。转染miR-218 mimics后绵羊ACSL1
mRNA表达量显著降低(图7(a)),蛋白表达量显著降低(图7(b)和(c))。转染miR-218 inhibitor后绵羊ACSL1
mRNA表达量显著升高,蛋白表达量显著升高。结果表明miR-218可通过3′UTR结合位点调节绵羊前体脂肪细胞中ACSL1表达量。
图7 miR-218对ACSL1 mRNA表达量的影响(a)和miR-218对ACSL1蛋白表达量的影响(b)及灰度值检测(c)
3 讨 论
APA普遍存在于真核生物中,并且能够调控基因表达,ACSL1
基因存在APA现象,有两个不同长度的3′UTR,长度分别为1 570和748 bp。检测ACSL1
3′UTR在诱导分化过程中表达量的变化,2种长度的3′UTR都是先上升后下降,与ACSL1
表达趋势相同,并且ACSL1-
al 3′UTR表达量明显高于ACSL1-
as,但是在诱导分化初期,ACSL1-
as 3′UTR的表达量上升速度显著高于ACSL1-
al,这表明在绵羊前体脂肪细胞分化过程中,可能与T细胞被激活一样,部分ACSL1
会切换成近端的ployA位点。研究表明,通过转录组分析脂肪干细胞脂肪生成,结果显示半衰期的变化与3′UTR的延长有关,更长的UTR稳定了主要的转录本。从而,这些延伸的长度可能与多核糖体结合能力的改变或半衰期有关。虽然从远端到近端和近端到远端的这类APA变化事件和剪接依赖性事件之间没有显著性差异,但有研究显示T淋巴细胞活化的过程中86%的基因增加了短3′UTR亚型的相对表达量,表明这类3′UTR缩短与细胞增殖存在重要联系。在双荧光素酶活性检测中,ACSL1-
as 3′UTR高于ACSL1-
al,并且连接不同长度3′UTR的ACSL1蛋白表达检测中发现带有短3′UTR的ACSL1蛋白表达量更高,说明短3′UTR更能促进ACSL1
基因表达并且在绵羊脂肪细胞诱导分化的初期更活跃。miR-202、miR-449a、miR-124a和miR-218均能显著降低ACSL1
3′UTR活性,并且miR-218降低极显著。在检测诱导分化不同时microRNAs表达量的变化中,miR-218的表达是先下降后上升,与ACSL1
表达趋势相符合,并且miR-218 的过表达可降低绵羊ACSL1
表达量。前期研究表明,绵羊ACSL1
基因过表达后脂肪细胞中甘油二酯含量和花生四烯酸含量显著增加,因此miR-218可能通过ACSL1
基因表达影响细胞内甘油二酯和花生四烯酸的含量,值得进一步探究。ACSL1
的APA现象已被证实在生物体中有特殊功能,有研究表明ACSL1
基因可能通过脂代谢调节结肠直肠癌,ACSL1
基因3′UTR多样性可能作为治愈后复发可能性的标志,基因型为TT的患者较带有一个C的患者更容易复发。这表明APA具有可以作为一种分子标记应用于各个领域的潜能。ACSL1
基因3′UTR被证明可与多个microRNAs结合。在小鼠的肝星状细胞中miR-34a能够与ACSL1
基因3′UTR结合,并靶向ACSL1
基因影响肝星状细胞激活并引起肝纤维化。miR-34a作为哺乳动物脂质代谢的转录调节因子,同样在家禽的肝脏脂代谢中具有调节作用,在产蛋高峰期的母鸡中,miR-34a-5p在肝脏中的表达明显高于产蛋早期母鸡,能够调节肝细胞内TAG和总胆固醇酯的合成。在甲状腺癌的研究中,SNHG7在甲状腺癌细胞系中的表达较高,SNHG7敲低后对ACSL1
基因有一定的抑制作用,研究发现SNHG7通过阻止miR-449a与ACSL1
基因结合来调控ACSL1
基因表达,进一步调控甲状腺癌细胞的增殖。因为ACSL1
基因的3′UTR较长,许多microRNAs都可能与ACSL1
基因3′UTR结合,影响ACSL1
基因表达。绵羊ACSL1
基因有2个不同长度的3′UTR,其中较长的3′UTR为1 570 bp,可能存在很多与microRNAs结合的位点,并且有研究表明,带有较长3′UTR的基因更稳定和不容易被激活。因此绵羊带有长3′UTR的ACSL1-
al这一转录本更稳定,在绵羊前体脂肪细胞诱导分化的过程中更难被激活。可以利用ACSL1
基因这一特性为其相关的脂代谢等疾病提供新的靶标,为绵羊育种提供新的分子标记。4 结 论
绵羊ACSL1
基因因APA存在2个不同长度的3′UTR,ACSL1
-as在绵羊前体脂肪细胞诱导分化前期更活跃,并且短3′UTR更有助于ACSL1蛋白表达。miR-218通过与ACSL1
3′UTR 的1 264~1 271 bp处结合显著降低ACSL1
基因表达。因此,APA和miR-218可调控绵羊ACSL1
表达,并可能通过ACSL1影响绵羊脂肪代谢。