太子参白绢病病原菌的分离鉴定及生防菌筛选
2022-01-07陈燕萍肖荣凤陈梅春郑雪芳朱育菁王阶平
陈燕萍,肖荣凤,金 国,陈梅春,郑雪芳,朱育菁,刘 波 ,王阶平
(1. 福建省农业科学院农业生物资源研究所,福建 福州 350003;2. 福建省宁德市柘荣县农业农村局,福建 柘荣 355300)
0 引言
【研究意义】太子参Pseudostellaria heterophylla为石竹科药食两用植物,具有健脾益肺等功效,是常用补虚药,也是很有发展潜力的经济作物,主产于我国福建、贵州、安徽等地[1-2]。随着太子参种植面积的不断扩大,其相应的连作障碍也日趋严重,太子参白绢病土传病害正在逐渐扩展蔓延。该病发病周期长,从太子参块根膨大期到收获、留种期,块根和茎基部均可发病,可造成20%以上的产量损失甚至绝收[3]。通过对太子参白绢病病原菌的鉴定及生防菌的筛选,可为该病的科学防控提供依据。【前人研究进展】关于太子参白绢病的报道主要集中在田间发病规律的调查,发病症状、病原菌形态及田间化学防治的研究[3-5]。现有的防控主要以农业防治和化学防治为主,但传统农业防治措施受限因素多、成本高,化学农药又存在农药残留、污染环境等问题,生物农药因其生物安全、毒副作用小、对环境友好等特点,备受人们青睐[6-7]。近几年,ITS、LSU、TEF-1α序列常被用于进行真菌鉴定,因其可较好地反映真菌的遗传多样性的特点,为病原菌的快速、准确鉴定提供便利。ITS作为内转录间隔区,LSU为核糖体大亚基序列,TEF-1α为翻译延伸因子序列,适合属及属下水平的分子分类研究[8-11]。【本研究切入点】仅依靠田间发病症状及病原菌形态特征难以对病原菌进行准确的分类鉴定,联合多基因分子鉴定对太子参白绢病病原菌进行全面系统的鉴定及筛选对该病原菌具有良好防治效果的生防菌,有待深入探讨。【拟解决的关键问题】笔者发现在福建省柘荣县太子参种植田块的白绢病病害严重,因此,对当地该病害进行了全面调查取样和病害诊断,对引起该病害的病原菌通过形态学、联合多基因分子鉴定和致病性测定进行病原菌鉴定,明确引起福建太子参白绢病的病原菌。筛选获得对该病原菌具有良好防治效果的生防菌,采用生物防治替代太子参种植过程的化学防治,解决中药的农药残留问题,为太子参白绢病的防控及太子参产业的健康发展提供依据。
1 材料与方法
1.1 病害采样与症状观察
在福建省柘荣县(119.89 E,27.25 N)太子参不同种植区,调查白绢病在苗期与商品参采收期的田间发生情况,记录病害典型症状,并采集代表性样品用于病原菌分离鉴定。
1.2 病原菌的分离与形态学鉴定
采用组织分离法对病原菌进行分离。采集不同时间的田间发病植株的根茎部和块根,取病健交界处切取大小为5 mm×3 mm,厚度为1 mm的病组织,分别切取 30~50 块病组织。病组织经75%酒精处理2~5 s,1%次氯酸钠处理5~8 min,无菌水清洗3遍后置于灭菌滤纸上吸干水分,将病组织置于含200 μg·mL-1硫酸链霉素的PDA培养基上,每皿放5片,28±2 ℃培养。从分离的培养物中随机挑选10个组织块上的分离物纯化培养,观察不同培养时期的菌落形态,并利用显微镜观察菌丝的形态,于-80 ℃甘油冷冻保存。
1.3 病原菌的分子鉴定
取培养7 d的菌丝体参照真菌基因组DNA提取试剂盒方法提取总DNA。利用rDNA-ITS、rDNALSU和TEF-1α等基因进行序列比对。引物和PCR反应体系如下[12-13]:ITS1/ITS4(ITS1:5′-TCCGTAGGT GAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATAT GC-3′),PCR反应体系(25 μL):12 μL 2× EasyTaqPCR SuperMix,引物各1 μmol·L-1,DNA模板1 μL,ddH2O 10 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。LROR/LR5(LROR:5′-ACCCGCTGAACTTAAGC-3′,LR5:5′-TCCTGAGGGAAACTTCG-3′),PCR反 应 体 系(25 μL):12 μL 2× EasyTaqPCR SuperMix,引 物各2.5 μmol·L-1,DNA模板2 μL,ddH2O 6 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延 伸10 min。ef595f/ef1160r(ef595f:5′-CGTGACTTCATCAAGAACATG-3′,ef1160r:5′-CCGATCTTGTAGACGTCCTG-3′),PCR反应体系(25 μL):12 μL 2× EasyTaqPCR SuperMix,引 物各1 μmol·L-1,DNA模板1 μL,ddH2O 10 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性40 s,56 ℃退火40 s,72 ℃延伸45 s,共32个循环;最后72 ℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳检测后,送交铂尚生物技术有限公司进行纯化测序。测得序列上传至GenBank数据库进行比对,并下载相关菌株的参比序列,采用软件MEGA 6.0,利用Maximum Composite Likelihood法构建系统发育树,bootstrap 1000次重复。
1.4 病原菌的致病性测定
随机挑取两株编号为FJAT-32609和FJAT-32610代表菌株,根据柯赫氏法则进行分离物的回接测定。将柘参2号种参播种于装有高压灭菌栽培基质土的盆钵中,置于20~25 ℃的温室大棚培育40~50 d,分别于太子参植株地上部株高约为10~15 cm时进行浇灌接种试验和收获期时进行块根接种试验。
根茎灌溉接种:将FJAT-32609和FJAT-32610菌扩大培养后分别配置成1.0×107CFU·mL-1的孢子悬浮液,采用伤根浇灌接菌法,每株浇灌50 mL菌液,以清水处理为对照,每组处理分别接种30株太子参苗,接种后的植株于28±2 ℃、相对湿度80%的光照培养箱中培养,逐日观察太子参苗的发病情况。根据柯赫氏法则重新分离各处理组的植株,并进行分离物的鉴定验证。
块根接种:新鲜块根用清水冲洗干净后,经75%酒精表面消毒后,置于超净台中吹干备用。在无菌操作下,用无菌枪头在块根中上部戳一个深约1 mm伤口,分别挑取少量FJAT-32609和FJAT-32610菌丝置于伤口中,以接无菌水为对照,每个处理接种50根。接种后块根置于铺有无菌湿润滤纸的培养皿中,上盖一层无菌湿润滤纸后置于温度28±2 ℃,湿度70%~80%的光照培养箱中培养,2 d后去除上层滤纸,接着培养,逐日观察侵染情况。根据柯赫氏法则重新分离各处理组样品,并对分离物进行鉴定。
1.5 生防芽胞杆菌的筛选
以太子参白绢病病原菌FJAT-32609为靶标菌,采用平板对峙法筛选有效的生防菌。在PDA平板中央接种生长5 d 的FJAT-32609菌饼,距离菌饼2.0 cm处,接种环蘸取芽胞杆菌发酵液进行划线,置于28 ℃培养6 d,观察菌落生长状况,重复3次,以无菌水为对照。根据抑菌带宽度测定抑菌率,抑菌率/%=[(对照组菌落直径-处理组菌落直径)/对照组菌落直径]×100。
2 结果与分析
2.1 病害采样与症状观察
太子参发病前期,植株地上部根部周围的土壤表面呈现白色菌丝,茎基部皮层腐烂,植株萎蔫,在潮湿环境下该病害尤为严重(图1-A)。发病中期根块及土表密生大量白色绢状菌丝,菌丝体呈辐射状扩展,环绕整个块根(图1-B),发病后期在块根或土壤表层形成菌核,菌核初为白色、渐变为米黄色至棕褐色,最终块根完全腐烂(图1-C、D)。

图1 太子参白绢病田间发病症状Fig. 1 Disease symptoms of southern blight on P. heterophylla in the field
2.2 病原菌的分离与形态学鉴定
经单孢分离,挑取有代表性的10个菌株进行-80 ℃冷冻保存。所分离的菌株在PDA培养基上28 ℃下培养3 d时,菌落呈圆形,菌丝为白色羽毛状,生长速度快,向周围呈辐射状扩展,菌丝疏松或集结成线形紧贴于培养表面(图2-A);培养5~6 d后,菌落表面开始出现白色菌核,老熟后变成黄色至褐色,菌核为球形或不规则形,表面光滑有光泽,直径为0.5~1.0 mm(图2-B);菌落背面呈淡浅黄色,菌丝呈线形辐射状分布(图2-C);显微镜下观察发现菌丝无色,棍棒状,有明显隔膜和分枝,未见孢子(图2-D)。根据形态特征初步鉴定该病原菌为罗耳阿太菌Athelia rolfsii。

图2 太子参白绢病病原菌的形态特征Fig. 2 Morphology of southern blight pathogen
2.3 病原菌的分子鉴定
两株供试菌株FJAT-32609和FJAT-32610的rDNA-ITS、rDNA-LSU、TEF-1α基因序列与GenBank数据库进行BLAST同源性比对,均与罗耳阿太菌A.rolfsii相似度达99%以上,并通过MEGA 6.0构建系统发育树进行分析。ITS序列聚类结果显示,供试菌株 与A. rolfsii(登 录 号 分 别 为AB075288.1、MN380242.1、KY446385.1)处于系统发育树的同一分支,置信度为100%(图3-A);LSU序列聚类结果显示,供试菌株与A. rolfsii(登录号分别为MT012705.1、AY635773.1、MT225781.1)处于系统发育树的同一分支,置信度为99%(图3-B);TEF-1α序列聚类结果显示,供试菌株与A. rolfsii(登录号分别为JF267815.1、JN790645.1、MT509439.1)处于系统发育树的同一分支,置信度为98%(图3-C)。因此,基于ITS、LSU和TEF-1α序列的系统发育树分析,FJAT-32609和FJAT-32610均与罗耳阿太菌具极高的置信度,故将该病原菌鉴定为罗耳阿太菌A.rolfsii。
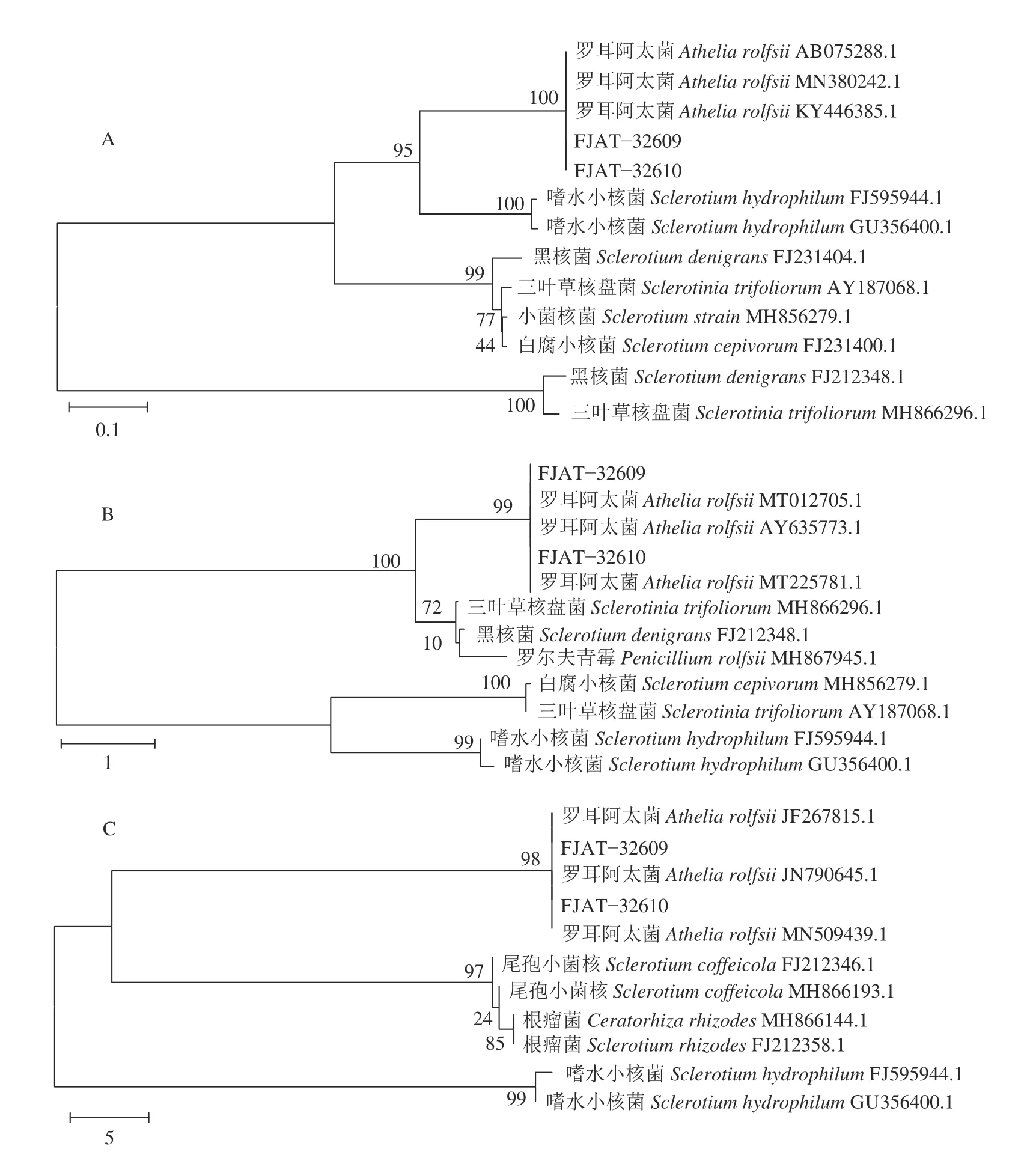
图3 病原菌系统发育分析Fig. 3 Phylogenetic trees of pathogen
2.4 病原菌的致病性测定
将白绢病病原菌FJAT-32609和FJAT-31610分别接种太子参幼苗后6 d,植株根部及土壤表面出现白色绢状菌丝(图4-A),茎基部表皮呈现水渍状褐变,后逐渐腐烂、断裂(图4-B),地上部分叶片出现轻微萎蔫,随着病情发展,病株萎蔫加重至整株死亡(图4-C)。重新分离回接的样品,获得的纯培养物经鉴定与所接种供试菌株一致。

图4 接种太子参白绢病病原菌后太子参植株的发病症状Fig. 4 Disease symptoms on P. heterophylla plants artificially inoculated with isolated pathogen
太子参白绢病病原菌FJAT-31609和FJAT-31610分别接种太子参新鲜块根后第7 天时,块根表皮会有白色放射状菌丝出现(图5-A),块根参头部内部开始出现腐烂(图5-B);随后块根表面白色绢丝状菌丝不断蔓延包裹参块,并集结形成白色菌核(图5-C、E),参内部腐烂面积逐渐扩大,组织不断消解(图5-D、F);发病后期块根表面菌核由白色变为褐色(图5-G),参内部组织也逐渐消解至剩下表皮(图5-H)。两株菌株的发病率均为100%,且发病症状与田间症状相似,无菌水对照组不发病(图5-I、J)。同上,重新分离回接的样品并鉴定,致病性测定结果符合柯赫氏法则,证实了供试的两株罗耳阿太菌菌株为太子参白绢病的病原菌。

图5 菌株FJAT-32609和FJAT-31609接种太子参块根后,不同时间的发病症状Fig. 5 Disease symptoms on tubers of P. heterophylla plants artificially inoculated with isolated pathogen
2.5 生防芽胞杆菌的筛选
以太子参白绢病病原菌为靶标菌,采用平板对峙法对实验室已有的6株芽胞杆菌进行抑菌活性筛选,筛选获得具有明显抑菌活性的生防菌4株(表1),其中贝莱斯芽胞杆菌FJAT-17931的抑菌率最高,为73.23%,其次为暹罗芽胞杆菌FJAT-52595,抑菌率为71.16%。因此,后续可选用这两株芽胞杆菌为太子参白绢病生防菌,进一步展开相关研究。
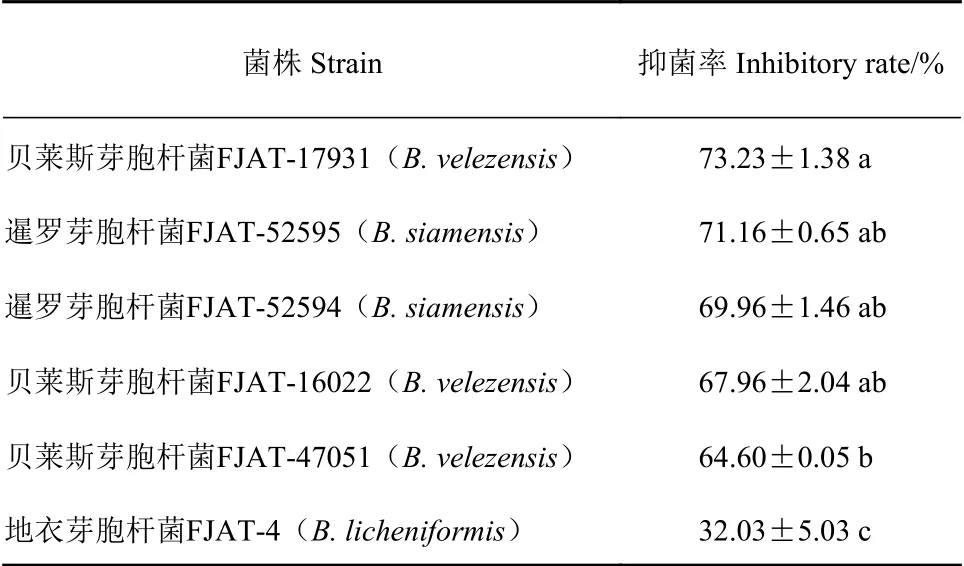
表1 不同芽胞杆菌对太子参白绢病病原菌的抑菌率Table 1 Inhibition rates of Bacillus spp. on A. rolfsii
3 讨论与结论
白绢病是一种寄主范围广、毁灭性强的真菌病害,可危害100多科中的200多种植物。以茄科、豆科、葫芦科等植物尤甚。我国传统药用植物受白绢病危害者也很多,如白术、铁皮石斛、玄参 、太子参等[3,14-16]。前人研究报道太子参白绢病病原菌为小菌核菌属SclerotiumTodeexFr.齐整小核菌Sclerotium rolfsiiSacc.,该名为其无性世代名称,其另一有性世代名为罗耳阿太菌,两者同物异名[17]。本研究通过太子参田间发病症状、病原菌形态特性及联合ITS、LSU、LEF-1α多基因分子鉴定表明,福建柘荣太子参白绢病病原菌为罗耳阿太菌(A. rolfsii),与前人研究报道一致[18]。因不同的菌株间存在高度的多样性,为避免单一基因序列测定产生的误差,本研究联合3种基因序列进行分子鉴定。这3种基因序列应用于白绢病原菌的分子鉴定上均已有报道:如半夏、槟榔和金钱树等白绢病原菌的鉴定报道中,均以ITS序列进行鉴定[19-21];在柳叶白前和菊花白绢病原菌鉴定报道中,以ITS和TEF-1α联合进行鉴定[13,22];同时,见Xu等用LSU序列进行8种植物病原菌菌核(包括Athelia属)的系统发育分析研究,证实其具有很好的特异性[23]。
白绢病主要危害太子参的块根与茎基部,温暖潮湿的4~7月为发病高峰期。该病原菌适应性强,当环境不利于菌丝生长时会生成菌核渡过,便于长期在土壤中存活,条件成熟时引起太子参发病[18]。因此,及时清除病株,冬季翻田清园,选用无病种参,开展种参消毒等防控措施很重要[4]。目前对于太子参白绢病的防治主要以化学防治为主,常用有多菌灵、恶霉灵、吡唑嘧菌脂悬浮剂等,生物防治报道仅见刘思睿筛选的钩状木霉Trichoderma hamatum对其病原菌具良好抑菌作用[24],其他作物的白绢病生防报道亦甚少,已报道的生防菌均以木霉菌和芽胞杆菌为主[25-26]。本研究筛选获得贝莱斯芽胞杆菌对太子参白绢病病原菌抑菌率为73.23%,在太子参白绢病上有强大生防应用潜能,关于该菌的拮抗机理、室内及大田防效等还有待进一步研究。
