羊乳对小鼠肠道微生物的影响
2022-01-06尹丹韩赵奇琦王红青方陈玉李高天胡弘宇陆晶芳肖海龙
尹丹韩,赵奇琦,王红青,方陈玉,林 捷,李高天,胡弘宇,陆晶芳,肖海龙
(1.杭州市食品药品检验研究院,浙江 杭州 310022;2.浙江省市场监管乳及乳制品监管技术重点实验室(培育),浙江 杭州 310022)
肠道微生物是寄居在人类肠道内微生物群落的总称,它们作为动物的“第二基因组”与肠道环境共同构成了一个巨大而复杂的生态系统[1]。小鼠和人类有着相似的肠道微生物组成,主要包括厚壁菌门、拟杆菌门、放线菌门和变形菌门等[2]。肠道微生物相当于一个器官,在代谢、免疫、内分泌过程中扮演着重要的角色,并与机体的其他器官相互作用[3-7]。大量研究表明肠道微生物与代谢性疾病、免疫系统疾病、消化系统疾病、心血管疾病、中枢神经系统疾病和癌症等具有一定的相关性[8-11]。
由于外界的环境影响和宿主自身状况的变化,肠道微生物组成时刻发生变化。有学者认为膳食中的蛋白质、脂肪、糖类成分能影响肠道核心优势菌群结构和代谢[12-13]。Qi等[14]用不同种类的蛋白质作为唯一的膳食蛋白配制日粮饲喂SD大鼠,发现不同种类的蛋白对大鼠肠道内容物中的菌群结构有显著影响。随着人们对健康关注度的不断提升,蛋白质、氨基酸类产品的消耗量也在日益上升[15-16]。由于富含丰富蛋白质、乳糖、脂肪和多种维生素,羊乳广受老百姓的喜爱,食用羊乳被认为有很多潜在的健康益处,包括防止感染、促进肠道上皮细胞增殖、改善胃肠道疾病、提高骨密度和血液中维生素A、Ca、烟酸、硫胺素和核黄素水平[17-18]。虽然目前已经有不少关于羊乳营养物质及其生物活性方面的研究,但对食用羊乳对肠道微生物影响的研究还很少。笔者以小鼠为研究对象,通过高通量测序技术探究摄入羊乳后小鼠肠道微生物群落结构及多样性的变化,为羊乳对宿主代谢的影响研究提供依据。
1 实验材料与方法
1.1 实验动物及分组
实验动物为36只6周龄SPF级ICR小鼠(动物生产许可证号:SCXK(浙)2014-0001),雌雄各半,体重均为19~20 g,购自浙江省实验动物中心。将36只小鼠随机分成3组,每组3个重复,每个重复4只小鼠。3组分别为对照组A(A1,A2,A3),试验组B(B1,B2,B3)和试验组C(C1,C2,C3),每组12只,雌雄各半。对照组A采用基础饲料和蒸馏水喂养,试验组采用的饲料与对照A组相同,试验组在蒸馏水中加入液态羊乳(蛋白质量浓度为3 g/mL),试验组B,C中羊乳加入的体积分数分别为30%,60%。喂养周期为20周。
Co60辐照试验颗粒鼠粮(舒克贝塔1010009),购自江苏省协同医药生物工程有限责任公司;羊乳,购自本地羊乳生产企业;所有器具、饲料均经过灭菌处理;饲养环境为昼夜12 h交替;室内温度为22~25 ℃;湿度为55%~65%;实验期间小鼠自由采食、进水;保持垫料干燥。实验中所有操作严格按照GB 14923—2010《实验动物管理条例》执行。
1.2 试剂与仪器
1.2.1 试 剂
Stool Genomic DNA kit粪便基因组DNA提取试剂盒,北京康为世纪生物科技有限公司;引物16S rRNA基因V3-V4区特异性引物341F/806R,上海生工生物公司;高保真酶ExTaq Master Mix,TaKaRa公司;GeneJET Gel Extraction Kit,Thermo Scientific公司;琼脂糖粉末,北京沃比森科技公司;建库与上机测序所用试剂MiSeq PE300测序平台配套试剂盒,Illumina公司。
1.2.2 仪 器
微量移液器,Eppendorf公司;生化培养箱,Binder公司;厌氧工作站,Ruskinn公司;普通PCR仪,Bio-rad公司;电泳仪,Bio-rad公司;液氮罐,Thermo公司;凝胶成像仪,Bio-rad公司;Nano Drop 2000c,Thermo Scientific公司;HiSeqTM 2500测序平台,Illumina公司。
1.3 样本采集
于第20周采集小鼠直肠部位粪便,同一重复的4只小鼠粪便混合均匀后置于无菌离心管中,做上标记,共9个样本。样本采集完后立即测试分析,无法立即测试分析的样本迅速置于液氮中,于-80 ℃保存备用。
1.4 小鼠肠道高通量测序分析
取0.2 g粪便或肠道内容物样品,采用粪便基因组DNA提取试剂盒提取小鼠肠道微生物的基因组DNA,提取方法按说明书操作,DNA浓度用Nanodrop仪器检测。16S rDNA分析选取相对保守的V3-V4区域,对V3-V4区进行PCR扩增,扩增产物用1.5%琼脂糖凝胶电泳检测后割胶回收并纯化,然后用BioTek酶标仪对样本进行定量。添加标记后采用Illumina MiSeq平台进行测序,测序碱基准确率为99%,且不容许有模糊碱基。将高通量测序结果运用Qiime,Pear软件进行拼接、过滤,去除嵌合体,得到有效序列。
1.5 数据分析
利用Uparse软件对所有样品的全部有效标签进行聚类,默认以97%的一致性(Identity)将序列聚类成为操作分类单元(OTU)。筛选OTU中出现频次最高的序列作为OTU的代表序列。对OTU代表序列进行物种注释,用Uclust方法与Silva数据库(http://www.arb-silva.de)进行物种注释分析(设定阈值为0.8~1.0)。使用Qiime软件计算各指数,其中Chao 1指数反映菌群丰度(Community richness),Shannon指数反映菌群多样性(Community diversity),Goods-coverage指数(测序深度指数)反映测序深度。使用R软件对肠道菌群丰富度和多样性进行Tukey检验与分析,绘制无度量多维标定法(Non-metric multi-dimensional scaling,NMDS)分析图。使用LEfSe软件(Linear discriminant analysis effect size,线性判别分析)进行组间差异性分析。
2 实验结果和讨论
2.1 小鼠肠道菌群测序结果
对9份小鼠粪样进行测序,质控后获得有效序列416 491条,对所有样品的有效序列进行聚类,以97%的一致性将序列聚类成为OTU。序列共聚类成2 811个OTU,平均每个样本312个OTU。9个样本的测序深度指数均超过99.75%,表示样品中99.75%以上的序列均被测出,测序结果及alpha多样性分析如表1所示,测序结果代表了样品中微生物的真实情况。
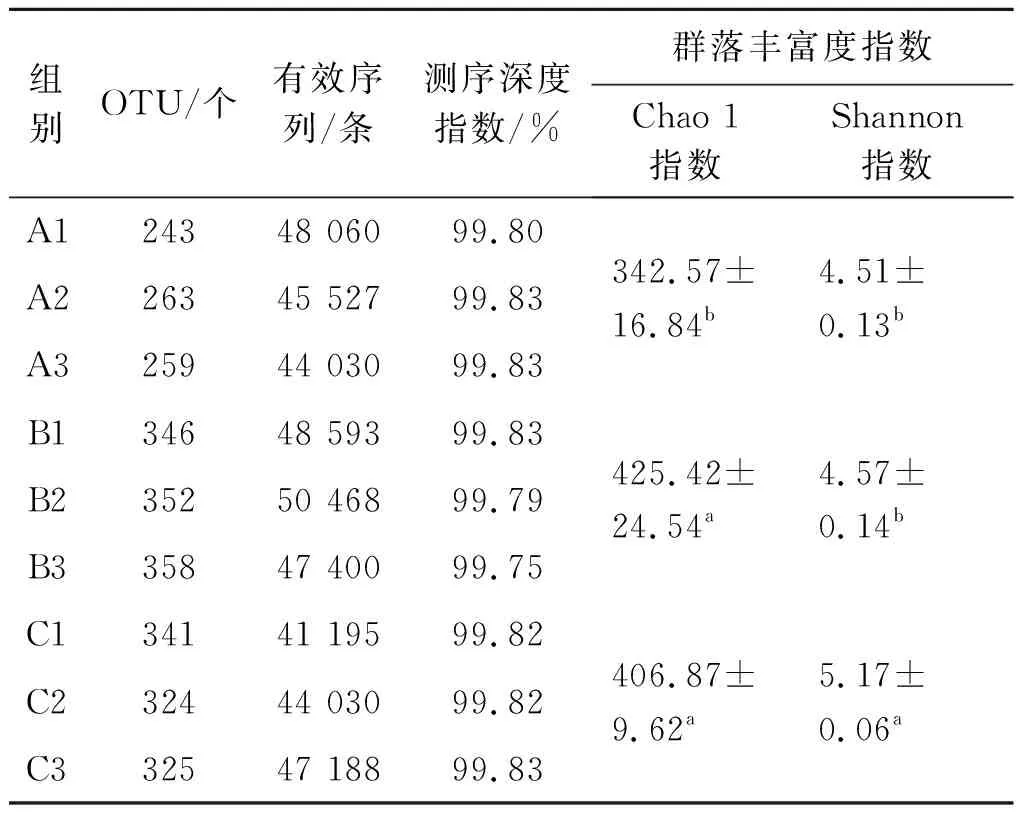
表1 测序结果及alpha多样性分析
2.2 小鼠肠道微生物群落性alpha多样性分析
为了研究对照组A与试验组B,C小鼠肠道微生物群落的丰富度和多样性,对各组别alpha多样性指数进行了计算和Tukey检验(表1)。由表1可知:Chao 1指数在对照组A与试验组B,对照组A与试验组C之间均存在显著差异,在试验组B,C之间差异不明显,试验组的微生物群落丰富度均显著高于对照组;Shannon指数在对照组A与试验组B之间均无显著差异,在对照组A与试验组C之间存在显著差异,在试验组B,C之间存在显著差异,试验组C的微生物群落多样性显著高于对照组A与试验组B,对照组A与试验组B之间的微生物群落多样性无明显差异。
2.3 小鼠肠道微生物群落NMDS分析
为了考察试验组B,C和对照组A之间小鼠肠道微生物群落组成的差异,从OTU水平进行NMDS分析(Non-metric multidimensional scaling,非度量多维尺度分析),用胁强系数(Stress)来衡量NMDS分析结果的优劣,判断该图形是否能准确反映数据排序的真实分布。笔者得到的Stress=0.01<0.05,说明结果具有很好的代表性。不同组别样品的NMDS分析如图1所示,由图1可知:试验组B,C和对照组A能明显区分开,试验组B,C间的距离相对较近,试验组C和对照组A间的距离明显大于试验组B和对照组A间的距离。因此,与对照组相比,羊乳的添加改变了试验组小鼠肠道微生物的结构,高剂量组的改变比低剂量组明显。
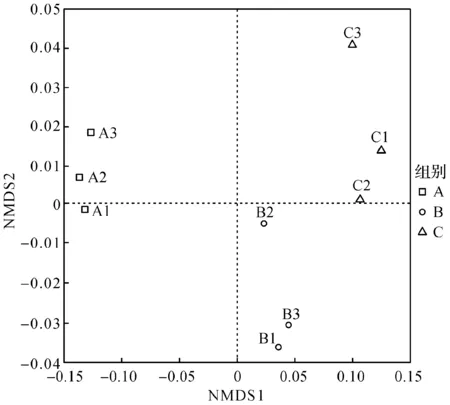
图1 不同组别样品的NMDS分析Fig.1 NMDS analysis on different groups of sample
2.3 羊乳对小鼠肠道微生物群落结构的影响
2.3.1 门水平上小鼠肠道微生物相对丰度
依据物种注释结果,选取每组样品在门分类水平上最大丰度排名前5位的物种,以柱型图展示对小鼠肠道微生物组成的分析结果,门水平上不同组别小鼠肠道微生物群落结构相对丰度比较如表2所示。在门分类水平上最大丰度排名前5位的物种包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)和Saccharibacteria菌门。各组样品优势菌均由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)组成,三者丰度和大于95%。

表2 门水平上不同组别小鼠肠道微生物 群落结构相对丰度
2.3.2 属水平上小鼠肠道微生物相对丰度
依据物种注释结果,选取每组样品在门分类水平上最大丰度排名前15位的物种,以柱型图展示对小鼠肠道微生物组成的分析结果,属水平上不同组别小鼠肠道微生物群落结构相对丰度比较如表3所示。对照组A小鼠肠道微生物群落中平均丰度大于1%的有10个属,分别为乳酸菌属(Lactobacillus)、毛螺菌科NK4A136组(Lachnospiraceae_NK4A136_group)、脱硫弧菌属(Desulfovibrio)、拟杆菌属(Bacteroides),另枝菌属(Alistipes)、梭状芽胞杆菌属(Clostridium_sensu_stricto_1)、普雷沃氏菌属(Prevotella_9)、劳特氏菌属(Blautia)、瘤胃球菌属(Ruminococcaceae_UCG-014)和Allobaculum菌属。试验组小鼠肠道微生物群落中平均丰度大于1%的有12个属,两组的优势菌种类一致,分别为Lactobacillus,Lachnospiraceae_NK4A136_group,Desulfovibrio,Bacteroides,Alistipes,Clostridium_sensu_stricto_1,Prevotella_9,Blautia,Allobaculum,Alloprevotella,Ruminococcaceae_UCG-014和Faecalibacterium属。
2.3.3 组间肠道微生物群落差异性分析
利用LEfSe分析(Linear discriminant analysis effect size)研究试验组和对照组小鼠肠道微生物群落的组间差异性。LEfSe是一种发现和解释高纬度数据生物标识(分类单元、通路和基因)的分析工具,可以实现2个或者多个分组之间的比较,同时也可进行分组内部亚组之间的比较,从而找到组间在丰度上有显著差异的物种(即Biomaker)。该分析首先使用非参数Kruskal-Wallis秩和检测不同分组间丰度差异显著的物种,然后使用Wilcoxon秩和检验上一步的差异物种在不同组间子分组中的差异一致性,最后采用LDA分析(Linear discriminant analysis)对每个组分(物种)丰度对差异效果影响力(LDA分值)进行估算。LDA值分布柱状图中展示了不同组中丰度差异显著的物种,不同颜色代表不同分组,柱状图的长度代表差异物种的贡献度大小(LDA score),笔者设定筛选参数为P<0.05,LDA>4,小鼠肠道微生物群落的LEfSe分析如图2所示。与对照组A相比,试验组B小鼠肠道微生物群落的Bacteroidetes,Alloprevotella,Lactobacillus和Prevotella_9的相对丰度较高,Firmicutes,Proteobacteria,Bacteroides,Alistipes和Desulfovibrio的相对丰度较低,它们均具有统计学意义;与对照组A相比,试验组C小鼠肠道微生物群落的Bacteroidetes,Alloprevotella,Lactobacillus,Prevotella_9和Faecalibacterium的相对丰度较高,Firmicutes,Proteobacteria,Bacteroides,Alistipes,Desulfovibrio,Allobaculum和Streptococcus的相对丰度较低,它们均具有统计学意义。

图2 小鼠肠道微生物群落的LEf S e分析Fig.2 LEfSe analysis of intestinal microbial community in mice
由图2可知:所有样本中Firmicutes和Bacteroidetes都是最主要的两大门类,该结论与其他文献的报道一致[19]。有研究发现:Bacteroidetes是肠道内糖和脂肪代谢的重要参与者[20],通过降低Firmicutes和Bacteroidetes的丰度比值,能有效预防轻度炎症的发生,同时降低肥胖风险,对宿主的健康有利[21-22]。与对照组相比,试验组Bacteroidetes的相对丰度显著提高,Firmicutes的相对丰度显著下降,因此Firmicutes和Bacteroidetes的丰度比值显著降低。研究结果表明摄入羊乳可增加小鼠肠道内脂肪和糖的代谢能力。
有文献报道,在对高脂饮食大鼠脂质代谢的研究中发现:Alloprevotella是短链脂肪酸的产生菌,在脂质代谢的调节中发挥关键作用,与非酒精性脂肪酸性肝病、脂质积累、脂质代谢紊乱呈负相关[23]。因此,推测摄入羊乳可能对抗高脂血症和降低脂质代谢紊乱的风险有一定的作用。Lactobacillus是一种公认的肠道益生菌,能抑制病原菌在肠道内的定植,并可以产生保护性营养物质以防止其他菌的迁移,起到稳定肠道菌群的作用[24]。Faecalibacterium和Prevotella_9菌属可以通过发酵膳食纤维合成短链脂肪酸产丙酸、丁酸,促进肠道合成黏蛋白,修复肠道黏膜,维持肠道微平衡,促进胰岛素响应[25]。Bacteroides中某些种被认为可能会影响人类和啮齿类动物的神经炎症信号及大脑功能[26]。Streptococcus菌大部分属于条件致病菌,被认为对宿主有害。在已知的研究中,除了部分细菌有相关功能报道,很多细菌功能仍然不明确。
3 结 论
基于高通量测序技术进行了微生物多样性分析,比较了对照组A、试验组B,C的微生物群落。alpha多样性分析显示对照组A的微生物多样性显著低于试验组B,C;肠道菌群NMDS分析结果表明:试验组的肠道菌群结构产生了变化,摄入羊乳对小鼠的肠道菌群产生了影响,摄入剂量不同,变化会有一些细微差异。摄入羊乳的小鼠肠道中Bacteroidetes,Alloprevotella,Lactobacillus,Prevotella_9和Faecalibacterium的相对丰度显著提高,Firmicutes,Proteobacteria,Bacteroides,Alistipes,Desulfovibrio,Allobaculum和Streptococcus的相对丰度显著降低。总之,羊乳的摄入增加了小鼠肠道微生物多样性,一定程度上改善了小鼠肠道环境。
