348例胎儿颈项透明层增厚病例分析
2022-01-05张艳萍邓玉清钟世林薛利萍郑思阳
张艳萍,邓玉清,钟世林,薛利萍,郑思阳
颈项透明层(nuchal translucency,NT)是指妊娠早期(11~13+6周)在超声波下见到的胎儿颈项部皮肤后方皮下组织中空隙部位的液性暗区,胎儿NT值是孕早期行超声检查的一个重要指标,1990年Szabo和Celln[1]首次提出NT异常与21三体综合征有关,1992年Nicolaides等[2]提出并开始逐步规范NT值测量的临床操作。近年来,越来越多的研究报道,NT增厚不仅与胎儿染色体异常有关,还与胎儿严重心脏畸形、宫内感染、地中海贫血及某些遗传性疾病密切相关[3-4],因此,对于超声筛查胎儿NT增厚的病例应行进一步检查,及时发现异常,避免出生缺陷。本研究回顾性分析我院孕期产前超声提示胎儿NT增厚并行介入性产前诊断的孕妇,对其染色体核型和染色体微阵列分析(chromosomal microarray analysis,CMA)检测结果进行分析,从而更好地指导胎儿NT结果在临床咨询中的应用。
1 对象和方法
1.1 研究对象
回顾性分析2018年3月至2020年3月在北京大学深圳医院孕期定期产检,孕11~13+6周行超声检查结果提示NT值≥2.5 mm,行介入性产前诊断的348例孕妇的资料,其中行绒毛活检术17例,羊水穿刺术331例,孕妇年龄18~44岁,平均(30.12±4.86)岁,孕周13~25+6周,平均(18.46±2.13)周。
1.2 方法
1.2.1 胎儿超声 超声检查由我院获得医学影像产前诊断资格证书的医生检查,外院检查异常者,如就诊孕周在胎儿NT超声检查孕周内,均在我院再次行胎儿NT超声确认NT值情况。测量方法:检查孕周为11~13+6周,胎儿头臀径为45~84 mm时,应取得胎儿正中矢状缝切面图,在胎儿自然姿势时测量皮肤内缘至脊柱外软组织外缘间的最宽距离,NT测量3次,取其最大值。我院诊断NT≥2.5 mm为NT增厚。
1.2.2 介入性产前诊断 孕妇及家属签署介入性产前诊断同意书后,由我院产前诊断中心操作熟练的医生在超声引导下采集胎儿样本,孕11~13+6周行绒毛活检术,孕17~26周行羊水穿刺术。
1.2.3 染色体核型检测方法 按照标准常规方法对胎儿绒毛细胞或羊水细胞进行培养及胎儿染色体G显带核型分析。染色体核型命名根据《人类遗传学国际命名体制ISCN(2016)》。
1.2.4 染色体微阵列分析检测 按照Affymetrix CytoScan芯片检测的标准操作流程进行基因组DNA的提取、扩增、纯化、片段化、标记、杂交、洗涤及扫描,再对数据进行分析,根据基因组中引起DNA拷贝数不平衡改变的微缺失与微重复情况,其临床意义分为多态、致病性、不明确、可能致病、可能良性5种。
1.3 随访
交代所有在我院行介入性产前诊断手术的孕妇术后3天复诊,术后1周及产后有产前诊断中心专职工作人员电话咨询孕妇胎儿及新生儿情况。
1.4 统计学处理
应用SPSS 22.0统计软件录入数据,计数资料采用频数及率表示,通过χ2检验比较NT增厚不同厚度情况与染色体核型和CMA的异常检出率是否存在显著性差异;通过χ2检验比较NT增厚是否合并超声异常与染色体核型和CMA的异常检出率是否存在显著性差异。P<0.05为差异有统计学意义。
2 结果
2.1 348例颈项透明层增厚胎儿产前诊断结果情况
348例孕妇中,共有17例接受绒毛活检术,331例接受羊水穿刺术,其中7例双胎妊娠。17例行绒毛活检术孕妇同时行引产术,331例行羊水穿刺孕妇无一例出现术后流产、宫内感染、胎膜破裂等并发症。共检出染色体核型异常60例,占17.24%(60/348),其中致病性异常57例,占16.38%(57/348)。CMA结果异常121例,其中CMA致病性异常56例,占16.09%(56/348),意义不明确65例。将348例孕妇按照胎儿NT值增厚情况将其分为2.5 mm≤NT<3.0 mm、3.0 mm≤NT<3.5 mm、3.5 mm≤NT<4.0 mm、4.0 mm≤NT<4.5 mm、4.5 mm≤NT<5.0 mm、≥5.0 mm共6组,分别详细说明。
(1)超声提示2.5 mm≤NT<3.0 mm有132例,其中染色体核型异常12例,致病性异常11例,其中8例21-三体(含1例21-三体嵌合体,核型47,XN,+21[6]/46,XN[94])、1例18-三体、1例XYY、1例45,X[61]/47,XXX[39]、1例46,X,t(Y:15)(q12:p11);CMA异常37例,其中CMA致病性异常10例,意义不明确27例,其中有1例CMA 7q11.23-q21.11杂合性缺失5.31Mb,经父母双方验证为新发病变,有3例经父母双方验证为遗传。有1例染色体核型结果为45,X[61]/47,XXX[39],CMA结果未见异常,该例孕妇选择引产。1例染色体核型结果正常,CMA提示 Xp22.31缺失1.70Mb,为致病性,孕妇选择继续妊娠,出生时随访一般情况良好。除染色体异常外,有2例重型地中海贫血(--SEA/--SEA)。4例染色体核型结果及CMA结果均正常孕妇在中孕期超声发现胎儿结构异常(1例先天性心脏病、1例先天性心脏病合并腭裂;1例小下颌并腭裂、1例双侧多囊肾)。
(2)超声提示3.0 mm≤NT<3.5 mm有102例,含3例双胎妊娠,其中染色体核型异常11例,致病性异常10例,其中7例21-三体、3例18-三体、1例双胎妊娠,其NT增厚胎儿染色体核型结果46,XN,inv(2)(p22p12),t(2∶7)(q21∶q22)[8]/46,XN[92];CMA异常34例,其中CMA致病性异常11例,意义不明确23例,除染色体核型致病性异常的10例病例,CMA另检出1例致病性异常,1q42.3-q44重复12.96Mb/5p15.33-p15.1缺失16.14Mb致病性,该例孕妇引产终止妊娠。有1例意义不明确片段经父母双方验证为遗传。染色体核型结果及CMA结果均正常者,1例新生儿随访出现尿道下裂、多指畸形;1例新生儿在1岁3个月时因儿童颅脑损伤死亡。
(3)超声提示3.5 mm≤NT<4.0 mm有43例,其中染色体核型异常10例,致病性异常10例,其中8例21-三体、1例XXY,1例46,XN,add(9)(q34);CMA异常16例,其中CMA致病性异常9例,意义不明确7例。该例染色体核型结果为46,XN,add(9)(q34)的病例,CMA 结果提示意义不明确(1q41-q42.11重复819kb;9q34.3缺失832kb;12p13.33-p13.31重复6.56Mb;14q21.2-q21.3重复1.52Mb),孕妇选择继续妊娠,新生儿出生随访出现耳廓畸形、肠道发育异常、多指畸形等,后续再随访拒接电话。1例染色体核型结果及CMA结果均正常孕妇在中孕期超声发现胎儿心脏发育异常,引产终止妊娠。
(4)超声提示4.0 mm≤NT<4.5 mm有33例,含1例双胎妊娠,其中染色体核型异常9例,致病性异常9例,其中3例21-三体、1例18-三体、1例13-三体、3例45,X、1例双胎妊娠,其NT增厚胎儿染色体核型结果46,XN,dup(8)(q11.23q13.3),行选择性减胎术。CMA异常13例,其中CMA致病性异常9例,意义不明确4例,有1例意义不明确片段经父母双方验证为遗传。
(5)超声提示4.5 mm≤NT<5.0 mm有19例,含2例双胎妊娠,其中染色体核型异常6例,致病性异常5例,其中3例21-三体、1例45,X、1例46,XN,add(15)(q12)、1例46,XN,t(8∶9)(q13∶?);CMA异常8例,其中CMA致病性异常5例,意义不明确3例。其中2例为绒毛活检术后同时引产,这两例病例1例超声提示胎儿多发畸形(胎儿NT增厚并全身皮肤水肿;胎儿四肢长骨异常声像;颜面部异常;腭裂;下颌回缩可能),染色体核型结果正常,CMA提示意义不明确片段(15p25.3重复352kb;17p11.2重复388kb不明确);1例超声提示胎儿NT增厚并全身皮肤水肿,染色体核型结果及CMA结果未提示异常。
(6)超声提示≥5.0 mm有19例,含1例双胎妊娠,其中染色体核型异常12例,致病性异常12例,其中4例21-三体、5例18-三体、1例13-三体、2例45,X;CMA异常13例,其中CMA致病性异常12例,意义不明确1例。其中,NT≥6.0 mm有5例,染色体核型及CMA致病性异常3例;包括6.0~6.9 mm 2例,1例45,X,1例21-三体;7.0~7.9 mm 1例,染色体核型及CMA正常,该例胎儿生后随访出生情况正常;NT≥9.0 mm 2例,1例13-三体。
2.2 颈项透明层增厚数值与胎儿染色体核型及染色体微阵列分析结果的关系
将348例孕妇按照胎儿NT值增厚情况将其分为6组,比较各组间胎儿染色体异常情况及CMA异常情况(详见下页表1)。由表1中可见,随着胎儿NT值的增厚,胎儿染色体异常率及CMA致病性异常率均增加,各组相比较差异有统计学意义(χ2=43.355,P<0.001;χ2=45.661,P<0.001)。NT≥5.0 mm时胎儿染色体异常率及CMA致病性异常率明显增高(χ2=29.695,P<0.001;χ2=32.836,P<0.001)。2.5 mm≤NT<3 mm与≥3 mm以上相比较,其染色体异常及CMA致病性异常率与NT值差异有统计学意义(χ2=9.901,P=0.002;χ2=11.423,P=0.001)。
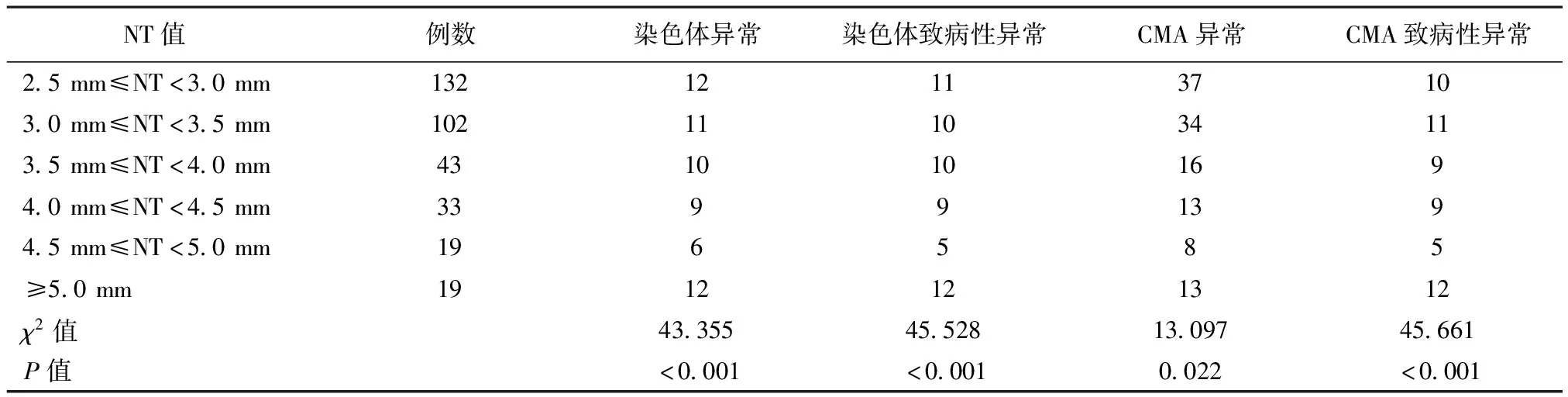
表1 NT值增厚数值与胎儿染色体异常率及CMA致病性异常率的关系
2.3 单纯颈项透明层增厚与颈项透明层增厚合并其他超声异常与胎儿染色体核型及染色体微阵列分析结果的关系
将348例孕妇按照胎儿NT值增厚是否合并其他超声异常情况将其分为两组,单纯NT增厚组与NT增厚合并其他超声异常组,比较各组间胎儿染色体异常情况及CMA异常情况(详见下页表2)。NT合并超声异常以胎儿颈部水囊瘤/全身皮肤水肿最多,有16例,其中6例同时合并其他异常,如脐膨出、单脐动脉、四肢长骨异常声像、二、三尖瓣少量反流等;其余病例异常包括鼻骨显示不清、心血管发育异常、全前脑、脑积水、脉络丛囊肿、肾脏回声增强、鳃裂囊肿等。由表2中可见,胎儿NT增厚合并其他超声异常组,其染色体异常及CMA致病性异常率高于单纯NT增厚组,差异有统计学意义(χ2=42.066,P<0.001;χ2=46.876,P<0.001)。
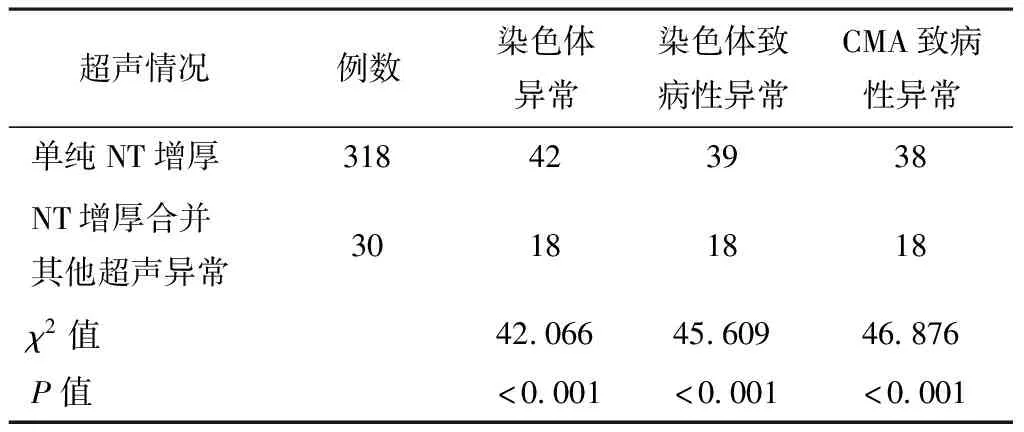
表2 NT增厚是否合并超声异常与胎儿染色体异常及CMA异常的关系
3 讨论
正常胚胎在发育过程中,胎儿淋巴系统在孕14周前尚未完全发育完善,颈部淋巴囊与颈静脉窦尚未相连通,淋巴液不能及时回流到颈静脉,少量淋巴液积聚在颈部,从而出现了暂时性的颈部皮下积液,表现为颈后部皮下的低回声带,就是NT[5],NT是所有胎儿都会出现的一种超声征象。目前公认的NT增厚为超过第99百分位数,即3.5 mm,但目前研究认为的NT增厚标准不一,大多数认为NT≥3.0 mm为增厚,2.5 mm≤NT<3.0 mm为临界增厚[3-4,6]。我院产前诊断中心以NT≥2.5 mm定义为增厚,并建议进一步介入性产前诊断排除胎儿染色体异常等情况。
在本研究中,348例孕妇染色体核型异常60例,占17.24%(60/348),其中致病性异常57例,占16.38%(57/348),其中21-三体33例,占57.89%(33/57),18-三体11例,占19.30%(11/57),Turner综合征6例,占10.53%(6/57);CMA结果致病性异常56例,占16.09%(56/348),按照胎儿NT值增厚情况将其分为2.5 mm≤NT<3.0 mm、3.0 mm≤NT<3.5 mm、3.5 mm≤NT<4.0 mm、4.0 mm≤NT<4.5 mm、4.5 mm≤NT<5.0 mm、≥5.0 mm 6组分析,其染色体致病性异常发生率分别为8.33%、9.80%、23.26%、27.27%、26.32%、63.16%;CMA致病性异常发生率分别为7.58%、10.78%、20.93%、27.27%、26.32%、63.16%;可见,随着NT值增厚,其染色体异常及CMA异常发生率均呈增高趋势,NT≥5.0 mm时胎儿染色体异常率明显增高,但超过5.0 mm后,其染色体异常与NT值厚度差异无统计学意义。麦明琴等[6]在其研究中,NT增厚胎儿致病性染色体异常的发生率为16.6%,其中以21-三体、18-三体、13-三体及X单体等数目异常为主,且随着NT值的增加,其染色体异常风险增加,我们的研究与其大致相符。胎儿NT增厚除与染色体病相关外,还与染色体微缺失/微重复综合征有关。Grand等[7]对17项研究的1 696例妊娠进行了荟萃分析,发现CMA可见NT增厚胎儿染色体核型正常胎儿的致病性CNVs检出率提高5%。杨丹等[4]在其研究中通过CMA检测也发现了14例微缺失/微重复综合征。在本研究中,CMA额外检出两例致病性异常,低于文献报道,其中一例Xp22.31缺失1.70Mb;一例1q42.3-q44重复12.96Mb/5p15.33-p15.1缺失16.14Mb。另有一例染色体核型结果为45,X[61]/47,XXX[39],CMA结果未见异常,两者结果不符合考虑可能总体上X染色体数目是正常的,CMA检测有一定的局限性,不能检出异常。在本研究中,有30例胎儿NT增厚合并超声异常,其中2.5 mm≤NT<3.0 mm组6例、3.0 mm≤NT<3.5 mm 3例、4.0 mm≤NT<4.5 mm 8例、4.5 mm≤NT<5.0 mm 4例、≥5.0 mm 9例,NT≥4 mm以上有21例合并其他超声异常,占70%(21/30),单纯NT增厚染色体核型异常为13.21%(42/318),CMA致病性异常为11.95%(38/318),胎儿NT增厚合并其他超声异常时,胎儿染色体核型异常及CMA致病性异常达60%(18/30),胎儿染色体异常风险明显增加,这与郑文婷等[8]的报道大致相符,其研究中提示胎儿NT增厚合并其他超声异常的胎儿染色体异常检出率为60.4%。
NT增厚最开始用于胎儿染色体异常的筛查,但近年来研究提示NT增厚与胎儿结构发育异常也有着密切的关系,尤其是心脏畸形[9],NT<3.5 mm时,胎儿的先天性心脏发育异常为1.5%左右,NT在3.5~4.4 mm、4.5~5.4 mm和>8.5 mm时,胎儿先心病的发生率会提高到3.4%、15.0%、64.0%。在我们随访过程中,除孕早期发现4例心脏发育异常绒毛活检同时引产病例外,后期仅随访到3例胎儿出现心脏发育异常胎儿,该数量较少不排除因较多染色体核型异常或其他因素的胎儿已行引产而影响结果,可在后续的工作中进一步研究。对于NT增厚染色体核型正常的胎儿,在孕16~18周进行超声结果筛查已经可以发现大部分胎儿结构畸形[10],但是,部分神经系统畸形、进展性畸形、肺部畸形可能出现较晚,所以必要时仍需配合孕中期21~24周的结构筛查,我们可将NT增厚胎儿超声结构筛查提前到16~18周,能及早检查出部分严重胎儿畸形病例。研究中还检出2例重型地中海贫血胎儿,周祎等[3]在其对135例NT增厚病例的研究中也发现7例重型地中海贫血,提示NT增厚可能与胎儿结构发育异常或重型α地中海贫血有关。
目前一些研究认为的NT增厚标准不一,大多数认为NT≥3.0 mm为增厚,2.5 mm≤NT<3.0 mm为临界增厚[3-4,6]。周祎等[3]在其研究中建议对于NT≥3.0 mm胎儿可直接行产前诊断;对于NT临界增厚(2.5mm≤NT<3.0mm),建议妊娠早期染色体非整倍体联合筛查后根据风险值决定是否行介入性产前诊断。胎儿染色体非整倍体无创基因检测是通过获取孕妇外周血中胎儿游离DNA片段,应用高通量测序技术,结合生物信息分析,检测胎儿染色体异常的一种产前检测方法,该检测具有所需样本量少、高通量、敏感度高、特异度高和无创性等优点[11-12]。在本研究中,NT临界增厚异常结果为8例21-三体(含1例21-三体嵌合体,核型47,XN,+21[6]/46,XN[94])、1例18-三体、1例XYY、1例45,X[61]/47,XXX[39]、1例46,X,t(Y∶15)(q12∶p11)、1例CMA提示 Xp22.31致病性缺失1.70Mb。在这13例病例中,有4例21-三体行无创基因检测提示T21高风险;染色体核型结果47,XN,+21[6]/46,XN[94]病例,唐氏筛查及无创DNA检查均提示低风险,超声提示NT增厚2.7 mm,引产终止妊娠;染色体核型结果45,X[61]/47,XXX[39]病例,无创基因检查提示低风险,超声提示NT增厚2.8 mm,引产终止妊娠;CMA结果提示染色体Xp22.31微缺失1.70Mb病例,唐氏筛查及无创基因检查均提示低风险,超声提示NT增厚2.9 mm,中孕期晚孕期超声筛查均未发现胎儿结构发育异常,Xp22.31微缺失临床表现为X连锁鱼鳞病,临床表型主要包括鱼鳞病、对称性皮肤损害(病变主要发生在四肢、头皮、颈部和躯干,呈褐色)、男性隐睾症(睾丸癌风险增加)、角膜混浊等;其余病例未行筛查,直接选择介入性产前诊断。麦明琴等[6]在其研究中,2.5 mm≤NT<3 mm胎儿发现1例22q11.21出现2.5Mb缺失,与DiGeorge综合征相关。本研究中3例产前筛查提示低风险病例,仍出现较严重致病性染色体或CMA异常。可见在2.5 mm≤NT<3 mm胎儿还是可能出现微缺失/微重复综合征,胎儿非整倍体异常及性染色体数目异常可通过无创基因检测做筛查,必要时再行产前诊断,但是无创基因检测对于胎儿微缺失微重复综合征检测有一定的局限性[13],可能造成漏诊。一旦发生出生缺陷,将对社会和家庭造成沉重的负担。胎儿染色体非整倍体无创基因检测是否可作为NT临界增厚的筛查方法还需要在后续的研究中积累更多的病例深入探讨。
综上所述,胎儿NT厚度不仅可提示胎儿染色体异常,还可能与胎儿结构发育异常、地中海贫血等相关,且随着NT值增高其染色体核型及CMA异常发生率呈增高趋势。在临床工作中,针对NT增厚病例应进一步建议介入性产前诊断排除胎儿染色体异常风险。并在孕中期21~24周行超声结构筛查了解胎儿结构情况,必要时可将超声结构筛查提前至孕16~18周。
