超时间窗急性缺血性脑卒中患者动脉取栓后颅内出血预警模型构建
2022-01-05包建英王雪梅曹月洲施海彬
包建英,王雪梅,曹月洲,刘 圣,施海彬
南京医科大学第一附属医院介入放射科,江苏 南京210029
我国急性缺血性脑卒中(acute ischemic stroke,AIS)标化患病率逐年上升,是致死和致残的重要病因[1]。经静脉使用重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)溶栓是治疗AIS的首要方法,但具有严格的时间窗限制,且对大血管闭塞AIS患者疗效欠佳[2]。2015年以来,多个随机对照研究结果提示,在经过筛选的前循环大血管闭塞AIS患者中,以动脉取栓为主的血管内治疗可以让患者获益[3-9]。颅内出血转化是AIS静脉溶栓和动脉取栓后的主要并发症,文献报道的发生率为1.9%~7.0%,与AIS预后不良密切相关[10]。目前国内外研究主要聚焦溶栓后的颅内出血转化[11],针对动脉取栓,尤其是超时间窗AIS患者动脉取栓后出血转化的预测研究仍不多见。因此,本研究以动脉取栓后发生颅内出血转化为主要观察指标,拟研究超时间窗AIS患者动脉取栓后发生颅内出血转化的危险因素,构建预警模型,为AIS动脉取栓后的临床观察和出血转化防治提供依据。
1 对象和方法
1.1 对象
回顾性分析2018年1月—2020年6月146例在南京医科大学第一附属医院介入放射科接受血管内治疗的AIS患者临床资料。纳入标准:①年龄≥18岁;②美国国立卫生研究院脑卒中量表(National Institute of Health stroke scale,NIHSS)评分≥6分;③大脑中动脉M1/M2段闭塞和/或颈内动脉颅内段闭塞;④发病时间6~24 h或醒后卒中,影像资料完整且图像清晰,影像学参数符合DEFUSE 3临床研究标准[8];⑤术前头颅计算机断层扫描(computed tomography,CT)未见颅内出血或异常高密度;⑥采用Solitaire AB支架进行取栓。排除标准:①基线改良Rankin量表(modified Rankin scale,mRS)评分>2分;②术前头颅CT显示低密度区超过大脑中动脉供血区域1/3;③临床资料不完整。本回顾性研究已经通过南京医科大学第一附属医院伦理委员会审批(编号2019-SRFA-063)。
1.2 方法
1.2.1 一般资料
收集患者的姓名、年龄、性别、既往卒中或短暂性脑缺血发作(transient ischemic attacks,TIA)史、房颤史、高血压、冠状动脉疾病史、糖尿病史、吸烟史。收集发病时间、到院时间、股动脉穿刺时间、血管再通时间、手术结束时间、是否进行静脉溶栓、基线NIHSS评分、基线国际标准化比值、基线血小板、血管闭塞部位、血管再通分级、是否使用动脉内溶栓或盐酸替罗非班注射液、是否进行血管成形/支架植入、支架取栓次数和基线Alberta卒中项目早期CT(Alberta stroke program early CT score,ASPECT)评分。血管闭塞部位依据取栓前脑血管造影结果来判断。血管再通分级采用改良脑梗死溶栓分级(modified thrombolysis in cerebral infarction score,mTICI)标准进行评估,达到mTICI 2b或3被定义为良好再通[12]。到院至穿刺(door to puncture,DTP)时间定义为从患者到达医院到穿刺的时间。总手术时间定义为从股动脉穿刺到实现mTICI 2b或3,或没有实现再通的患者手术结束的时间。基线ASPECT评分依据术前CT平扫图像来评估。ASPECT评分主要评估大脑中动脉供血区的10个区域。总分10分,累及一个区域扣1分[13]。
1.2.2 术后评估及颅内出血的诊断
所有患者常规在动脉取栓后24~48 h复查头颅CT平扫。若24 h内症状加重,立即复查头颅CT平扫。CT平扫图像上出现的高密度,可以是颅内出血或造影剂渗出。若高密度影在随访CT中很快消失,则认为造影剂渗出,反之则是颅内出血[14]。
1.3 统计学方法
采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料用均数依标准差(±s)表示,两组间比较采用独立样本t检验。不符合正态分布的计量资料用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料以百分数(频数)表示,组间比较采用Fisher确切概率法检验或卡方检验。将单因素分析中P<0.05的变量纳入Logistic回归,以明确出血转化的危险因素,并构建预警模型。以受试者工作特性(receiver operating characteristic,ROC)曲线法评估预警模型对颅内出血转化的预测效能。P<0.05为差异具有统计学意义。
2 结果
本研究共纳入AIS患者146例。其中女57例(39.0%),平均年龄(72.6依10.1)岁。67例(45.9%)为大脑中动脉闭塞,79例(54.1%)合并颈内动脉闭塞。95例(65.1%)合并高血压、37例(25.3%)合并高血糖、35例(24.0%)合并房颤、26例(17.8%)合并冠心病、27例(18.5%)合并卒中/短暂性卒中病史、37例(25.3%)合并吸烟史。中位基线NIHSS评分为14(10,18)分,中位基线国际标准化比值为1.05(1.01,1.14),平均基线血小板计数为(184.5依66.1)×109个/L。中位CT平扫ASPECT评分为7(6,9)分。中位患者到院至穿刺时间为89(72,109)min,中位手术总时间为91(60,121)min。
29例(19.9%)患者在动脉取栓前接受了静脉溶栓。动脉内使用盐酸替罗非班33例(22.6%)。动脉内溶栓4例(2.7%)。动脉内取栓后行血管成形或支架植入41例(28.1%)。平均支架取栓2次。118例(80.8%)患者实现良好再通。
146例患者中,48例(32.9%)出现颅内出血转化。与非出血组比较,出血组基线NIHSS评分更高(P<0.001)、支架取栓次数更多(P=0.049)、ASPECT评分更低(P<0.001)。两组间年龄(P=0.060)、性别(P=0.414)、血管闭塞部位(P=0.474)、使用静脉溶栓(P=0.263)、良好再通(P=0.722)、到院至穿刺时间(P=0.320)和手术总时间(P=0.554)差异无统计学意义(表1)。

表1 出血组和非出血组临床资料对比Table 1 Comparison of clinical data between two groups
Logistic回归分析显示,高基线NIHSS评分(β=0.130,OR=1.139,95%CI:1.054~1.230,P=0.001)和低基线ASPECT评分(β=-0.597,OR=0.550,95%CI:0.417~0.727,P<0.001)是动脉取栓后颅内出血转化的危险因素。代表性病例见图1。
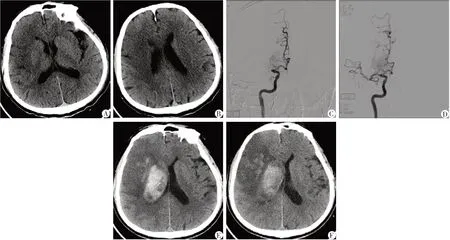
图1 动脉取栓后发生颅内出血的急性缺血性脑卒中患者的影像资料Figure 1 Images of one AIS patient with intracranial hemorrhage after intra-arterial thrombectomy
依据回归分析结果及危险因素的偏回归系数,构建AIS患者动脉取栓后颅内出血的风险预测模型:颅 内 出 血 风 险 值=-0.535+0.130×NIHSS评分-0.597×ASPECT评分。模型预测取栓后颅内出血 的ROC曲 线 下 面 积 为0.875(95%CI:0.810~0.924)、灵敏度为0.854(95%CI:0.722~0.939)、特异度为0.837(95%CI:0.748~0.904)(图2)。

图2 预警模型预测AIS患者动脉取栓后颅内出血的ROC曲线Figure 2 ROC curve of the model in predicting intracranial hemorrhage in AIS patients
3 讨论
3.1 AIS患者动脉取栓后颅内出血的危险因素分析
颅内出血转化是AIS静脉溶栓及动脉取栓后的重要并发症,与不良预后相关[15]。既往Enomoto等[16]研究认为支架取栓次数与术后蛛网膜下腔出血密切相关。多次支架取栓在拖出血栓的同时,会损伤血管内膜,导致血管渗透性增加,增加出血风险。但Hassan等[17]研究发现,支架取栓次数与颅内出血转化不相关。本研究发现,出血组支架取栓次数高于非出血组(2次vs.1次),但多因素分析未提示支架取栓次数是影响颅内出血的危险因素。NIHSS评分是评估AIS患者神经功能损伤程度最常用指标。NIHSS越高,往往提示存在颅内大血管闭塞,缺血范围和程度更加严重。既往文献报道,NIHSS评分是AIS取栓后发生大面积脑梗死的危险因素[12]。本研究中,出血组基线NIHSS评分高于非出血组(19分vs.12分),与既往文献相符。ASPECT评分是反映AIS患者脑缺血范围的指标,评分越低提示缺血范围越大。既往Raychev等[18]发现基线ASPECT评分与颅内出血转化风险负相关。本研究中,出血组ASPECT评分低于非出血组(6分vs.8分),表明ASPECT评分反映的基线梗死体积是影响AIS术后出血转化的重要因素。
3.2 AIS患者动脉取栓后颅内出血预警模型建立
通过Logistic回归分析,本研究发现高NIHSS评分和低ASPECT评分是动脉取栓后颅内出血转化的危险因素。依据此结果和危险因素的偏回归系数,本研究构建的AIS患者动脉取栓后颅内出血的风险预测模型如下:颅内出血风险值=-0.535+0.130×NIHSS评分-0.597×ASPECT评分。Logistic回归是常用的建模方法,根据回归系数的权重对危险因素赋值,能更有针对性地预测AIS患者发生颅内出血的风险。模型的预测效能常用曲线下面积表示,取值越接近1说明预测效能越好。本模型预测取栓后颅内出血的线下面积达到0.875,提示预测效能良好。
3.3 对临床工作的指导意义
AIS患者动脉取栓后颅内出血预警模型的构建,有利于医护人员在取栓术后对高风险的患者进行有针对性的观察、监测及护理。在实际临床工作中,可以借助信息化平台,依据NIHSS评分和ASPECT评分等信息自动计算出患者个体化的颅内出血风险值,并以警示信息形式推送至医护工作台。接收信息后,纳入工作安排的“优先”序列,启动针对动脉取栓后颅内出血风险的观察和管理,包括血压的个体化控制、神经系统症状和体征的观察、保持呼吸道通畅、避免尿潴留和便秘、保持循环动力学稳定,按需给氧,避免低氧血症。至少每30 min观察血压及神经系统症状和体征。
综上所述,超时间窗AIS患者中,高NIHSS评分和低ASPECT评分患者动脉取栓后发生颅内出血的风险较大。预警模型可为超时间窗AIS患者动脉取栓后的临床观察和出血转化防治提供依据。
