MicroRNA-190调控衰老相关的脂肪能量代谢稳态
2022-01-05彭丹丹
彭丹丹,李 言
1东南大学生命科学与技术学院,江苏 南京210096;2江南大学食品学院,江苏 无锡214122
衰老通常伴随机体发生不可逆转的生理功能下降,这其中就包括能量代谢稳态。衰老相关的代谢稳态失衡通常包括能量消耗减少、脂肪堆积以及胰岛素敏感性的降低等[1-2]。衰老相关的代谢稳态失衡与很多代谢性疾病有着十分密切的关系,包括2型糖尿病、心血管疾病以及神经退行性疾病等[3-6]。因此,探究衰老相关的代谢稳态失衡发生发展过程中的分子机制并寻找潜在的干预靶点迫在眉睫[7-8]。研究发现衰老会导致脂肪组织中microRNA的水平发生改变,从而影响能量代谢稳态[9]。miR-190-5p(miR-190)位于染色体15q22.2的TLN2基因内含子区。最近,越来越多的相关研究表明其与人类疾病之间具有相关性,尤其是在癌症的发生和发展方面[10]。已知miR-190在多个组织中存在表达,但是其在脂肪组织中以及衰老进程中发挥的具体作用和分子机制仍不明确[10]。本研究对miR-190在脂肪细胞中的作用进行探究,鉴定衰老过程中miR-190水平的改变及其在衰老相关代谢稳态失衡中的作用,探讨miR-190调控脂肪组织能量代谢稳态的分子机制。
1 材料和方法
1.1 材料
小鼠模型:实验所用小鼠C57BL/6J(上海斯莱克实验动物公司),均为年龄4~8周龄的雄鼠,待其成年后进行实验。动物20~22℃恒温饲养于无特定病原体(specific pathogen free,SPF)级动物房,每12 h开关照明昼夜循环,以正常饲料饲养。本研究所有小鼠实验均严格遵循动物实验“3R”原则,按照中华人民共和国国家标准《实验动物福利伦理审查指南》(GB/T27416-2014)执行。
细胞系:褐色脂肪前体细胞(brown adipose cell,BAC)细胞系,细胞培养基:改良杜氏伊格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)+10%胎牛血清(fetal bovine serum,FBS)+1%青链霉素混合液(penicillin-streptomycin solution,PS)。3T3 L1细胞系,脂肪前体细胞,细胞培养基:DMEM+10%新生牛血清(newborn calf serum,NCS)+1%PS+生物素(8 mg/L)+泛酸(17 μmol/L)。所有细胞置于37℃、5%CO2的细胞培养箱中进行培养,每天观测细胞生长状态。
泛酸酯、生物素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松(dexamethasone,Dex)、吲哚美辛(indometacin,Indo)和葡萄糖(D-glucose)(Sigma公司,美国);核糖核酸(ribonucleic acid,RNA)反转录试剂盒、克隆用聚合酶链式反应(polymerase chain reaction,PCR)酶LA Taq(Ta-KaRa公司,日本);蛋白酶抑制剂和磷酸酶抑制剂、SYBR GREEN实时定量PCR试剂盒(Roche公司,瑞士);蛋白定量试剂Bradford、蛋白marker PageRuler Prestained Protein Ladde和蛋白免疫印迹化学发光试剂Super West Pico Chemiluminescent Substrate(Thermo Fisher公司,美国);RNA抽提试剂TRIzol、转染试剂lipofectamine2000、DMEM、非必需氨基酸(non-essential amino acids,NEAA)、glutamine、0.25%胰酶(trypsin)、胎牛血清及其他细胞培养试剂(Life technologies公司,美国);荧光素酶报告基因试剂盒(Promega公司,美国)。
1.2 方法
1.2.1 小鼠实验
小鼠麻醉取血后处死,迅速收集褐色脂肪组织(intrascapular brown adipose tissue,iBAT)与皮下白色脂肪组织(inguinal white adipose tissue,iWAT)于液氮中速冻后保存于-80℃超低温冰箱,待进一步检测。体内miR-190 antagomir抑制剂作用通过定点注射iBAT与iWAT部位进行。
1.2.2 代谢笼
将待检测的小鼠称量体重后每只单独放入检测小室,提供充足的粮食和饮用水后密封。启动自动化小鼠新陈代谢监测系统,录入小鼠体重后开始检测。
1.2.3 HE染色
新鲜组织用8%多聚甲醛固定24~48 h后脱水,石蜡包埋;修石蜡块、切片、展片、贴片、烤片(55~60℃)3~10 h;将切片依次放入二甲苯中10 min(2次)、无水乙醇中5 min(2次)、95%乙醇中5 min、80%乙醇中片刻、70%乙醇中片刻脱蜡,后双蒸水洗5 min;将切片用苏木素染液染色5 min后双蒸水洗片刻;将切片用0.5%盐酸酒精分色约10 s,自来水洗返蓝(约20 min);将切片置于70%乙醇中5 min、80%乙醇中5 min,然后用伊红染液(95%乙醇配制)染色约20 s;将切片依次置于95%乙醇中5 min、无水乙醇中5 min、二甲苯+乙醇(1∶1)中5 min和二甲苯中5 min(2次);中性树胶封片,正置显微镜观察拍摄照片。
1.2.4 细胞培养、诱导及分化
3T3L1脂肪前体细胞使用生长培养基进行普通传代培养:DMEM+10%NCS+1%PS+1%生物素/泛酸酯,细胞生长至70%左右进行传代(生长过密后传代会影响之后的细胞分化效率)。需要分化的细胞铺板生长接触抑制后继续在生长培养基中维持48 h左右(克隆增殖期),用诱导培养基对该状态下的3T3L1细胞进行诱导:DMEM+10%FBS+1%PS+1%生物素/泛酸+1 μg/mL insulin+500 μmol/L IBMX+1 μmol/L Dex。此时3T3L1细胞需在诱导培养基中至少保持48 h,然后换为分化培养基:DMEM+10%FBS+1%PS+1%生物素/泛酸+1 μg/mL insulin,分化培养基每2 d换1次液,在诱导之后6~8 d细胞分化成熟,出现明显的脂滴后进行后续的其他实验。
BAC褐色脂肪前体细胞使用生长培养基进行普通传代培养:DMEM+10%FBS+1%PS,细胞生长至70%左右进行传代。将要分化的BAC细胞铺板后换为分化培养基:DMEM+10%FBS+1%PS+0.1 μg/mL insulin+1 nmol/L三碘甲状腺原氨酸(triiodothyronine,T3),待其生长至90%及以上用诱导培养基进行诱导:DMEM+10%FBS+1%PS+0.1 μg/mL insulin+1 nmol/L T3+500 μmol/L IBMX+5 μmol/L Dex+0.125 mmol/L Indo。将BAC细胞在诱导培养基中保持48 h以上,然后换为分化培养基,分化培养基每2 d换1次液,在诱导之后6~8 d细胞分化成熟,然后每天换新鲜分化培养基,出现明显脂滴后进行后续其他实验。
1.2.5 细胞衰老模型构建
利用H2O2与棕榈酸(palmitic acid,PA)在体外构建细胞衰老模型。在3T3L1白色脂肪前体细胞和BAC褐色脂肪前体细胞出现明显脂滴后,进行诱导衰老处理:分别配制用培养基稀释的100 μmol/L的H2O2溶液和200 μmol/L的PA溶液,随后将配制好的溶液加入模型组细胞24 h孵育。吸去含有H2O2和PA的培养基,收取细胞样品。
1.2.6 荧光素酶报告基因实验
将处于生长对数期的HEK 293T细胞进行铺板,细胞增殖至80%左右进行转染,报告基因质粒转染24~48 h后取出细胞板终止培养。根据试剂盒操作说明进行后续实验。
1.2.7 定量PCR
采用TRIzol试剂(Invitrogen公司,美国)按操作说明书提取脂肪组织和细胞中的总RNA。根据试剂盒操作说明进行后续实验。
1.2.8 蛋白质免疫印迹[11]
小鼠组织及细胞在匀浆后10 000 r/min离心20 min得到上清。使用BCA试剂盒测定蛋白浓度作为内参,在保证蛋白量一致的情况下确定组织上清液体积。在组织上清液中加入5×上样缓冲液(5×loading buffer)后100℃加热10 min,即可获得组织样品。用10%的聚丙烯酰胺凝胶进行电泳,待条带跑开后转膜,用5%TBST牛奶封闭1 h,分别加入内参和相应的一抗进行孵育,TBST充分洗涤后再加入二抗进行孵育,TBST充分洗涤后上机检测。
1.3 统计学方法
数据用GraphPad5.0进行分析,除特别标注外,定量实验各组数据以均数依标准差(±s)表示。使用独立样本t检验分析两组数据之间的差异性,使用one way ANOVA分析多组数据之间的差异性。P<0.05为差异有统计学意义。
2 结果
2.1 miR-190在衰老褐色脂肪组织与白色脂肪组织中的表达
Sirtuins蛋白家族又被称为长寿蛋白家族,其中SIRT3主要定位于线粒体,并被报道具有拮抗人干细胞衰老的作用。相关研究表明,SIRT3与衰老呈现负相关性[12]。随着小鼠月龄的增加,小鼠iBAT与iWAT中SIRT3的表达水平逐渐下降,证明了衰老进程的发展(图1A、B)。为了进一步确定miR-190与衰老之间的相关性,我们分别比较了不同年龄段小鼠iBAT与iWAT中miR-190的表达水平。RT-PCR的结果显示,iBAT与iWAT中,随着衰老进程的发展,miR-190的表达水平呈现逐渐上升的趋势(图1C、D),提示miR-190的表达水平与衰老呈现正相关性。众所周知,褐色脂肪组织是一种“燃烧脂肪”,可以产生热量。有意思的是,miR-190在褐色脂肪组织中的表达水平最高,而在内脏白色脂肪组织(eWAT)中表达最低,说明miR-190的表达可能与脂肪组织的产热有关(图1E)。

图1 不同月龄小鼠脂肪组织中SIRT3的表达Figure 1 Expression of SIRT3 in adipose tissue of mice at different months of age
2.2 miR-190在体外衰老脂肪细胞中的表达
此外,利用H2O2与PA在体外构建细胞衰老模型[13],以验证上述体内实验的结果。图2A~D证明了体外细胞衰老模型的构建成功。RT-PCR的结果显示,无论是在褐色脂肪细胞(BAC)还是白色脂肪细胞(3T3L1)中,H2O2和PA均可以使脂肪细胞中miR-190水平升高,这与体内结果也是吻合的(图2E~H)。
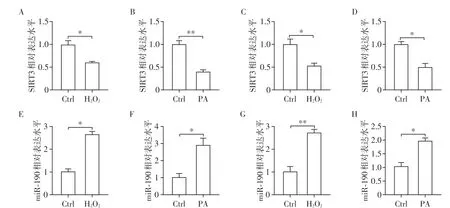
图2 衰老细胞模型中miR-190的表达Figure 2 miR-190 expression of cellular senescence model
2.3 miR-190抑制脂肪细胞产热基因的表达
由于脂肪组织衰老会引起脂肪组织产热基因表达的降低,我们首先检测了衰老细胞模型和衰老小鼠中产热相关基因PR结构域蛋白16(PR domain containing 16,PRDM16)的mRNA表达。结果显示,PRDM16的mRNA表达水平在两种衰老细胞模型中均显著下降(图3A、B)。在衰老小鼠的iBAT与iWAT中也得到了相似的结果(图3C、D)。接着向褐色脂肪细胞与白色脂肪细胞中转染miR-190 agomir,并进行RT-PCR。结果显示,miR-190的过表达会显著降低褐色脂肪细胞中产热相关基因解耦联蛋白1(uncoupling protein 1,UCP1)、PRDM16、细胞死亡诱导DFFA样效应蛋白A(recombinant cell death inducing DFFA like effector A,CIDEA)、碘甲腺原氨酸脱碘酶Ⅱ(recombinant deiodinase,iodothyronine,typeⅡ,DIO2)的mRNA表达水平(图4A);在白色脂肪细胞中也获得了类似结果(图4B)。

图3 衰老细胞模型和衰老小鼠脂肪组织中产热基因PRDM16的变化Figure 3 Changes of thermogenesis gene PRDM16 in senescent cell models and adipose tissue of aging mice

图4 miR-190过表达对脂肪细胞中产热基因的影响Figure 4 Influence of miR-190 overexpression on thermogenesis genes in adipocytes
2.4 PRDM16是miR-190的直接靶基因
通过对数据库检索发现,脂肪产热的关键基因PRDM16[14]可能是miR-190的靶基因并在多个物种间保守(图5A)。为了验证miR-190对脂肪细胞产热的影响是否依赖于PRDM16,进行了荧光素酶报告实验。结果显示,miR-190会抑制PRDM16 3′-UTR的转录活性,而将miR-190结合位点进行突变以后则无该效果(图5B)。向3T3L1细胞中过表达miR-190会抑制PRDM16 RNA和蛋白质的表达,而敲减miR-190,则会促进PRDM16 RNA和蛋白质的表达(图5C~E)。以上结果均表明,PRDM16是miR-190的直接靶基因。miR-190可能通过介导PRDM16的表达抑制脂肪组织产热进而影响代谢稳态。
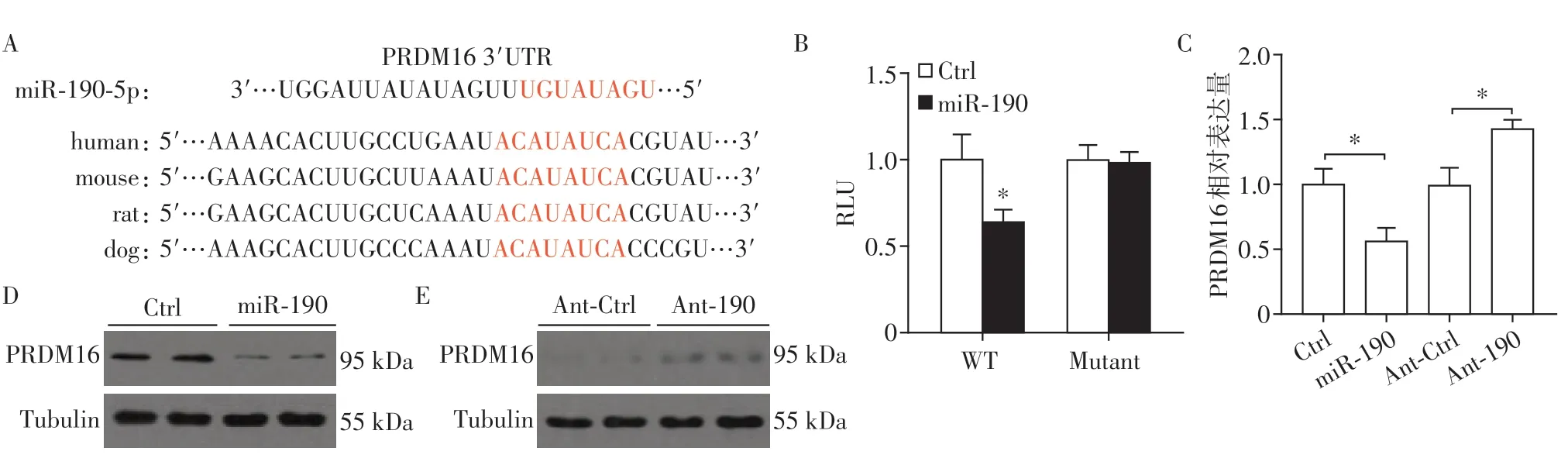
图5 PRDM16是miR-190的靶基因Figure 5 PRDM16 is the target gene of miR-190
2.5 miR-190敲减可以改善老年小鼠的代谢稳态
接着,使用miR-190基因敲除(knockout,KO)小鼠模型来测试miR-190在老年小鼠代谢稳态中是否起作用。对12月龄的老年小鼠进行miR-190 antagomir注射,抑制脂肪组织中miR-190的水平。代谢笼的结果显示,抑制miR-190后,老年小鼠的能量消耗和耗氧量都得到了明显的提升(图6A、B)。HE染色的结果则表明,抑制miR-190可以明显改善衰老小鼠皮下白色脂肪和褐色脂肪细胞的形态,降低脂滴大小(图6C)。此外,本研究检测了正常小鼠、老龄小鼠、KO小鼠中相关产热基因的mRNA表达水平。RT-PCR结果显示,在衰老小鼠的褐色脂肪组织中产热基因UCP1、PRDM16、CIDEA、DIO2的mRNA表达水平显著下降,而抑制miR-190可以明显抑制衰老导致的相关产热基因mRNA表达的下降(图6D);在白色脂肪组织中也获得了类似的结果(图6E)。上述结果证实敲除miR-190可以有效改善老年小鼠的代谢稳态。

图6 miR-190敲减对衰老小鼠的影响Figure 6 Influence of miR-190 knock-down on aging mice
3 讨论
众所周知,衰老是机体代谢下降的病因之一。microRNA已经被广泛报道参与了代谢疾病的调控,但是对于衰老相关代谢稳态失衡的作用仍不够清晰。研究衰老相关代谢紊乱与microRNA之间的关系有利于加深人们对于衰老机制及进程的了解,也为其提供了潜在的有效治疗靶点。在人体中,脂肪细胞是营养和代谢平衡的中心。控制脂肪细胞的形成和衰老不仅可以改善新陈代谢健康,还能有效减缓衰老[15]。以往研究已经表明miR-190是肥胖学龄前儿童胰岛素抵抗和宫颈癌的生物标志物;miR-190通过调控相关靶基因在多种类型的人类肿瘤中表达失调,并可预测肿瘤的诊断和预后,但目前对其在脂肪细胞衰老进程中的作用还不清楚。本研究首次发现了miR-190参与了衰老进程中脂肪能量代谢稳态的调控,miR-190通过抑制PRDM16的表达导致脂肪细胞产热降低从而导致了能量代谢紊乱。
本研究首先通过RT-PCR发现衰老小鼠的褐色脂肪组织和白色脂肪组织中miR-190的表达水平均是升高的,并且体外衰老模型的结果也与之相吻合,说明miR-190与衰老呈正相关性。由于在衰老进程中,产热减少,因此进一步向褐色脂肪细胞和白色脂肪细胞中过表达miR-190,并对相关产热基因进行RT-PCR,结果表明过表达miR-190均会导致产热基因的表达降低,说明miR-190抑制脂肪细胞产热。进一步机制探究发现,脂肪产热的关键基因PRDM16是miR-190的直接靶基因,miR-190通过对PRDM16的负调控抑制脂肪细胞产热。因此直接调控PRDM16表达可能对miR-190诱导的脂肪细胞产热下降有显着抑制作用。
最后,在衰老小鼠中通过miR-190 antagomir抑制脂肪组织中miR-190的表达,结果显示,抑制miR-190的表达后,衰老小鼠的能量消耗和耗氧量都得到改善提升,脂肪组织中脂滴缩小,形态得到明显改观,并且衰老诱导的产热相关基因的下降受到抑制。综上所述,本研究为衰老相关代谢紊乱提供了理论支持,并为其提供了可能的潜在治疗干预策略,但是还需要进一步研究miR-190在脂肪组织中的其余靶点和作用。
