一种基于活动轮廓模型的PET-CT肺肿瘤分割方法
2022-01-04宗静静邱天爽朱广文
宗静静 邱天爽 朱广文
①(大连交通大学计算机与通信工程学院 大连 116028)
②(大连理工大学电子信息与电气工程学部 大连 116024)
③(大连医科大学附属第一医院核医学科 大连 116011)
1 引言
近年来,肺癌成为发病率和死亡率增长最快的恶性肿瘤之一。21世纪初出现的PET-CT设备可将PET的代谢信息和CT的解剖结构信息有机地结合在一起,为精确鉴别恶性肿瘤和正常组织器官提供更全面的资料。PET-CT是了解肺部疾病进展的重要工具,对肺部肿瘤诊疗及疾病监测具有重要作用[1]。
为减少人工勾画肿瘤轮廓带来的耗时、费心、不易重复等不利影响,研究者开发了多种方法分割肺肿瘤图像,如阈值法[2]、区域生长法[3]、协同分割[4-6]等。阈值法简单有效,多用来分割单模态PET图像。其对噪声比较敏感,且对小肿瘤分割效果不好,很少用来处理复杂的分割任务[7]。区域生长类方法性能有时优于阈值法,但需要事先给定感兴趣目标区域或放置种子点以区分背景和前景。对多模态PET-CT数据,多采用协同分割的方法。文献[4]结合随机游走和图割方法,将协同分割问题定义为损失最小化问题,求解并获得分割结果。这类方法一般计算相对复杂,有些需要后处理等。近几年来,随着机器学习的发展,出现了基于深度学习的PET-CT肺肿瘤分割方法[8,9]。深度学习比较依赖大数据,传统统计信号处理方法主要依靠基本假设模型。PET-CT肺肿瘤图像分割的最终目的是服务于临床,它属于解决问题为主要目的问题驱动式研究,而非热点驱动或方法驱动。传统的应用数学建模派和数据驱动的深度学习派两大流派在PETCT肺肿瘤分割方面也许会博弈,也有可能会产生“深度学习+传统方法”类的融合方法以发挥更大价值。对于小样本数据的灰度异质图像,活动轮廓模型的分割算法[10-12]计算效率较高、准确性可靠,更具应用价值,但这类方法对研究人员的整体设计能力要求较高。多种方法的提出为解决PET-CT肺肿瘤分割问题提供了更多可能的选择,其准确性、稳健性也在不断提高。
尽管如此,该领域仍有部分问题亟待解决。肺肿瘤勾画的挑战性之一表现在:多数PET-CT肺肿瘤分割方法未充分将临床诊断经验等纳入方法设计中。按照医工交叉的指导思想,问题驱动式的医学图像算法研究中,开发者应针对不同的问题和应用,尽可能将医生的医学知识和临床经验融入到算法设计中,设计出有针对性的个性化方法。
在人工勾画肿瘤轮廓过程中,PET-CT融合图像在一定程度上可降低不同观察者勾画大体肿瘤体积(Gross Tumor Volume, GTV)的不同,从而提高GTV勾画的精确性[13]。在肺肿瘤的临床诊断中,医生多根据肺肿瘤在PET-CT多模态影像中的表现,采取对应的诊断模式与勾画策略。一般地,由影像专家识别PET中示踪剂摄取增加的区域,并从CT获得肿瘤的解剖界限。当肿瘤边界在CT图像上可识别时,将其作为肿瘤界限。当CT上肿瘤边界不可识别时,从PET图像中获得边界[14]。
为解决PET-CT肺肿瘤分割中存在的没有充分将医生临床经验融入算法设计中的问题,本文参考肿瘤的人工勾画过程和不同临床诊断模式,考虑融合图像在靶区勾画中的有效作用,将融合图像作为待分割目标,提出基于融合图像的肺肿瘤分割方法,旨在提高分割的鲁棒性和精确性。考虑实际小样本情况,建立基于水平集方法的几何活动轮廓模型作为分割算法,使算法成本低,更具应用价值。工作分为3部分:(1)预处理:异机PET和CT图像的配准与融合;(2)建模:建立基于RSF模型和MLC准则的混合活动轮廓模型(简记为RSF_ML模型);(3)分割:基于RSF_ML模型,分割肺肿瘤图像。
2 理论背景
2.1 RSF模型
RSF模型[15]由于考虑了局部信息,一般情况下,可以有效分割部分灰度不均匀的合成图像及临床医学影像。其能量泛函为
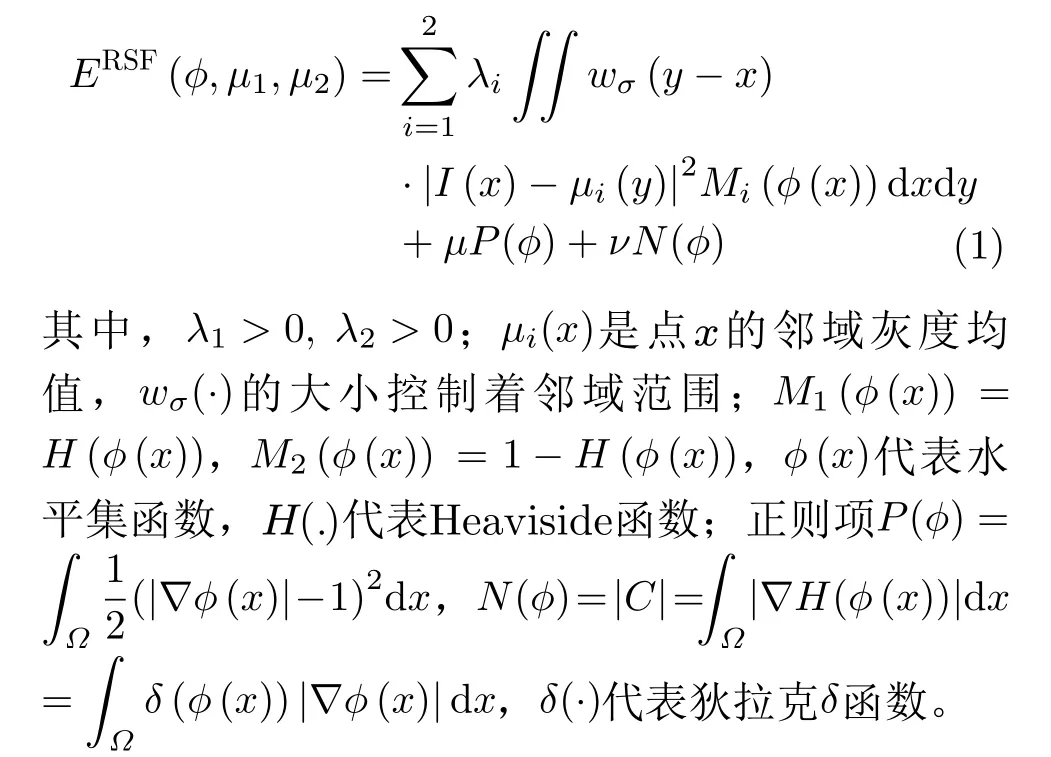
2.2 最大似然比分类
最大似然比分类,又称为贝叶斯(Bayes)分类,它假设数据服从正态分布,是应用较为广泛的一种监督分类方法。该方法是建立在贝叶斯准则基础上分类错误概率最小的一种非线性分类,其判别函数为
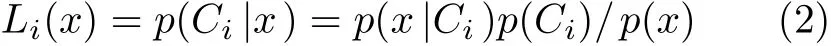
其中,p(Ci|x)是像元x出现在Ci(i ∈[1,N])类的最大概率,又称为后验概率;p(x|Ci)是在Ci类观测到x的条件概率;p(Ci)是Ci类的先验概率;p(x)为变量x与类别无关情况下的出现概率。贝叶斯公式的经典之处就是将后验概率问题转化成了先验概率的问题,当待分类图像中存在N个类别时,计算并比较N个p(Ci|x),取最大者代表的类别为待分类像素的归属类别。p(x)是若干计算式中都出现的公共项,为简单起见可以省略。式(2)可等价表示为
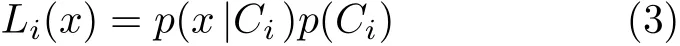
3 混合活动轮廓模型RSF_ML
RSF模型由于解决了普通灰度不均匀图像的分割问题而备受学者关注。医学图像一般存在弱边界、固有噪声等问题,多属于更为复杂的灰度不均匀图像,其复杂性使得RSF模型并不能对所有类型的医学图像分割有效。许多医学图像分割问题要结合待处理医学数据的特点,建立科学合理的方案和模型。文献[7]指出,PET图像中目标的亮度分布形状一般是高斯分布的。将此作为先验知识,考虑RSF模型分割灰度不均匀图像的能力,本文提出一种结合RSF模型和MLC准则的混合活动轮廓模型RSF_ML。该模型将分割看作二分类问题,结合MLC准则,旨在实现肺肿瘤的精确分割。

3.1 数据保真项
式(4)中ERSF表达式的相关解释可参考2.1节,不再赘述。以下对式(4)所提出的数据保真项EML详细介绍。令I:Ω ⊂R2→R表示待分割的图像,一条闭合的演化曲线C ⊂Ω,由水平集函数φ的零水平集表示,即C={x ∈Ω:φ(x)=0},用于将图像域Ω分成两个区域:Ω1={x ∈Ω:φ(x)>0}和Ω2={x ∈Ω:φ(x)<0}。高斯分布假设下,灰度值为I(x)的像素属于类Ci(i=1,2)的概率表示为



3.2 正则项
如式(14)所示,本文正则项Er包括两部分:水平集正则化项P(φ)和长度项N(φ)。

3.3 能量泛函最小化
最优的活动轮廓φ∗(t)满足
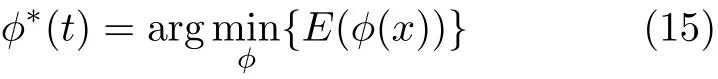
使用梯度下降法实现E(φ)对φ的最小化,有

3.4 算法步骤
算法步骤如表1所示(算法1)。

表1 基于RSF_ML模型的图像分割
4 基于RSF_ML的PET-CT肺肿瘤分割方法
针对PET-CT肺肿瘤分割中存在的缺乏将临床经验纳入算法设计的问题,本文进一步提出了基于RSF_ML的肺肿瘤融合图像分割方法。该方法借鉴专家临床勾画肺肿瘤GTV过程中融合图像的重要价值,将融合图像作为待分割图像,实现了基于RSF_ML的肺肿瘤精确分割,可以为临床提供有效的计算机辅助分割结果。方法总体框架大致可分为预处理和分割两部分,具体内容如下。
4.1 预处理
图1为预处理示意图。由于所用临床数据源是未配准的异机PET, CT数据,在分割融合图像前,首先要对异机PET, CT进行配准和融合预处理。多模态医学图像配准是融合的基础,PET, CT图像配准的本质是寻找PET图像的最优几何变换,使之与参考图像CT在空间位置上一一对应。配准后再进行融合,将具有互补信息的PET和CT图像融合成一幅图像,从而达到对目标更为精确识别和分析判决的目的。
(1) 配准:配准过程中,先进行上采样和数学形态学处理,之后再仿射配准,从而使PET和CT的像素点一一对应。如下所述:
步骤1 对168×168大小的PET源图像线性上采样至512×512大小,和CT图像尺寸一样;
步骤2 利用数学形态学方法分别去除CT和PET胸腔轮廓外的目标,为后续高质量配准和分割奠定基础。对CT,主要是去除挡板。对PET,去除图1示意的黄色圆圈内的非胸腔肿瘤目标点,减少干扰;

图1 PET, CT数据预处理:配准和融合
步骤3 以去挡板后的CT(记为ICT)为基准,将步骤 2得到的PET与ICT进行仿射配准,得到配准后的PET(记为IPET)。

4.2 PET-CT肺肿瘤分割方法
所提出的基于融合图像的RSF_ML肺肿瘤分割方法如图2所示。参考人工勾画肺肿瘤GTV的过程,结合融合图像对减少观察者本身及观察者之间肿瘤勾画差异的鲁棒性及勾画精确性,该方法将融合图像作为待分割目标,旨在较好地结合PET的高代谢信息和CT的边界信息,以提高分割精度。如图2所示,在对PET, CT多模态肺肿瘤图像进行配准及融合预处理后,本文基于所提出的RSF_ML模型,对融合图像进行分割,并将对应分割结果GTVPET-CT作为肺肿瘤分割的最终结果。
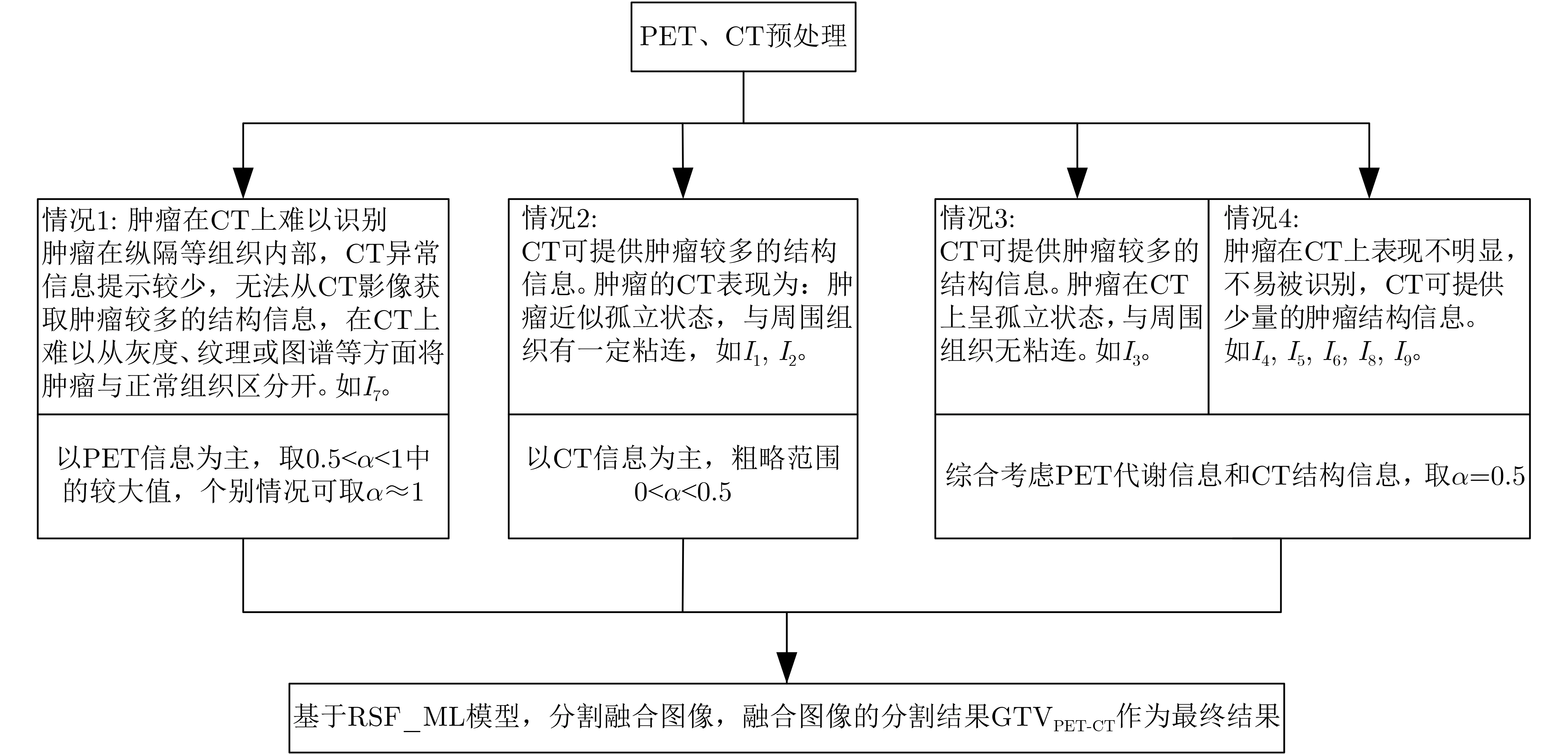
图2 基于RSF_ML模型的PET-CT肺肿瘤分割方法
5 实验与讨论
5.1 实验目的
实验目的有两个:(1) 评测所提出RSF_ML分割模型的有效性。考虑各模态及融合图像的靶区勾画结果对诊疗的不同价值,基于活动轮廓模型,对PET,CT和PET-CT融合图像进行分割,分割结果分别记为GTVPET,GTVCT和GTVPET-CT。通过实验对比,评测RSF_ML模型的分割能力。(2) 评测所提出的基于融合图像的分割方法性能。将上述3种分割结果与真值对比,对比单模态图像与融合图像之间分割结果的差异,评测基于融合图像的分割方法的有效性。
5.2 实验基本设置
实验所用数据来自法国大诺曼底地区肿瘤诊疗中心-鲁昂亨利·贝克勒尔癌症综合治疗中心,选取9组有代表性的NSCLC图像测试。9组PET和CT图像对,简记为I1-I9,如图3(a)中第1行(PET)和第2行(CT)所示。其中,PET大小为4.06×4.06 mm2,重建后对应矩阵大小为168×168;CT大小为0.98×0.98 mm2,重建后对应矩阵大小为512×512。
将所提出的RSF_ML模型与RSF模型[15]和RSF&LoG模型[17]进行对比。多数情况下参数取固定值,如λ1=λ2= 1,µ=1, r=2, Δt=0.1,其他参数根据不同图像进行调整。一般地,高斯核σ的取值与待分割肿瘤的异质程度成正比。肿瘤异质程度越大,σ应当选取的越大。参数α是一个常数,它决定了PET图像的融合加权系数。其取值根据肿瘤在CT上的表现来定(如图2示意),当肿瘤在CT上难以识别时,以PET信息为主,取0.5<α ≤1范围内较大的值,如对I7的α取0.75。当肿瘤的CT表现为近似孤立状态但与周围组织有一定粘连时,以CT信息为主,取0<α<0.5范围的值,如对I1的α取0.25,对I2的α取0.1。多数情况下,α取0.5,PET, CT各占50%的融合权重,以将PET和CT的特征均匀地融入融合图像中。
5.3 评价指标及代理真值
在主观评价基础上,本文基于Dice相似系数(Dice Similarity Coefficient, DSC)和Hausdorff距离(Hausdorff Distance, HD)客观参数指标对比各算法。DSC是基于区域的度量标准,测量分割结果和真值的区域重叠度,其值越高代表分割效果越好。基于边缘的测度HD被用来测量两个边界远离彼此的程度,其值越低代表结果与真值的形状相似度越高。一个好的分割结果应有一个较高的DSC值和一个较低的HD值。
由于待分割目标没有可用的病理学样本,则没有真值可用。本文使用代理真值衡量算法性能,基于STAPLE方法,通过加权2位专家(1位核医学科医师和1位放射科医师)的人工分割结果得到代理真值。
5.4 实验结果与分析
实验结果列于图3中。如图3(a)所示,每一列对应一组数据及分割结果;第1行是PET源图像和初始轮廓(绿色矩形框是人工选取的初始轮廓);第2行是CT源图像和金标准;第3行是融合图像分割结果的局部放大图;第4行是PET图像分割结果的局部放大图。图3(b)为CT图像分割结果的局部放大图,此处只出I1-I3的CT分割结果,是因为这几组图像(对应图2中的情况2和情况3,针对孤立或近似孤立型状态的CT肿瘤)的肿瘤边界可从CT上明显地分辨出来。对于肿瘤在CT上不可识别的情况(对应图2中的情况1和情况4),此时不便分割CT。根据图2的方法,CT不易识别时,将融合图像或PET图像的分割结果叠加在CT上即可。图3中,RSF_ML模型、RSF模型、RSF&LoG模型的分割结果分别用红色、蓝色和绿色曲线表示,金标准用黄色曲线表示。以下从主客观两方面分析实验结果。
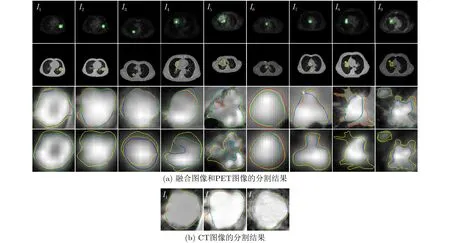
图3 PET-CT肺肿瘤图像多模态分割结果
(1) 实验结果的主观分析:主观比较各模型的整体分割结果,如图3所示,RSF_ML模型对PETCT融合图像,PET,CT三模态图像的分割基本上均达到了较满意的效果,其外形轮廓与金标准较接近,重叠度较高。除了极个别肿瘤形状复杂图像,RSF_ML模型存在微弱的欠分割(I8组的融合图像和I9组的PET图像)。RSF&LoG模型对上述三模态图像的多数分割取得了较好的效果,但对个别肿瘤形状复杂图像,如I5, I8存在一定的过分割和欠分割。RSF模型对上述三模态图像的部分分割达到了较佳效果,但对肿瘤形状复杂图像,如I5, I7, I8和I9,存在相对明显的过分割和欠分割。具体地,RSF模型和RSF&LoG模型对个别肿瘤周围正常组织或器官的“伪边缘”存在过分割(I1组的融合图像和CT图像、I5组的融合图像),对个别异质性较强的肿瘤图像存在欠分割(I5组的PET图像、I8组的融合图像和I9组的PET图像),对个别形状复杂的非类圆型肿瘤存在欠分割或过分割(I7组和I8组的融合图像)。相比而言,RSF&LoG模型的主观分割结果比RSF模型更接近真值,但其整体分割结果逊于RSF_ML模型。
主观比较各模态的实验结果,所有实验中,融合图像比单模态PET或CT图像的分割结果外形上更接近金标准。此外,图3(b)所示的CT边界清晰的孤立型病灶分割中,上述3种模型与金标准的差异较小,基于CT分割的结果比基于PET分割结果相对更精确。
(2) 实验结果的客观分析:客观参数指标方面,表2和表3分别列出了不同模态图像分割结果的DSC和HD系数,每组的最优结果加粗标示。分析上述表中结果,可以看到:(a)对比各模态的分割结果,融合图像优于单模态PET或CT的同类指标。对孤立型病灶(I1-I3),融合图像分割指标最优,CT次之,PET最差。这说明将融合图像作为待分割目标图像的方案是科学的。(b)对比各模型的分割结果可以发现,RSF_ML模型性能指标整体最优,RSF&LoG模型次之,RSF模型客观参数相对最差。RSF_ML模型在DSC和HD系数上的优越性,表明了该模型在区域和边缘两方面均与真值比较吻合,性能良好。说明了本文所提出模型的有效性。

表2 各方法的DSC
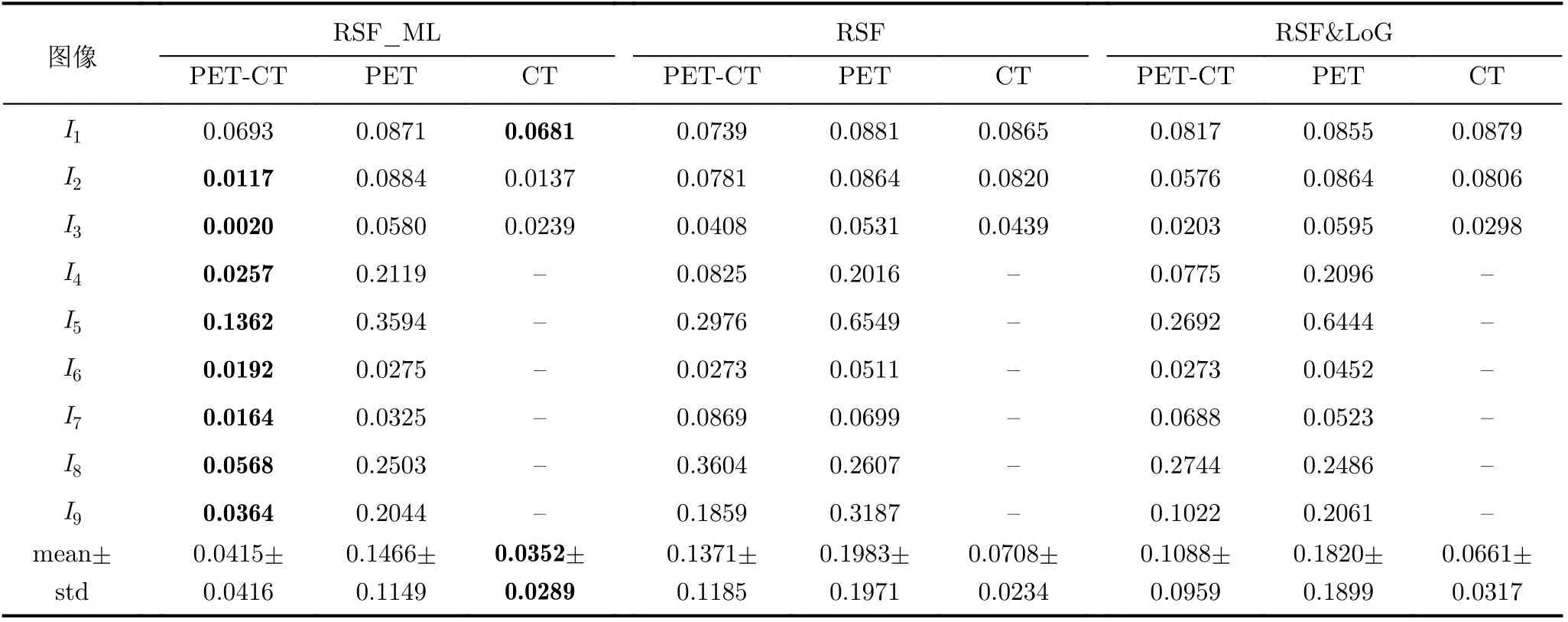
表3 各方法的HD
(3) 实验结果的综合评价:综合主客观评价,本文所提出的R S F_M L 模型性能整体最优,RSF&LoG模型次优,RSF模型表现稍逊。特别地,对于复杂形状和异质程度较大的病灶(如I5,I8和I9),本文模型RSF_ML能较好地完成分割任务。究其原因,RSF模型和RSF&LoG模型所涉及的最小距离分类准则只考虑待分类样本到各类别中心的距离,而不考虑样本的分布,导致基于这种准则的模型有时候分类精度不高。R S F&L o G模型优于RSF模型的原因在于其LoG算子能量泛函保真项在平滑图像的同时具有一定的边缘增强作用,这使得其在灰度异质图像分割的细节方面优于RSF模型,但该模型未考虑实际数据的先验信息及实际临床医学数据的复杂性,因此其应用具有一定的局限性。本文所提出模型考虑了样本的分布,而不仅仅是距离,所提出模型的EML数据项对应的距离是标准欧氏距离(I(x)−µi(x))2/(2σi2(x)),这种利用标准欧氏距离来衡量误差的做法,相当于对数据有一种“标准化”的作用,当数据存在异常值或较多噪声时,这种“标准化”处理方式可以减少异常值和极端值的影响。解释是:通常异常值I(x)偏离其类中心µi(x)较远,此时其对应方差σi2(x)较大。若利用上述标准欧氏距离,方差的倒数相当于加权系数,方差大的加权权重小,则可大大减少异常值和极端值的影响。而数据项ERSF对应的是加权的非标准欧氏距离λiwσ(y −x)[I(x)−µi(y)]2。所以,对复杂的异质病灶,数据项EML的处理能力理论上优于ERSF。ERSF相比EML的优势在于其加权系数为自适应高斯核函数wσ(·),由于该核函数的作用,相当于对原图像实施了高斯低通滤波,这在一定程度上增强了模型对抗图像灰度不均匀性的能力,代价是高斯核涉及的卷积运算带来的低效率。本文将待处理目标看作复杂异质形状和灰度不均匀等因素的结合体,通过线性加权EML和ERSF将上述两种距离准则结合起来,可以很好地融合二者的优势。
6 结 论
本文提出了一种基于RSF模型和最大似然准则的混合活动轮廓模型RSF_ML,该模型将PET图像高斯概率分布先验纳入建模考虑,建立了基于最大似然准则的能量泛函数据项EML。EML本质是利用标准欧氏距离来衡量误差,当数据存在异常值或噪声时,基于标准欧氏距离的误差可以减少异常值和极端值的影响。RSF_ML模型将待处理目标看作灰度不均匀和复杂异质形状的组合体,结合RSF模型分割灰度不均匀图像的优势,以及最大似然数据项EML处理复杂形状目标的能力,可以对形状复杂、灰度异质的图像实现高质量分割。
本文在RSF_ML模型基础上,将有效结合PET代谢信息和CT结构信息的融合图像作为待分割目标,进一步实现了基于融合图像的NSCLC肺肿瘤分割。由于兼并考虑了待处理数据分布先验、灰度异质处理能力、专家临床诊断模式和人工勾勒肺肿瘤GTV的经验等因素,所提出方法可实现肺肿瘤的精确分割,可以为临床诊疗提供高质量的计算机辅助分割结果。
