1例SMARCA4胚系变异卵巢高钙血症型小细胞癌的综合治疗和遗传咨询
2022-01-01康茗贻马凤华谭灏文徐丛剑
郜 意 ,康茗贻 ,王 辉,胥 婧 ,石 月,陶 祥,马凤华,谭灏文,康 玉,徐丛剑,
1.复旦大学附属妇产科医院妇科,上海 200011;
2.上海市女性生殖内分泌相关疾病重点实验室,上海 200011;
3.复旦大学附属妇产科医院护理部,上海 200011;
4.复旦大学附属妇产科医院病理科,上海 200011;
5.复旦大学附属妇产科医院放射科,上海 200011;
6.江西合因教育科技有限公司,江西 赣州 342604;
7.复旦大学上海医学院妇产科学系,上海,200032
卵巢高钙血症型小细胞癌(small cell carcinoma of the ovary,hypercalcemic type,SCCOHT)是一种罕见的预后极差的卵巢恶性肿瘤,多见于年轻女性。SMARCA4基因的有害变异是90%SCCOHT患者的致病驱动因素,其中约43%的变异为胚系变异,可在家族中遗传[1]。迄今为止,全球文献报道的SCCOHT病例不到600例。目前尚无统一的治疗方案及携带者管理共识。本文报道1例SMARCA4胚系变异的SCCOHT患者的治疗过程及其家系遗传咨询,并结合文献讨论,为SCCOHT的临床诊疗和SMARCA4致病变异携带者亲属的预防管理提供参考。
1 临床资料
患者,女性,29岁,因“乏力伴恶心呕吐1个月”于2019年9月入院检查,磁共振成像(magnetic resonance imaging,MRI)检查发现盆腔直径约20 cm的肿物。术前肿瘤标志物:糖类抗原125(carbohydrate antigen 125,CA125)131.00 U/mL(参考值0~ 35 U/mL),CA19-9 40.95 U/mL(参考值0~ 37 U/mL)。9月12日行右侧附件切除术,术中快速冷冻切片病理学检查提示恶性肿瘤,遂行开腹卵巢恶性肿瘤瘤体减灭术(广泛全子宫切除术+双附件切除术+大网膜切除术+阑尾切除术+盆腔淋巴结清扫术+大网膜切除术),达到R0切除。术后多家医院病理学会诊:(右侧)SCCOHT,腹主动脉旁淋巴结1/4包膜下转移(图1A、B)。免疫组织化学检测:AE1/AE3(-),EMA(-),FOXL2(-),CCND1(-),Ki-67(+,40%),Inhibin-α(-),Calretinin(-),SMARCA4(-),WT-1(+),LCA(-)(图1B)。肿瘤组织和血液基因检测:SMARCA4第25个外显子变异(c.3546+2T >C)。最终明确诊断为SCCOHT(T3aN1M0ⅢA1期)。

图1 病理学诊断Fig.1 Pathological diagnosis
2019年9月26日患者术后CT提示右盆壁包裹性积液(6.3 cm×4.9 cm)。10月28日正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)提示盆腔多发结节灶(φ5 cm)及增大淋巴结,腹膜后、右侧腹股沟区增大淋巴结,代谢高,考虑转移(图2A、B、C)。11月15日开始行PAVEP方案化疗:顺铂100 mg(80 mg/m2)+表阿霉素50 mg(40 mg/ m2),第1天;依托泊苷100 mg(75 mg/m2)+环磷酰胺400 mg(300 mg/ m2),第1~ 3天。患者在第1次化疗后发生Ⅳ度骨髓抑制:白细胞1.00×109/L,血红蛋白94 g/L,血小板161×109/L,嗜中性粒细胞0.22×109/ L,嗜中性粒细胞占比23%。遂入院给予重组人粒细胞集落刺激因子升白细胞,定期复查血常规,白细胞逐步升高,12月4日血常规显示:白细胞12.18×109/L,血红蛋白100 g/ L,血小板107×109/L,嗜中性粒细胞9.45×109/L,嗜中性粒细胞占比78%。12月7日行第2次化疗,无明显化疗不良反应,出院给予聚乙二醇化重组人粒细胞集落刺激因子预防性升白细胞。第3次化疗后MRI评估:盆腔左侧肿物大小为9 mm×6 mm,达到部分缓解(partial response,PR)。2020年3月11日化疗第6个周期结束后病灶基本消失,评估为完全缓解(complete response,CR)。2020年4月16日起,患者进行干细胞动员,给予环磷酰胺3.5 g化疗2 d;4月20日起给予粒细胞集落刺激因子10 μg/kg,连续静脉滴注1周;1周后顺利采集干细胞,有核细胞计数27.40×108/kg,CD34+3.6×106/kg;6月5日起行自体干细胞移植:预处理予卡铂500 mg(总量1 900 mg,316.7 mg/ m2/d),VP-16(总量2 000 mg,333.3 mg/ m2/ d),环磷酰胺2 g(总量7.5 g,1.25 mg/ m2/ d),移植前3~ 5天;环磷酰胺1.5 g,移植前2天,期间联合可乐必妥、伐昔洛韦预防感染;回输自体造血干细胞,共回输单个核细胞98.95×109,CD34+1.69%(患者体重48.5 kg,单个核细胞20.4×108个/kg,CD34+3.45×106/kg),细胞活性达91.87%,过程顺利,移植当天;后予重组人粒细胞集落刺激因子、重组人血小板生成素促进造血干细胞植入,同时进行止泻、预防出血、输血支持等治疗;回输后第11天患者嗜中性粒细胞达1.79× 109/L,一般情况好转。2020年8月1日盆腔增强MRI未见明显病灶,评估为CR(图2D)。
2020年10月PET/CT示:盆腔、肠系膜、腹腔种植转移(8.8 cm×6.3 cm)。遂行腹盆腔病灶切除术+结直肠吻合术+小肠部分切除术,术后病理学检查提示SCCOHT转移/复发。术中留取转移灶组织通过迷你患者来源的异种移植瘤(mini-patient-derived xenograft,mini-PDX)模型进行药物敏感性筛选,相对敏感的药物依次为紫杉醇+卡铂、CDK4/6抑制剂(帕博西尼)、酪氨酸激酶抑制剂(普纳替尼)、EZH2抑制剂(他泽司他)、血管内皮生长因子受体酪氨酸激酶抑制剂(阿帕替尼)、组蛋白去乙酰化酶抑制剂(西达苯胺)、多聚腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂(奥拉帕利),肿瘤的相对增殖率分别为39%、57%、61%、64%、67%、>100%、>100%(图3)。考虑到先前PAVEP方案中含有顺铂,可能出现耐药情况,且有病例报道CDK4/6抑制剂联合程序性死亡[蛋白]-1(programmed death-1,PD-1)单抗在复发性SCCOHT中效果良好[2],我们为患者选择于2020年11月18日和12月21日行帕博利珠单抗200 mg静脉滴注肿瘤免疫治疗联合帕博西尼(100 mg,连续口服2周,停药1周)治疗,末次口服靶向时间为2021年1月4日。2020年12月28日复查盆腔增强MRI:多发占位性病变较治疗前明显增大,遂于2021年1月8日调整治疗方案为“紫杉醇+卡铂+贝伐”,具体剂量:第0天贝伐珠单抗750 mg(15 mg/kg)静脉滴注,第1天紫杉醇200 mg(135 mg/m2)静脉滴注,第1天卡铂600 mg(曲线下面积为5)静脉滴注,每3周1次。3个周期后,疗效评估为PR。2021年4月患者盆腔病变进展。后续尝试了选择性动脉栓塞术+顺铂动脉灌注化疗、帕博利珠单抗免疫治疗联合仑伐替尼靶向治疗等,但疗效甚微,最终于2021年8月去世,总生存期为23个月(图2A)。
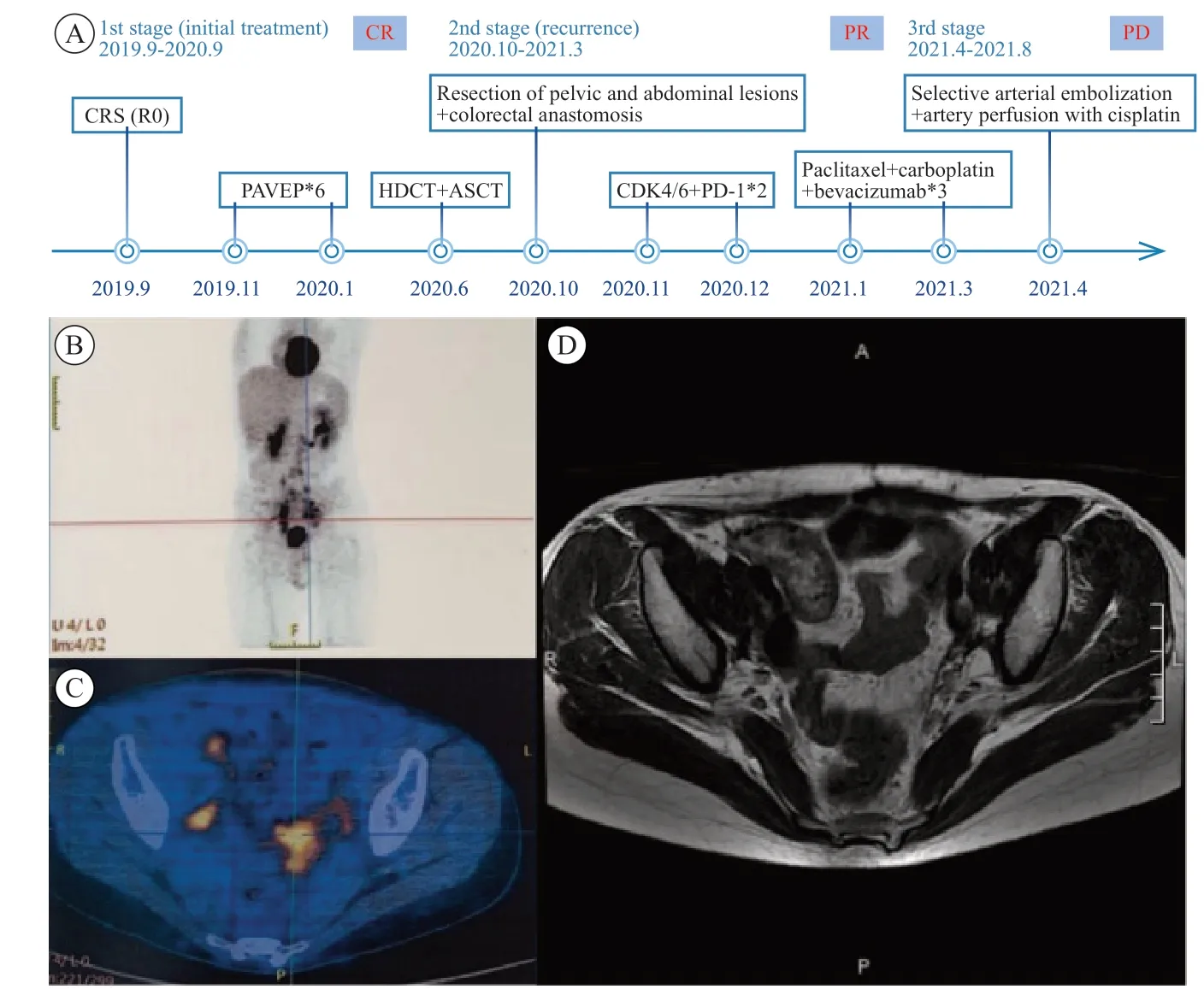
图2 患者的治疗过程和影像学检查结果Fig.2 Patient’s course of treatment and imaging examination
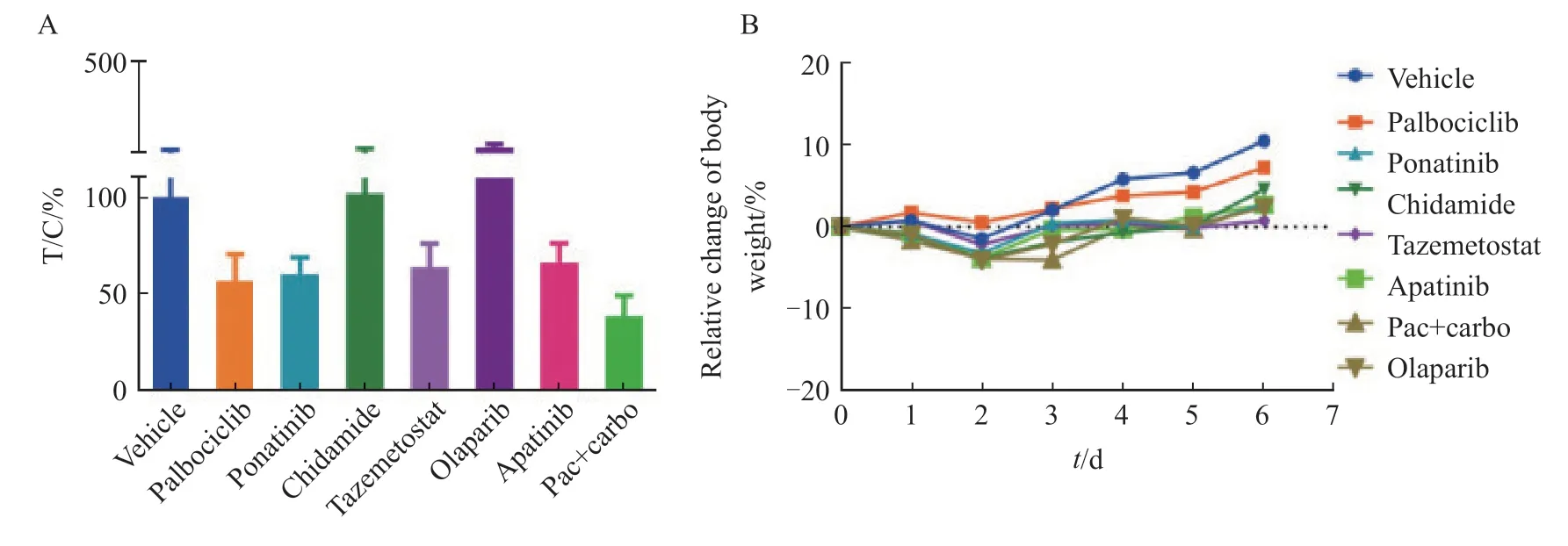
图3 Mini-PDX药物敏感性筛选结果Fig.3 Drug sensitivity assay tests of mini-PDX
患者已婚,育有2女。大姨65岁被诊断为小细胞肺癌。因患者存在SMARCA4胚系变异,故对其家族30人(包括先证者)进行Sanger测序验证,发现其2个女儿(分别为2岁和5岁)、母亲、三姨均携带变异(图4),遂为携带者提供遗传咨询建议:
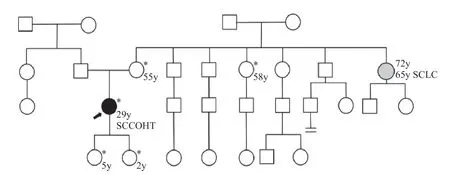
图4 患者家系图Fig.4 Patient’s pedigree
⑴ 患者的母亲和三姨均具有胚系SMARCA4变异,因此有患SCCOHT的风险,可行预防性双侧输卵管卵巢切除术(risk-reducing bilateral salpingo-oophorectomy,RRBSO);且有患未分化子宫肉瘤的风险,可以考虑同时予预防性子宫切除[3]。但鉴于已报道的SCCOHT年龄大多为5~ 46岁[1],绝经后发病率较低,且两人均已超过50岁,并已经绝经,建议权衡利弊后考虑预防性切除。
⑵ 患者的两个女儿(姐姐5岁,妹妹2岁)均具有胚系SMARCA4变异,建议在月经初潮后进行遗传咨询,可以考虑在生长发育完成后(18岁之前)行RRBSO,与此同时可以进行生育力保存(如卵母细胞冷冻或卵巢组织冻存)[1,4-5]。在完成预防性切除后可在随访监测下进行激素替代治疗,改善生活质量。后期如有生育要求,建议采取“三代试管”,完成植入前基因诊断。同时需告知虽然在国外卵母细胞冷冻及卵巢组织冻存有相对较多自然分娩的成功案例,但中国尚处于起步阶段。长期激素替代治疗可能会增加乳腺癌的患病风险(尚不确定)。并告知10余年后医学对于SMARCA4变异可能会有更深入的认知,处理可能会有所进步。
⑶ 对于没有进行RRBSO的携带者建议每半年进行妇科B超+CA125+血清钙联合检查[5-6]。
⑷ 女儿在3岁前尚有患横纹肌样肿瘤的风险,由于发生率低,不提供相关筛查建议[5]。
2 讨论
SCCOHT极为罕见且发病年龄较早,平均发病年龄23.9岁,范围5~ 46岁,约2/3的患者出现高钙血症[7]。大部分SCCOHT患者发现时即为晚期,会在短时间内复发并死亡,1年总生存率约为50%,5年总生存率低于10%,中位生存期为14.9个月,早期患者的长期存活率也仅为33%[7-11]。
SCCOHT的罕见性导致前瞻性研究较少,目前的治疗手段主要包括根治性手术、化疗和放疗。对于各个期别的患者均推荐辅助化疗,通常是基于顺铂和依托泊苷的联合方案(如BEP、VPCBAE、PAVEP)。2018年发布的ESMO临床实践指南[12]建议SCCOHT化疗达到CR后,进行高剂量化疗(high-dose chemotherapy,HDCT)+自体干细胞移植(autologous stem cell transplantation,ASCT)来延长生存时间(证据水平:Ⅱ;推荐等级:C)。本案患者也使用了PAVEP方案以及HDCT+ASCT,成功缓解并持续数月,佐证了该方案在SCCOHT初治患者中的应用潜力。
SCCOHT极易复发,且进展迅速,复发治疗面临巨大挑战。近年来的研究揭示了SCCOHT的驱动变异来自SMARCA4的致病变异,超过90%的病例缺失正常的SAMRCA4蛋白。围绕靶向SMARCA4变异的药物研究也应运而生,目前SCCOHT的潜在治疗药物主要有:①表观遗传药物,如EZH2抑制剂[13]、组蛋白去乙酰化酶抑制剂[14]、赖氨酸特异性组蛋白去甲基化酶1抑制剂[15];② 激酶抑制剂,如酪氨酸激酶抑制剂[16]、CDK4/6抑制剂[17];③免疫治疗,如PD-1单抗[18]。尽管SCCOHT的低突变负荷不符合免疫检查点阻断疗法的用药指证,但有研究[19]表明,PD-1抑制剂在之前接受细胞毒性化疗及放疗后的SCCOHT复发患者中呈现显著且持久的反应。对于进展迅速的SCCOHT,如何在短期内挑出适合患者的药物成为临床诊疗的关键点。本案通过mini-PDX进行药物敏感性筛选,这是一种将患者肿瘤细胞通过一个特殊装置移植在免疫缺陷小鼠身上,在1周内检测多种药物及药物组合对肿瘤细胞的杀伤比例的模型[20],可为临床用药提供指导依据,减少盲目试药的周期。本研究的患者在尝试了CDK4/6抑制剂联合免疫治疗后虽然没有达到缓解,但是与文献报道的Ⅲ期患者中位生存时间只有10.4个月相比[8],二次手术配合mini-PDX选药与靶向治疗的确延缓了肿瘤的进展,延长了患者的寿命。
对于SMARCA4胚系变异的患者,其家系也应该进行基因检测和遗传咨询,从而为预防和早期诊断提供依据。以本研究的患者为例,我们对其进行胚系(血液)和体系(肿瘤组织)的基因测序,发现患者携带SMARCA4(NM_001128849.3):c.3546+2T>C胚系杂合变异,该变异为经典剪接变异(IVS25+2T>C),预期导致25号外显子的跳跃,该变异在基因组聚合数据库等自然人数据库中没有携带,患者的SCCOHT临床表型与SMARCA4高度符合,结合以上证据该变异评级为可能致病变异。
SMARCA4胚系致病变异将导致两种常染色体显性遗传病:Coffin-Siris综合征4型和横纹肌样肿瘤易感综合征2型。前者是一种先天性畸形综合征,后者则是一种癌症易感综合征,会增加发生SCCOHT、恶性横纹肌瘤(malignant rhabdoid tumors,MRT)和非典型畸胎样/横纹肌样肿瘤(atypical teratoid/rhabdoid tumors,AT/RT)的风险[5]。此外,现在还认识到胚系SMARCA4变异会增加患未分化子宫肉瘤的风险[3]。约55%的SMARCA4胚系有害变异携带者在生命的第3个10年,会发展为恶性肿瘤,主要为SCCOHT,到第4个10年,发病概率将达到80% 以上[3]。
考虑到SCCOHT早期发生肿瘤的高风险,尚无标准的筛查、治疗方式,即使疾病早期也具有高死亡率,与激素替代治疗和生育力保存手段的可及性等这些因素相比,不少学者认为RRBSO更能有效地防止SMARCA4胚系有害变异携带者SCCOHT的发生,但其益处仍有待证实[19]。由于SCCOHT的罕见性,胚系SMARCA4有害变异的外显率难以估计,因而无法确定预防性手术的最佳时间。对于青春期前携带者,有文献认为可以考虑在月经初潮前进行预防性双侧卵巢切除术[21],但此时卵巢功能尚未成熟,无法进行卵母细胞采集和冷冻保存,不过可以将子宫留在原位以备后续使用供体卵母细胞妊娠,然而有研究[5]仍建议在青春期之后再考虑预防性手术;对于青春期携带者,有学者认为可以参考Swyer综合征的预防,考虑在生理发育完成之后(可能在18岁之前)进行性腺切除手术,并进行卵母细胞冷冻保存[1,4-5];而对于已完成生育的携带者或年龄超过30岁的女性,可以考虑RRBSO和子宫切除术或密切的子宫内膜监测以降低未来患SCCOHT和未分化子宫肉瘤的风险[3]。文献报道过进行RRBSO的SMARCA4胚系变异携带者:1例是有3位女性亲属均在30岁前被诊断为SCCOHT(其中2位死于该疾病)且已生育3个孩子的33岁女性[21];另1例为母亲(26岁)和阿姨(17岁)均因SCCOHT去世的13岁女孩[6]。国际SCCOHT联盟建议没有个人史和家族史的携带者仍需谨慎考虑预防性手术;对于有家族史和个人史的携带者,在进行预防性手术前需要深入讨论肿瘤早期发病的高风险与长期激素替代治疗的利弊,此外还需知情生育力保存方式,包括卵母细胞冻存和植入前遗传学诊断等内容[19]。本研究患者的两个女儿年纪尚幼,可以考虑在月经初潮后进行遗传咨询并讨论上述方案,决定是否早期手术干预以降低风险,并为保留生育能力留出时间。另外,MRT和AT/RT常见于1~ 3岁儿童,尤其是1岁以内,但整体在脑部和腹部发生肿瘤的风险较低,无需特殊筛查[5]。
SCCOHT作为一种罕见的高侵袭性恶性肿瘤,常规治疗手段不足以应对该疾病的高复发率和快速进展,同时其具有特征性基因突变,易在家族中遗传。因此临床管理一方面应重视包括妇科肿瘤、分子病理、遗传咨询、辅助生殖在内的多学科协作以达到最合理的治疗和遗传学阻断,同时也应通过各医疗机构的多中心合作研究以优化治疗策略,重视SMARCA4驱动肿瘤形成的机制研究及靶向药物的研发。SCCOHT可以作为一个跨学科的病例管理模型,为复杂罕见肿瘤的临床管理提供宝贵经验。
利益冲突声明:所有作者均声明不存在利益冲突。
