血浆外泌体中的CD48蛋白作为潜在的肝细胞癌诊断标志物的研究
2022-01-01成意财杜振华范志娟曹鹏博周钢桥
成意财,杜振华,范志娟,冯 岚,曹鹏博,周钢桥
1.南华大学衡阳医学院,湖南 衡阳 421000;
2.军事科学院军事医学研究院辐射医学研究所,蛋白质组学国家重点实验室,国家蛋白质科学中心,北京 100850;
3.天津市武警特色医学中心检验科,天津 300160;
4.天津市第三中心医院医学重点学科(专科),天津 300170
世界卫生组织2020年发布的全球癌症数据显示,原发性肝癌是全球发病率排名第6位、死亡率排名第3位的消化系统恶性肿瘤[1]。其中,肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的75%~85%[1]。在中国,乙型肝炎病毒(hepatitis B virus,HBV)感染是与HCC的发生、发展相关的最主要风险因素,约有85%的HCC患者有HBV感染史[2]。超过70%~80%的患者确诊时已是中晚期,并且晚期HCC切除术后的5年复发转移率高达40%~70%[3]。最近研究[4]显示,若能实现HCC的早期诊断,可将患者的5年生存率提高到50%~75%。因此,研发更为有效的HCC诊断方法或策略,提高高危人群的早诊率,将有望提高HCC患者的生存率。
外泌体是一种直径为40~200 nm、由细胞内多囊泡胞内体(multi-vesicular endosome,MEV)成熟过程中膜向内出芽形成的具有脂质双分子层的腔内小泡[5]。近年来的研究[6-7]发现,外泌体中包含的蛋白质、核酸和脂类物质等可以作为癌症的诊断和(或)预后标志物,具有潜在的临床应用价值。本研究旨在通过HCC患者血浆外泌体的高通量蛋白质组学定性和定量分析,系统筛选可能作为HCC诊断的蛋白质标志物,并在独立的HCC人群队列中对其潜在的诊断价值进行验证。
1 材料和方法
1.1 材料
1.1.1 研究人群及其样本采集
研究人群包括发掘人群和验证人群。其中发掘人群包括4例HCC患者和4名健康对照着(healthy control,HC),验证人群包括56例HCC患者、20例肝硬化(liver cirrhosis,LC)患者和48名HC(表1)。HCC的诊断标准参照美国肝病研究协会(American Association for the Study of Liver Diseases,AASLD)指南[8]。HCC的分级参照巴塞罗纳临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分级系统[9]。LC通过病理学活检或两种影像学检查(超声检查合并计算机体层成像或磁共振成像)确诊。HC为无肝病或其他系统性疾病史的个体。上述HCC、LC和HC的外周静脉全血样本均于2018年8月1日—2019年9月1日在天津市第三中心医院采集。采集所有研究对象的外周静脉全血4 mL,然后,在4 ℃条件下500×g离心10 min,收集血浆,立即储存于-80 ℃超低温冰箱中用于后续实验。所有研究对象均签署知情同意书。本研究由天津市第三中心医院伦理委员会审查批准。
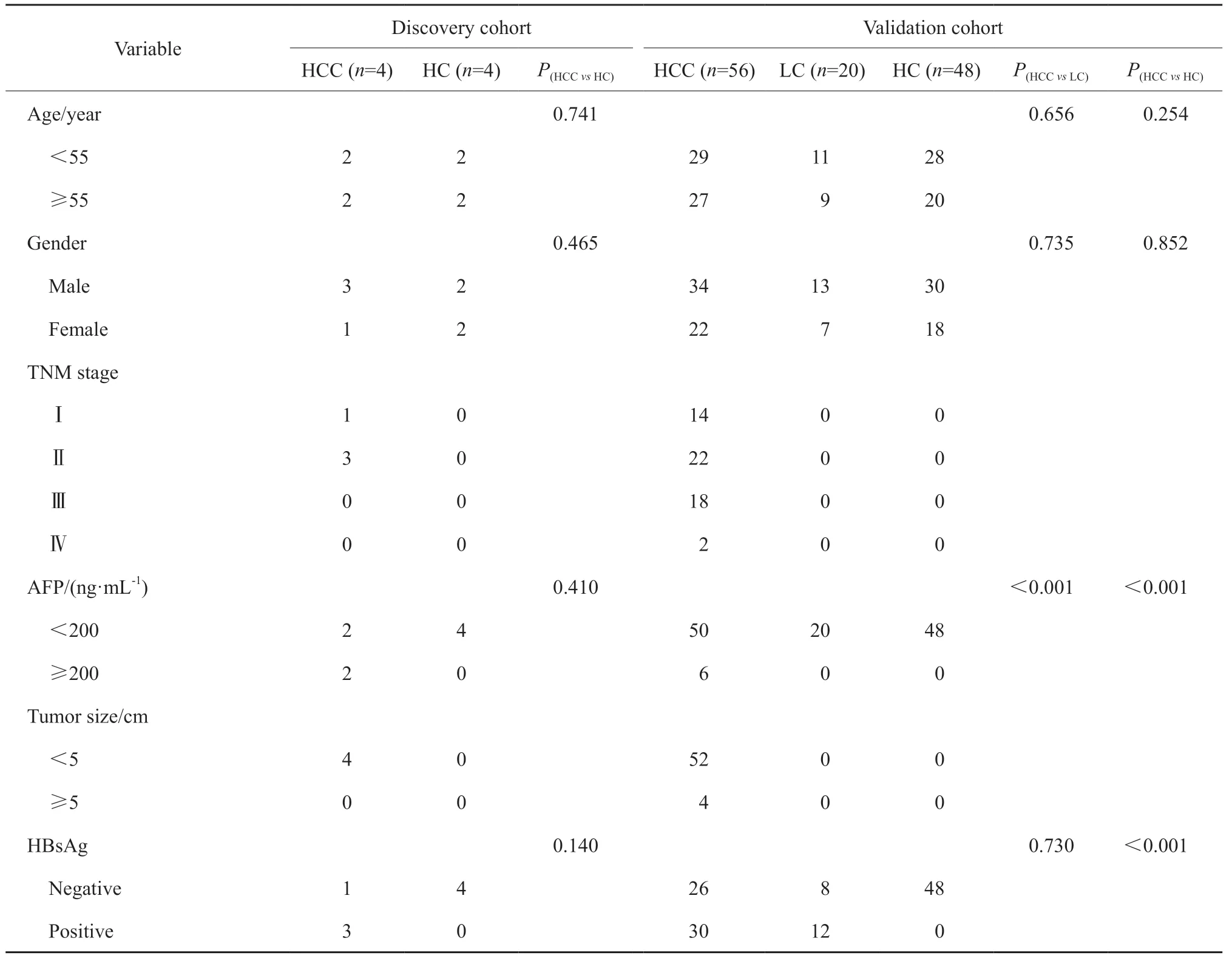
表1 研究对象的临床特征Tab.1 Clinical characteristics of participants
1.1.2 主要实验试剂
抗兔免疫球蛋白G(immunoglobulin G,IgG)-辣根过氧化物酶(horseradish peroxidase,HRP)购自江苏康为世纪生物科技股份有限公司,FLOT1抗体、兔抗CD48抗体均购自英国Abcam公司,抗鼠IgG-HRP、二辛可宁酸(bicinchoninic acid,BCA)试剂盒、蛋白预染Marker、抗荧光淬灭封片液及电化学发光(electrochemical luminescence,ECL)液均购自美国Thermo Fisher Scientific公司,CD63抗体和CD48蛋白标准品购自美国Proteintech公司,鼠抗CD48购自美国R&D Systems公司,马血清购自美国Gibco公司,LipofectamineTM2000购自美国Invitrogen公司,二硫代苏糖醇、碘乙酰胺、重碳酸盐三乙铵均购自美国Sigma公司,多聚甲醛溶液购自中国医药集团有限公司,胰蛋白酶购自美国Promega公司。
1.1.3 主要实验仪器
96孔酶标板和Orbitrap Fusion质谱仪购自美国Thermo Fisher Scientific公司,超纯水系统购自德国Merck Millipore公司,医用超低温冷冻冰箱购自海尔集团,离心机购自德国Eppendorf公司,尺寸排阻色谱柱购自新西兰Izon公司,透射电子显微镜购自日本HITACHI公司,纳米粒子跟踪分析仪购自德国Particle Metrix公司,激光扫描共聚焦显微镜购自美国GE Healthcare公司,SunriseTM酶标仪购自瑞士Tecan公司。
1.2 方法
1.2.1 血浆外泌体的分离纯化
采用尺寸排阻色谱法提取血浆中的外泌体,具体方法如下:首先,在4 ℃条件下,将500 μL血浆样本依次1 500×g离心10 min、10 000×g离心20 min,留取上清液。然后,将离心后的血浆加注到qEV外泌体分离柱中,通过缓冲液洗脱收集第7~9馏分(0.5 mL/馏分)。合并馏分后,在4 ℃条件下140 000×g离心4 h,去上清液。最后,用60 μL磷酸缓冲盐溶液(phosphate-buffered saline,PBS)重悬外泌体颗粒、备用。
1.2.2 外泌体的鉴定
1.2.2.1 外泌体的透射电子显微镜检测
滴加上述20 μL分离纯化的外泌体悬液于载物铜片上,室温静置10 min,用滤纸吸干。然后,滴加10 μL的4%磷钨酸溶液负染90 s,在白炽灯下烤干。最后,采用透射电子显微镜观察血浆外泌体的形态。
1.2.2.2 外泌体蛋白的提取及定量
取20 μL外泌体悬液,加入180 μL蛋白裂解液,冰上静置5 min,涡旋振荡。在4 ℃条件下12 000 r/min离心15 min后留取上清。采用BCA试剂盒测定蛋白质的浓度。
1.2.2.3 蛋白质印迹法(Western blot)检测蛋白质水平
取25 μg外泌体蛋白上样,Western blot温育、电泳后转移至PVDF膜上,5%脱脂牛奶封闭2 h。Western blot温育一抗为anti-FLOT1(1∶1 000,ab41927)和anti-CD63(1∶1 000,25682-1-AP),4 ℃温育过夜,第2天洗涤3次,然后与相应种属的二抗(CW0102M)室温温育1 h,最终显影、拍照,并分析结果。
1.2.2.4 外泌体的粒径分析
取20 μL分离纯化的外泌体悬液,用PBS(经0.22 μm孔径的滤膜过滤)稀释成1 mL,用1 mL注射器向样品池缓慢上样。采用纳米粒子跟踪分析仪检测外泌体的大小。
1.2.2.5 外泌体蛋白的酶解
首先,采用放射免疫沉淀裂解液(10 μL蛋白酶抑制剂和10 μL磷酸酶抑制剂)裂解外泌体悬液,得到总蛋白。冰冻20 min后在冰上超声 2 min,然后14 000×g离心10 min,收集上清液。随后,将每个样品提取物(20 μg蛋白质)用 5 mmol/L的二硫代苏糖醇在37 ℃下还原1 h,再在室温、避光条件下用20 mmol/L碘乙酰胺烷基化10 min。处理后的样品用25 mmol/L重碳酸盐三乙铵稀释4倍,然后,在37 ℃条件下下用胰蛋白酶(V528A)消化过夜。最后,置于冷冻干燥机装置中干燥样品。
1.2.3 质谱分析
通过液相色谱质谱联用分析平台进行蛋白质组学分析,将每个样品重新溶解于缓冲液A(20%乙腈和0.1%甲酸)中,并将其装入UHVPenning IKR270短分析柱(内径75 μm,孔径100 Å)中,以12 μL/min的流速分离4 min(缓冲液B:0.1%甲酸和100%乙腈)后,再以0.3 μL/ min的恒定流速运行洗脱梯度(洗脱0~11 min,4%~10%缓冲液B;洗脱11~88 min,10%~25%缓冲液B;洗脱88~98 min,25%~50%缓冲液B;洗脱98~102 min,50%~99%缓冲液B)分离多肽。质谱仪在2 kV电喷雾下以正极性非数据依赖性采集模式下运行,全扫描模式[质荷比(m/ z)范围为250~1 450],每次扫描后进行30次二级扫描,35%标准碰撞能量,动态排除时间为15 s。
对采集的质谱数据,通过Spectronaut软件(瑞士Biognosys公司)以UniProtKB/Swiss Prot(2018年8月发布,包含73 645条序列)为参考进行蛋白质鉴定。搜索条件设置为:最多允许2个胰蛋白酶漏切位点,氨基甲基化设置为固定修饰,乙酰化和氧化设置为可变修饰,其他参数使用默认设置。蛋白质鉴定的标准为:至少检测到3个特征肽段,P<0.05,假阳性率小于1%。
1.2.4 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)
采用购自中国台湾亚诺法生技股份有限公司的ELISA试剂盒,按照说明书检测血浆中甲胎蛋白(alpha-fetoprotein,AFP)的表达水平。过程如下:①将血浆样本稀释液和蛋白质标准品依次加入反应孔中,温育后清洗;② 向每孔中加入生物素化检测抗体,温育后清洗;③向每孔中加入亲和素HRP,温育后清洗;④ 向每孔中加入3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB),其在HRP的催化下产生蓝色产物,加入酸性停止液后变成黄色;⑤ 采用SunriseTM酶标仪在450 nm处读取反应信号。
采用建立的ELISA方法检测外泌体中CD48蛋白的表达水平,过程如下:①在96孔酶标板中包被100 μL鼠抗人CD63单克隆抗体(1∶1 000,67605-1-Ig),4 ℃温育过夜后洗涤、拍干水珠;② 向每孔中加入200 μL含0.05%吐温-20的5%脱脂奶粉溶液,室温温育2 h后洗涤、拍干水珠;③向每孔中加入100 μL血浆样本和蛋白标准品,37 ℃下温育2 h后洗涤、拍干水珠;④ 向每孔中加入100 μL兔抗人CD48多克隆抗体(1∶500,ab134049),37 ℃温育2 h后洗涤、拍干水珠;⑤ 向每孔中加入100 μL结合HRP的羊抗兔IgG多克隆抗体(1∶1 000;ab205718),37 ℃温育1 h后洗涤、拍干水珠;⑥ 向每孔加入90 μL TMB,室温下温育15 min后,每孔加入50 μL终止液(2 mol/ L H2SO4);⑦ 采用SunriseTM酶标仪在450 nm处读取反应信号。
1.2.5 免疫荧光
首先,取20 μL分离纯化的外泌体与500 μL 2%的多聚甲醛溶液混合,并滴加在盖玻片上固定20 min,用PBS洗涤2次,使用5%马血清封闭外泌体30 min,用PBS洗涤2次;其次,在盖玻片上加入400 μL的鼠抗人CD48单克隆抗体(1∶40,MAB36441)温育20 min,用PBS洗涤2次;然后,在盖玻片上加入400 μL的山羊抗小鼠IgG(1∶200,A28175)温育20 min,用PBS洗涤2次;随后,在盖玻片上加入400 μL的抗荧光淬灭封片液;最后,在激光扫描共聚焦显微镜下观察拍照。仅用山羊抗小鼠IgG处理的外泌体作为对照。
1.3 统计学处理
采用R4.1.2和GraphPad Prism 8.0软件对数据进行分析。采用χ2检验或Fisher精确检验比较分类变量的组间差异。采用Mann-Whitney检验比较各组间血浆外泌体中的蛋白质表达水平的差异,并采用Benjamin-Hochberg进行多重检验校正。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估候选标志物的诊断效能。使用Youden指数计算ROC曲线的最佳切点,并将其作为截断值,计算相应的灵敏度和特异度。P(双侧检验)<0.05为差异有统计学 意义。
2 结果
2.1 血浆外泌体的分离和鉴定
首先采用尺寸排阻色谱法提取发掘人群中4个HCC和4个HC个体的血浆外泌体,并分别采用纳米粒径分析、透射电镜分析和免疫印迹分析评估所提取的外泌体质量。纳米粒子跟踪分析结果显示,富集到的外泌体直径为30~150 nm,其粒径峰值约为72.25 nm,浓度约为2.19×109particles/mL(图1A)。通过透射电镜分析可以清晰地观察到血浆外泌体的大小在40~150 nm之间(图1B),形状如“茶托形”或“椭圆形”,与外泌体的形貌特征相符。免疫印迹分析显示,所富集的外泌体高表达特异性标志物FLOT1和CD63(图1C)。上述结果表明,本研究分离富集到了高质量的血浆外泌体颗粒。

图1 提取的血浆外泌体的质量评估Fig.1 Quality evaluation of the extracted plasma exosomes
2.2 血浆外泌体的蛋白质组学分析
为绘制HCC血浆外泌体的蛋白质组学图谱,本研究提取血浆中的外泌体,进而采用鸟枪法策略和非数据依赖性采集方式进行全蛋白质组的高通量质谱检测。经质控过滤、数据归一化及蛋白质定性和定量分析(图2A),共鉴定到1 434种蛋白质。其中,20种蛋白质为已知的外泌体表面的特征性标志物,其表达丰度在所有鉴定的蛋白质中排名靠前(图2B)。在HCC组和HC组中分别鉴定到1 226和1 346种蛋白质(图2C),两组之间有1 138种共有的蛋白质。对鉴定到的1 434种蛋白质与外泌体数据库ExoCarta和Vesiclepedia(图2D)进行比对,结果显示,有83.1%的蛋白质是外泌体蛋白质,进一步提示本研究富集到了高质量的血浆外泌体。

图2 血浆外泌体蛋白与外泌体数据库ExoCarta和Vesiclepedia的比对结果Fig.2 Comparison of plasma exosomal proteins with the ExoCarta and Vesiclepedia databases
2.3 血浆外泌体中与HCC相关的候选蛋白质标志物的鉴定
为鉴定HCC组和HC组的外泌体蛋白质组是否存在差异,首先进行主成分分析。结果显示,血浆外泌体蛋白质组可以将HCC组和HC组显著分开(图3A),提示HCC发生时血浆外泌体发生了显著变化。
为确保分析结果的可靠性,本研究只保留至少在2个样本中被检测到的蛋白质,并采用K最邻近(K-nearest neighbor,KNN)法对缺失值进行填充。最终,HCC组和HC组中分别保留了1 056和1 186种蛋白质用于后续分析(图3B)。进一步通过蛋白质差异表达分析,发现CD48是HCC组与HC组之间差异最为显著的蛋白质(Benjamin-Hochberg校正后,P=0.042,倍数变化为3.101,图3C、3D),提示其可能具有作为HCC诊断标志物的潜在价值。

图3 基于发掘人群鉴定与HCC相关的外泌体蛋白Fig.3 Identification of HCC-associated proteins based on plasma exosomal proteomes in the discovery cohort
2.4 检测血浆外泌体中CD48蛋白水平的ELISA方法的建立和评估
为进一步评估血浆外泌体中的CD48蛋白作为候选HCC标志物的诊断价值,首先招募独立的HCC验证人群(表1),包括56例HCC患者、20例LC患者和48名HC。
为评估ELISA作为检测血浆外泌体中CD48蛋白表达水平方法的可行性,通过免疫荧光实验鉴定其在外泌体上的定位。结果显示,在没有破外泌体膜的情况下,采用CD48抗体标记的CD48蛋白在外泌体膜上有较高的丰度(图4A),提示可通过ELISA方法检测其表达水平。随后,本研究建立了基于ELISA的CD48蛋白检测方法,并对其检测能力和适用范围进行系统评估(图4B)。首先,分别采用外泌体特异性蛋白质标志物CD63的抗体作为捕获抗体,CD48的抗体作为检测抗体建立ELISA方法1(图4B),分别评估其在同体积血浆提纯的外泌体及同体积血浆中的检测能力。结果显示,ELISA方法1在血浆提纯的外泌体中的标准曲线的R2值达到0.994(图4C),在血浆中直接检测的标准曲线的R2值也达到0.992(图4D)。更重要的是,通过上述两种检测策略得到的结果呈显著正相关(R=0.999,P<0.001,图4E),并且通过血浆提纯的外泌体的浓度梯度对应的吸光度(D)值(450 nm)与血浆样本的浓度梯度对应的的D值(450 nm)相差不超过0.02,表明ELISA方法1可直接从血浆样本中检测外泌体蛋白,而不必从预先提纯的外泌体中检测。
为排除血浆中游离的非外泌体中的CD48蛋白的干扰,将捕获抗体换成CD48的抗体而建立ELISA方法2(图4B)。结果显示,此方法在CD48蛋白标准品的浓度梯度实验中呈现较高的特异性(R2=0.989,图4F)。随后,在验证人群中随机选取8例HCC患者和8名HC,同时采用ELISA方法1和方法2检测血浆中CD48蛋白的表达水平。采用ELISA方法1检测的结果显示,血浆外泌体中CD48的表达水平在HCC组中显著高于HC组(图4G),而采用ELISA方法2检测的结果显示,血浆CD48的表达水平在HCC和HC样本间差异无统计学意义(P>0.05,图4H)。上述结果初步证实ELISA方法可以用于血浆外泌体蛋白质的定量检测,提示血浆外泌体中的CD48蛋白可能作为潜在的HCC诊断标志物。
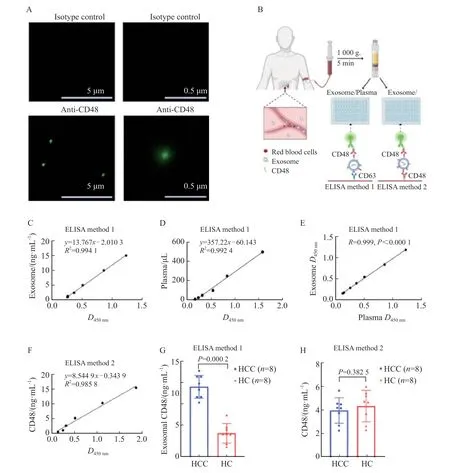
图4 自建ELISA方法检测血浆外泌体中CD48蛋白的表达水平Fig.4 Evaluation of the detection effect of self-built ELISA method
2.5 血浆外泌体中CD48蛋白用于HCC诊断价值的评估
为进一步评估血浆外泌体中CD48蛋白的HCC诊断价值,采用建立的ELISA方法1在验证人群样本中检测血浆外泌体中CD48蛋白的表达水平。同时,采用ELISA方法平行检测血浆AFP的表达水平。结果显示,HCC组血浆外泌体中CD48蛋白的表达水平显著高于LC组和HC组(P<0.001,图5A);同时,血浆AFP在HCC组中的表达水平也显著高于LC组和HC组(P<0.001,图5B)。
通过构建ROC曲线,进一步评估血浆外泌体中的CD48蛋白和血浆AFP鉴别HCC患者和对照个体(LC患者和HC)的能力。结果显示,血浆外泌体中的CD48蛋白单独鉴别HCC的曲线下面积(area under curve,AUC)为0.886,最佳截断值为9.29 ng/mL,灵敏度和特异度分别为0.928和0.706;血浆AFP单独鉴别HCC的AUC为0.796,最佳截断值为4.64 ng/mL,灵敏度和特异度分别为0.554和0.970。上述结果初步提示血浆外泌体中的CD48蛋白具有较高的灵敏度,而血浆AFP具有较高的特异度,两者具有明显的互补性。值得注意的是,这两种蛋白质建立的HCC预测Logistic回归模型:Logit[P=HCC]=0.999×外泌体中CD48+0.067×AFP -7.385,从LC和HC中鉴别HCC患者的AUC达到0.970,灵敏度提升至0.929,特异度为0.971,均高于两者单独的诊断能力。以上结果提示血浆外泌体中的CD48蛋白可以作为HCC诊断的候选血浆标志物,并且其与AFP联合使用时可能具有更高的诊断价值 (表2,图5C)。

图5 血浆外泌体中CD48蛋白用于诊断HCC的潜在价值Fig.5 Performance of plasma exosomal CD48 for HCC diagnosis

表2 血浆AFP、血浆外泌体中的CD48单独检测及联合检测对HCC的诊断能力Tab.2 The performance of plasma AFP and plasma exosomal CD48 alone or their combination for HCC diagnosis
2.6 血浆外泌体中CD48表达水平与HCC临床病理学参数的相关性
根据HCC血浆外泌体中CD48水平的中位数(7.15 ng/mL),将HCC患者分为高水平组(n=28)和低水平组(n=28)。χ2检验分析结果显示,HBV表面抗原阳性的患者血浆外泌体中CD48的表达水平显著高于阴性患者,其与年龄、性别、AFP、肿瘤大小和TNM分期无显著关联(表3)。以上结果提示血浆外泌体CD48的表达水平可能与HBV相关HCC的早期发生相关,而与HCC的中晚期进展无关。

表3 血浆外泌体CD48表达水平与HCC临床病理学参数的相关性Tab.3 Relationship between plasma exosomal CD48 levels and clinicopathological parameters of patients with HCC
3 讨论
HCC的发生、发展是一个极其复杂的过程。研究[10]表明,慢性HBV或丙型肝炎病毒(hepatitis C virus,HCV)感染、饮酒和黄曲霉毒素暴露等是诱发HCC的主要因素。目前临床应用的传统血清标志物检测HCC的能力有限,缺乏高灵敏度的HCC早期诊断标志物。因此,发现新的高灵敏度和特异度的HCC生物标志物、提高HCC患者的生存率是临床实践中迫切需要解决的问题。本研究通过高通量血浆外泌体全蛋白质组的检测和筛选、血浆外泌体蛋白质检测方法的建立和优化、独立队列人群的验证和评价等,初步证实血浆外泌体中的CD48蛋白有望作为HCC候选的诊断标志物。
目前检测血浆外泌体膜蛋白质的常用方法有免疫印迹法、ELISA方法和单分子阵列法等。免疫印迹法具有操作简单、重复性好和相对较低的成本等优点,但其灵敏度低、操作耗时长[11]。ELISA方法具有灵敏度高、重复性好、用时短、易于操作和相对较低的成本等优点,然而,在需要进行测量多种分析物时,同时运行多种ELISA对时间、成本具有很高的要求[12]。尽管如此,ELISA方法仍是进行血浆外泌体膜蛋白检测的首选方法。单分子阵列法是一种基于磁珠的ELISA方法,抗原可以被固定在磁性微珠上的抗体所捕获。此方法具有通量高、灵敏度高、重复性好、用时短和相对较低的成本等优点,但是操作复杂、花费高[13]。根据目前检测血浆外泌体膜蛋白的常用方法的优点,本研究建立了可直接在血浆中检测外泌体CD48蛋白表达水平的ELISA方法。此方法重复性好、用时短、易于操作、成本低,同时无需进行外泌体的纯化,只需少量血浆样本即可检测。然而,基于ELISA方法检测的局限性,现阶段ELISA只能检测外泌体的膜蛋白,而不能用于检测外泌体内的蛋白。
CD48基因位于1号染色体的1q21-23区域,包含4个外显子,该基因编码的CD48蛋白由243个氨基酸残基组成[14]。研究[15]发现,前列腺分泌的细胞外囊泡表达高水平的CD48蛋白,并通过CD48蛋白阻断自然杀伤(natural killer,NK)细胞上的CD48受体CD244,从而干扰NK细胞功能。此外,前列腺癌患者血浆中的细胞外囊泡被证明是其诊断标志物[16]。也有研究[17]表明,在肿瘤微环境中,巨噬细胞表达的CD48蛋白可能是肉瘤的预后预测标志物。以上研究提示肿瘤相关巨噬细胞分泌的外泌体CD48蛋白,可能具有诊断多种肿瘤的潜在价值。
综上所述,血浆外泌体中的CD48蛋白是一种新的HCC候选诊断标志物。本研究建立的ELISA方法可用于直接检测血浆样本中外泌体的CD48蛋白,且具有血浆样本用量少、成本低和操作简易等优势。未来尚需招募更大规模的HCC患者多中心临床队列,以进一步验证血浆外泌体中CD48蛋白的潜在诊断价值。
利益冲突声明:所有作者均声明不存在利益冲突。
