类器官在肿瘤转化医学中的应用和进展
2022-01-01王若彤
王若彤,王 欣,沈 波
南京医科大学附属肿瘤医院,江苏省肿瘤医院肿瘤内科,江苏 南京 210009
1 引言
肿瘤是一类具有高度异质性的疾病,不同患者对治疗的敏感性差异较大[1-2],所以肿瘤的个体化治疗十分必要。近年来,新兴的免疫治疗和靶向治疗与传统手术治疗、化疗、放疗并列为癌症治疗的五大支柱,显著延长了癌症患者的生存时间。但目前,靶向治疗和免疫治疗的应用有一定局限性,靶向治疗作为个体化治疗的代表,其应用往往依赖于特定的基因突变[3-4],而以程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)为代表的免疫检查点抑制剂(immune checkpoint inhibitor,ICI)治疗目前尚无明确的分子/基因谱特征[5],所以目前化疗仍是肿瘤治疗的重要基石之一。
化疗作为全身性的治疗手段,通过静脉或口服给药使药物到达全身,抑制恶性细胞生长、增殖,对于某些恶性程度高、侵袭和增殖能力强的肿瘤(如小细胞肺癌[6]等)来说,化疗依旧为首选治疗。然而,传统化疗效果同样无法被预测(尤其是对于相对后线的患者),考虑到化疗对正常组织的细胞毒作用,无效治疗会使患者承受额外的不良反应,导致脏器功能损害(如骨髓抑制),影响后续治疗,降低患者的生存质量和时间。
为使患者从化疗中获得最大益处,实现个体化治疗,治疗前预测患者对药物的反应性可提高化疗的获益概率,化疗药物的体外敏感性测试就是实现药物预测的实用手段之一。体外敏感性测试的首要条件就是恶性细胞/组织的培养,目前患者来源恶性细胞培养常用的体内和体外模型有患者来源的移植瘤模型(patient-derived xenograft,PDX)、肿瘤球体和类器官模型。理想的肿瘤预测模型要求能够在体外重现体内肿瘤的特征,包括基因组特征、组织学形态特点、恶性细胞间异质性及肿瘤微环境,Fiebig等[7]提出的移植瘤模型是较早的实用原代患者肿瘤培养模型,但由于成本和成功率等原因自20世纪80年代至今仍未广泛应用于临床。近年来由Hans Clever课题组[8]引入的类器官培养模型具有更加可接受的成本,因此受到广泛的关注。类器官可通过多能干细胞、胚胎干细胞、成人干细胞等建立,在培养基内多种细胞因子的诱导下自组织、分化为具有组织结构和功能的细胞团,更好地保留了恶性细胞间异质性[1,9]。类器官作为恶性肿瘤的体外药物敏感性测试模型有巨大潜力,可以填补2D细胞系、动物实验到人体临床试验模型在新药开发中的空白。本文将重点介绍类器官的特点、优势、转化应用及当前类器官技术面临的挑战。
2 恶性肿瘤研究常用的模型
2.1 肿瘤细胞系
肿瘤细胞系模型是目前应用最多的研究模型,作为标准化、商品化的细胞模型,目前主要用于肿瘤基础研究,可进行成本低廉的高通量药物筛选。但是肿瘤细胞系作为临床前研究模型却表现不佳,首先,肿瘤细胞系是一类为适应特定培养条件而人为筛选的细胞亚群,失去了很多原始来源恶性细胞的特征,在培养过程中,原代肿瘤细胞经过培养基的选择,只有少部分恶性细胞存活并传代形成肿瘤细胞系,丢失了恶性肿瘤的细胞间异质性,只能反映少部分恶性细胞亚群的特点[10];此外,稳定的体外肿瘤细胞系已经过多次传代,其遗传、转录和蛋白质组在培养中不断进化,导致同一细胞系在不同的培养传代中存在基因组差异[10-11]。上述缺陷影响了其预测患者药物敏感性的准确度,限制了其在临床前研究中的应用。
2.2 PDX
PDX作为可以服务于精准医疗的肿瘤研究模型弥补了肿瘤细胞系的缺陷,利用该模型可探索肿瘤发展机制、生物标志物、药物筛选及预后影响因素等。PDX能够保持原代肿瘤的病理学特征、异质性和一定的肿瘤微环境特征,有研究[12-13]表明,小鼠PDX的药物反应性能够与患者保持基本一致。但PDX技术价格昂贵,移植瘤模型的培养时间长,成功率低,传代复杂,致该模型成本高昂,因此未大规模应用[7,14];其次,小鼠模型肿瘤基质成分与人类有差异,且在此类模型中多使用免疫缺陷小鼠[12-13],除移植瘤的生长速度较快、影响药物敏感性测试的结果外,也无法使用此模型预测免疫治疗相关药物的疗效[12]。此外,有研究[15]表明,在传代过程中,PDX会获得与患者不同的基因突变类型,在原发肿瘤中观察到的几种基因突变在PDX中逐渐消失,它作为临床前模型的预测价值将受到影响。
2.3 肿瘤球体
肿瘤球体是指一类3D培养模型,包括多细胞肿瘤球状体、肿瘤球、器官型多细胞球体和肿瘤源性球体等[16-17],其中多细胞肿瘤球状体来源于肿瘤细胞系,可看作2D培养的延伸,没有克服肿瘤细胞系目前存在的缺陷[18];肿瘤球是肿瘤干细胞或具有干细胞特征的细胞富集球体[19],可在一定程度上反映肿瘤干细胞的特征,可以用于体外探索肿瘤干细胞分化等相关研究,并不能用于模拟体内肿瘤结构[16];器官型多细胞球体与外植体类似,将组织块不经酶解直接进行培养[17],其与肿瘤源性球体均起源于组织块。该模型球形结构需要靠细胞间黏附能力形成,培养过程中由于组织块和细胞自身差异导致建立的球体大小和形状不均,使进一步研究的质量控制变得困难,影响药物敏感性测试的结果[19]。总之,肿瘤球体模型在模拟体内肿瘤方面仍有不足,在个体化治疗领域应用有限。
2.4 类器官及其发展
类器官培养使用新型的3D细胞培养模型,可来源于原代恶性和(或)正常细胞和组织,2009年Hans Clever课题组[20]首次利用LGR5+的小肠干细胞,成功培养出富含隐窝的绒毛样上皮结构,具备小肠上皮几乎所有分化类型,表明干细胞在体外一定条件下可以被诱导分化产生特定的器官样结构,由此开启了“类器官时代”。此后,研究人员开始尝试利用干细胞(如胚胎干细胞、成人多功能干细胞等)建立各种正常组织类器官,同时,也尝试在体外建立立体结构的肿瘤组织,即肿瘤类器官。目前,乳腺癌[21]、肝癌[22]、胰腺癌[23,24]、结肠癌[1,25-26]、食管癌[27]、肾癌[28]、前列腺癌[29]、肺癌[30]、胃癌[31-33]、膀胱癌[34]等肿瘤类器官已建立,主要用于研究癌症的发生、发展、肿瘤间异质性探索、基因-药物联系、靶点预测及药物敏感性测试等方面。也有研究团队[25,31]建立了肿瘤类器官生物标本库,进行从基础到临床方面的转化研究。目前的肿瘤类器官起源于原代肿瘤组织或基因编辑的非肿瘤组织(引入癌基因/抑癌基因突变,建立肿瘤发生模型[35-36]);患者来源的肿瘤类器官(patient-derived tumor organoid,PDTO)是指利用患者的肿瘤组织(一般为手术切除或穿刺活检恶性组织),通过体外培养建立与患者肿瘤组织类型相似的模型。与其他肿瘤模型相比,PDTO在很大程度上保留了原始肿瘤组织的组织学、遗传学信息,并在组织结构上更接近于原始肿瘤,是患者肿瘤良好的体外“替身”[1,25,30-31]。此外,肿瘤类器官操作方便,所需样本组织量小,模型建立时间较短,易于体外观察,基因组稳定,因此在建构疾病模型、临床癌症研究和药物敏感性测试等领域有着巨大潜力[2]。恶性肿瘤常用模型的特点比较见表1。
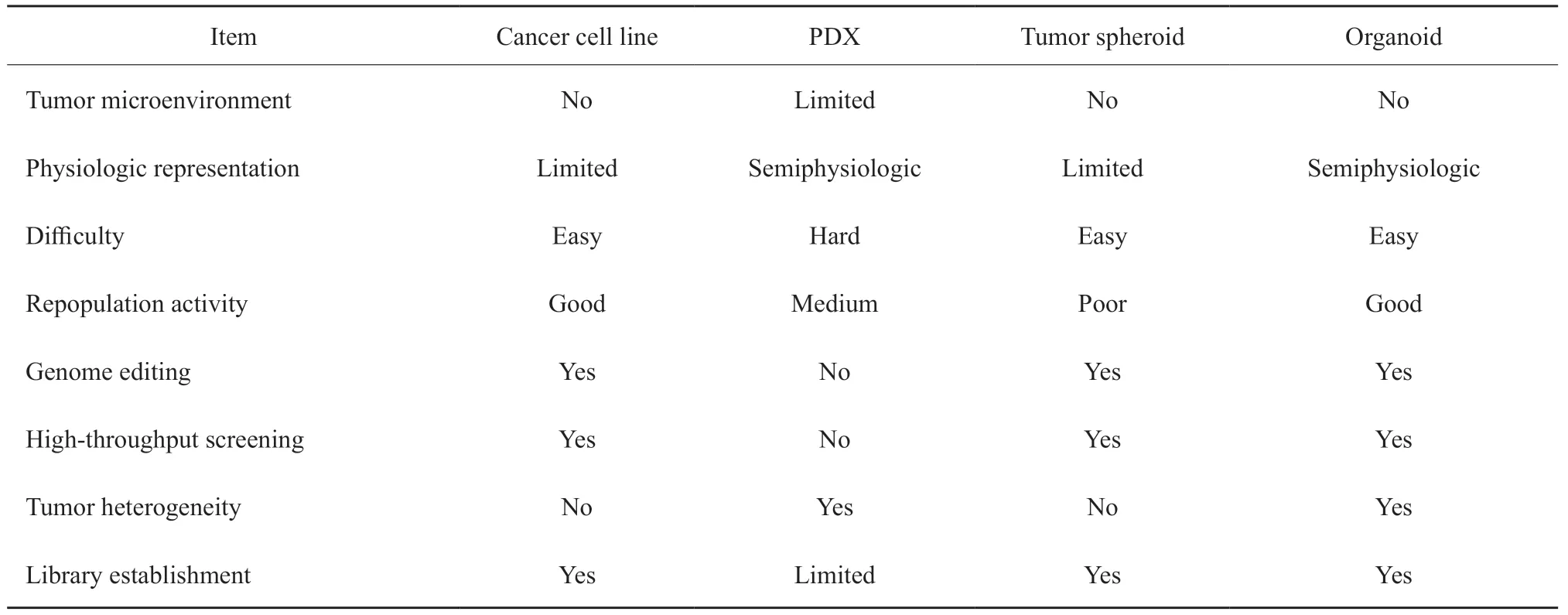
表1 恶性肿瘤常用模型比较Tab.1 Comparison of commonly used models for malignant tumors
尽管类器官应用前景良好,但类器官培养仍处于探索阶段,目前暂无标准的培养方法,各项研究使用的方法不同,肿瘤类器官建立的成功率也不同[37]。目前比较认可的培养方案为细胞重悬于可固化的材料中(如Matrix gel)再培养于含有各种重组蛋白的无血清培养基中[主要包括各类生长因子,如Wnt3A、R-spondin-1、表皮生长因子(epidermal growth factor,EGF)、Noggin及Rho激酶抑制剂Y-27632等]。虽然动物来源的Engelbreth-Holm-Swarm(EHS)应用广泛,但其成分复杂及明显的批次间变异性等,导致其缺乏可重复性,甚至影响肿瘤表型[38],目前正在探索生物材料替代物质(如纳米材料等)[39]。常见的肿瘤类器官培养基见表2。

表2 常见的类器官培养基成分概述Tab.2 Common organoid medium components summary

续表
3 肿瘤类器官的临床相关应用
3.1 药物筛选与研发
药物在进入临床之前需要经过筛选和评估以确定其适应证、有效性和安全性,然而由于现有的体外和体内药物筛选模型的局限性,新药的临床前开发缓慢且昂贵、低效,Wong等[44]分析了406 038个临床试验数据,发现Ⅲ期药物临床试验的总成功率为13.8%,而肿瘤治疗药物的成功率更低,仅为3.4%,其原因主要是药物有效性和安全性不足。与肿瘤细胞系和PDX相比,肿瘤类器官价格适中,培养时限较短,成功率与转化率高,有望为药物筛选和研发提供新的高性价比平台。
目前已有多个团队利用肿瘤类器官进行药物有效性筛选。Clevers团队[26]使用19个结直肠癌(colorectal cancer,CRC)类器官模型筛选83种药物,包括临床应用的靶向药物,如磷脂酰肌醇3-激酶(phosphoinositide-3-kinase,PI3K)抑制剂、胰岛素样生长因子1受体(insulin like growth factor 1 receptor,IGF1R)抑制剂、表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂、BRAF抑制剂等,一线化疗药物(奥沙利铂和5-氟尿嘧啶)以及临床试验中的药物(如IWP-2、Porcupine抑制剂[45]),研究药物敏感性与PDTO分子特征之间的联系,并测试临床试验药物的有效突变靶点,如IWP-2对RNF43突变型CRC有效,发现了该突变类型潜在的治疗策略。Vlachogiannis等[46]筛选了55种处于Ⅰ~ Ⅲ期临床试验或临床实践中的药物,发现BRAF突变患者对MEK/ERK抑制剂反应欠佳,GDC-0980[哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/PI3K抑制剂]对PIK3CA突变类器官疗效有差异。Yan等[31]建立了9个类器官系,测试了37种药物,发现具有ARID1A突变的类器官对ATR抑制剂VE-822反应较好。此外,类器官可保留患者的特异基因突变,也可通过基因工程获得罕见的基因突变并保持相对稳定遗传[35],为药物靶点的研究提供了机会。
除药物有效性测试外,类器官还可用于药物临床前安全性测试,使用正常组织类器官检测药物,通过细胞毒试验(如乳酸脱氢酶释放试验)并配合活细胞计数(如CellTiter)等手段判断药物对健康组织的毒性。目前已成功构建了多种健康组织类器官,如肝脏类器官[47]、心脏类器官[48]和肾脏类器官[49]等,并已用于药物的毒理学研究,已有研究者使用肝脏类器官测试了多种药物的剂量依赖肝毒性,并探索了一些药物导致的肝毒性的分子机制[50];Mun等[47]检测了多种上市后因不良反应而被召回的药物的安全性,如曲伐沙星由于会导致较高的肝功能衰竭风险而被下架,该团队使用2D模型和类器官模型分别进行药物测试,在同等药物浓度下2D模型显示曲伐沙星有很少甚至无肝毒性作用,但3D肝类器官中观察到细胞线粒体功能障碍和明显的细胞死亡,提示3D健康类器官可能对药物毒性反应较2D模型更加敏感。使用类器官系统作为现有药物筛选与研发测试方法的补充,可以更大限度地检测药物的安全性与有效性,提高药物研发的成 功率。
3.2 预测患者的药物敏感性
肿瘤类器官的发展为个体化治疗提供了新的思路:根据肿瘤类器官的特点,研究人员可在体外建立对应的肿瘤类器官模型,进行药物方案疗效和预后预测,在一定程度上实现个体化治疗。Vlachogiannis等[46]建立治疗前、治疗中及转移或进展后的类器官模型,对比发现,除组织病理学特征一致外,类器官与亲本肿瘤组织间分子图谱基本重合,基因突变谱中有96%的重叠;后续对PDTO进行药物测试并与患者疗效进行对比,尝试利用PDTO测试患者疾病进展后可能敏感的药物,结果显示,类器官预测患者药物反应具有100%的灵敏度、93%的特异度、88%的阳性预测值和100%的阴性预测值。一项有96个局部晚期结肠癌类器官标本库的药物敏感性测试中,Yao等[51]首先对已建立的18个类器官和相应的肿瘤活检组织行全外显子测序(whole exome sequencing,WES),发现PDTO与相应肿瘤基因突变谱的重叠率为94.4%,分别检测类器官对放疗及化疗药物(氟尿嘧啶和伊立替康)的敏感性,对比患者的临床疗效,得到84.43%的准确率、78.01%的灵敏度和91.97%的特异度。
虽然肿瘤类器官在预测患者药物敏感性方面表现优秀,但是由同一肿瘤建立的多个类器官对于药物的反应存在差异。Schumacher等[52]对同一结肠癌进行同步多区域取样获得的类器官培养在药物反应中显示出高达30倍的差异。通过外显子和RNA测序发现,这些“兄弟”类器官可基本保留亲本肿瘤常见的基因突变类型,但对于扩展测序发现的罕见突变类型存在显著遗传异质性,提示肿瘤内异质性对于类器官的建立及体外预测药物敏感性结果可能产生一定影响。Kim等[9]从结肠癌患者组织的不同区域中建立了肿瘤类器官和相应细胞系,比较同一患者来源的类器官与细胞系的基因组、转录组学和药物反应性,发现虽然PDTO仍然概括了原发肿瘤的主要组织学、基因组学和转录组学特征,但各类器官之间存在异质性,并且在培养传代过程中PDTO会产生新的突变。多种证据表明类器官对亲本肿瘤的模拟能力使其在体外具有较佳的预测能力,反映患者药物敏感性的准确率尤其是阴性预测率较高,可能成为患者药物选择、测试及判断患者预后的新途径。但考虑到肿瘤组织内的异质性,基于单次活检而建立的PDTO在预测患者反应方面可能具有一定局限性。
4 展望与挑战
4.1 共培养
虽然肿瘤类器官能够还原亲本肿瘤分子和病理学特征,但肿瘤类器官仅包括肿瘤上皮细胞,并不包含间质细胞,且缺乏肿瘤-基质相互作用和肿瘤微环境[53],因此,肿瘤类器官在临床应用方面会受到限制,如无法预测针对抗血管生成和免疫治疗等药物的反应[46]。为缩小肿瘤类器官与体内肿瘤微环境之间的差异,研究人员尝试将类器官与肿瘤间质细胞、免疫淋巴细胞等进行共培养。
肿瘤相关性成纤维细胞(cancer-associated fibroblast,CAF)是肿瘤微环境中一种重要的细胞成分,可通过多种机制影响肿瘤的发生、发展、转移及耐药[54]。Öhlund等[55]将胰腺导管腺癌类器官与小鼠胰腺星状细胞进行共培养,发现星状细胞在不同方式下转化为不同亚型的CAF,提示CAF的瘤内异质性。Seino等[23]将胰腺癌类器官与CAF共培养,发现CAF可为肿瘤类器官提供其生长所必需的微环境。Marusyk等[56]将CAF与乳腺癌类器官共培养后发现,CAF可保护癌细胞免受拉帕替尼毒性从而介导耐药,提示CAF在肿瘤发生、发展和治疗反应中发挥重要的调节作用,共培养系统为进一步探究恶性细胞与其周围环境之间的联系与作用提供了新途径。
免疫细胞在肿瘤微环境中也有重要影响。Dijkstra等[57]通过将PDTO和患者来源的外周血淋巴细胞进行一体化共培养,在长达数周的时间里,患者的T淋巴细胞受到肿瘤刺激实现扩增,得到了肿瘤反应性T淋巴细胞,后续实验证实诱导产生的T细胞具有肿瘤特异性杀伤能力,而对正常组织类器官无反应。此类肿瘤反应性T细胞或许可以作为一种新型淋巴细胞过继治疗方法直接杀伤患者体内的恶性细胞。但由于研究人员将类器官单细胞与T细胞置于T细胞培养基中进行共培养,并加入了干扰素γ、白细胞介素-2(interleukin-2,IL-2)和固定浓度的PD-1抗体,因此该共培养模型主要用于获得扩增的肿瘤特异反应性T淋巴细胞[58]。综上,共培养是未来类器官的发展方向之一,扩大类器官应用范围、提高类器官的生理性需要更多努力。
4.2 微流控设备
微流控设备是一种生物工程操作系统,其对流体的精确操控有望改进传统实验方法[59]。近年来其与体外模型结合成为一个发展方向,如器官芯片,它通过管道连接不同细胞室并控制液体流动以模拟体内器官的功能及细胞间、器官间的联系,提高体外模型的生理性[60]。微流控设备不仅可用于基础研究(如探究不同类型细胞在肿瘤发生、发展、侵袭和转移等方面的作用等[61]),还可用于药物筛选,可使筛选药物流程自动化,提高3D模型药物筛选的效率。Jin等[62]建立了由诱导肝细胞与微流控系统构建的3D血管化肝脏类器官,控制流体通过建立的血管流动,成功建立药物浓度梯度,实现高效率的药物筛选。除此之外,微流控设备与类器官联合建立微流控多器官平台,模拟药物在体内的代谢过程,进行药物疗效、安全性及药代动力学研究[48,60],可提高药物筛选效率,然而目前联合应用方案还不够成熟,但微流控设备可推动体外模型朝着更高效、更具生理性的方向发展。
4.3 生物打印技术
目前类器官应用需要人工培养传代以获得稳定的类器官,模型建立所需时间较长,且过程不精确,存在批次间变异,研究人员需要在规模、质量控制等方面进行改进,以实现类器官在药物筛选、器官再生等方面的转化应用[63]。生物打印技术凭借其强大的细胞控制能力目前已广泛应用于组织工程和再生医学等领域,目前有证据表明,该技术可与类器官技术相结合以控制类器官自组织[64],为药物研发筛选和再生医学开辟了新途径。此外,Lawlor等[65]测试了3D生物打印技术生成肾脏类器官的可行性,利用该技术精确调控类器官部分物理性质,包括类器官大小、细胞数量和结构,并利用生成的肾脏类器官进行了氨基糖苷类药物毒性测试,这一成果提示生物打印技术具有强大潜力,可为未来类器官相关药物研究和筛选提供更高通量和更可控的实验模型。Jiang等[66]结合微流控系统组建了类器官3D打印设备,可在高效快速的同时控制类器官内细胞数量,经检测生成的类器官病理学形态与基因组特征能够保留亲本肿瘤的特征,也提示生物打印技术与类器官结合是未来类器官快速建立的可能途径,但目前该方法只在特定细胞群(如代表亲代肿瘤组织的异质性细胞群)中可达到预期效果,对于成分复杂且不明确的细胞群(如患者来源的组织学标本)需要进一步研究。
5 总结
类器官的发展与应用的探究仍在继续,虽然目前仍有很多问题亟待解决,但类器官凭借其独特的优势和巨大的潜力,已在体外模型中占据了一席之地,而将类器官模型与传统模型有机结合定会推动肿瘤学和肿瘤治疗的进一步发展。随着国内外研究人员对类器官的不断探索和改进,相信类器官有能力充当实验室研究与临床应用之间的桥梁,弥补传统模型在临床应用方面的不足,在转化医学和个体化治疗方面扮演越来越重要的角色。
利益冲突声明:所有作者均声明不存在利益冲突。
