制动应激对孕猪海马结构神经元可塑性的影响
2021-12-31陈思彦孙维婧王子旭陈耀星董玉兰
陈思彦,孙维婧,王子旭,陈耀星,曹 静,董玉兰
(中国农业大学动物医学院,北京 100193)
在我国的生猪规模化养殖中,妊娠期母猪常使用限位栏养殖。虽然这种养殖方法能够节省养殖空间、提高养殖效率、方便孕期管理、疫苗免疫和精准饲喂,但也使孕猪长期处于制动应激状态,这种应激不仅不符合动物福利的要求,还会造成母猪生理和心理上的双重损伤,影响母猪的激素分泌、神经营养和生育繁殖等机能,甚至对子代健康产生负面作用,最终导致母猪的使用年限下降,淘汰率升高,给猪场造成经济损失。因此,如何正确评估限位栏养殖对母猪造成的影响,降低养殖风险,提高后备母猪的繁殖力也逐渐引起学者和养殖界的关注。同时,妊娠模型动物猪应激反应的研究对人类妊娠期应激导致疾病的机理研究和防治同样具有启发意义。下丘脑-垂体-肾上腺轴(HPA轴)是机体神经内分泌系统的重要组成部分。当应激源刺激机体时,信号从大脑皮层传入边缘系统,作用于下丘脑,在HPA轴的调控下,最终释放大量糖皮质激素(glucocorticoid,GC)。应激时HPA轴的功能是由海马、下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)和杏仁核共同调节的,GC又可反馈作用于海马的糖皮质激素受体(GR)和盐皮质激素受体(MR)引起一系列反应。应激能够引起海马形态和功能的改变。大量证据表明[1-2],海马是应激损伤的敏感区[3],应激会对海马突触可塑性、神经元存活、海马神经发生、海马神经元细胞代谢和机体记忆力等各个方面造成影响。可塑性被认为是神经系统应对内、外部刺激时产生的适应性结构重组以改变功能的能力[4-10]。大量资料显示,在应激改变海马形态和功能的过程中,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可能充当了重要的角色。海马中BDNF的表达水平在急性或慢性的应激中均有敏感的变化[11-13],而BDNF的减少也是影响海马神经元的发生[14-15]、导致海马神经元的退行性变化和突触的可塑性变化的一个因素[16-17]。而且,海马神经元中BDNF/TrkB由5-HT2A受体介导、雌激素参与的信号传导的调控[18],其下突触级联反应涉及突触可塑性[19],提示BDNF是妊娠母猪应激反应时影响突触可塑性且可监测的重要指标蛋白。本研究选用8~9月龄的巴马小型母猪,将配种成功的母猪随机分为应激组(n=3)和对照组(n=3),应激组从妊娠第1天开始饲养于定制的母猪限位栏中,模拟实际生产中孕猪所承受的制动应激环境,对照组在宽敞自由的环境中饲养,其他饲养条件相同。妊娠第18天处死动物,采集孕猪血液,进行相关激素水平的检测;分离孕猪的海马组织,检测海马BDNF表达水平,并通过尼氏染色和镀银染色检测海马的神经元丢失率、树突复杂度以及树突棘数量等多个指标,来研究心理应激在胚胎着床期对孕猪造成的类固醇激素合成功能的变化及对海马神经元可塑性的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物及处理 于北京实创世纪小型猪养殖基地购入6头雌性巴马小型猪作为实验动物,所有母猪月龄相近(8~9月龄)、体重相似(20~30 kg)且健康无病。将其均饲养于标准环境下(温度为22 ℃;12 h/12 h光照制度;每日上午8:00开灯,下午8:00关灯)并自由采食饮水。将实验母猪成功配种后随机分为两组,每组3头:1)对照组:将每头妊娠巴马小型猪单独饲养于干净、宽阔的环境下,可自由活动;2)制动应激组:将每头妊娠巴马小型猪单独饲养于50 cm×60 cm×100 cm的金属笼中,孕猪只可前后小范围运动,无法左右转头。
在持续制动应激处理的第18天上午对实验动物麻醉后心脏放血处死。用开颅器取出完整猪脑,于延髓后切断,从正中矢状面将大脑一分为二,左半球分离出各脑部结构并置于液氮冻存,右半球完整置于4%多聚甲醛固定。
血浆获取:制动应激处理前1 d记为D0(发情期),试验期间分别于D0和D18采集孕猪颈静脉血样。
1.1.2 主要试剂和设备 兔单克隆抗体BDNF(ab108319,abcam,美国),RIPA裂解液、蛋白酶抑制剂和HRP标记山羊抗兔IgG(CW0211)均购自江苏康为世纪生物科技有限公司。猪促肾上腺皮质激素释放激素(CRH)ELISA 试剂盒(CEA835Po)和猪5-羟色胺(5-HT)ELISA检测试剂盒(CEA808Ge)均购自武汉云克隆科技股份有限公司。YP1200电子天平购自上海第二天平仪器厂,生物组织包埋机购自浙江科迪仪器设备有限公司,高速台式离心机购自长沙湘仪离心仪器有限公司,酶标仪购自美国BLO-RAD,多管放射免疫计数器购自合肥众成机电技术公司,转膜电泳槽购自北京六一仪器厂,电泳仪购自上海伯乐生命医学产品有限公司。
1.2 方法
1.2.1 血液激素含量的测定 检测血浆中促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)的浓度:按照ELISA试剂盒说明书操作检测血浆中CRH的浓度。
检测血浆中的促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)和皮质醇(cortisol,COR)浓度:使用放射免疫法。将血浆样品解冻,分别加样,混匀后室温放置15 min,3 500 g转速离心15 min。弃上清,检测各管沉淀的放射性计数并采用“相对结合率-对数计量的分数对数”的数学模型进行拟合。
1.2.2 尼氏染色 海马在4%多聚甲醛中固定,经过修块、梯度脱水、透明浸蜡,切片每张厚度15 μm。将石蜡切片脱蜡并在酒精下行水化,进行尼氏染色,将切片置于尼氏染液中染色10 min,在蒸馏水中轻洗5 s,然后放入95%酒精中分色,分色程序视染色效果而定,一般为95%酒精Ⅰ 1 min、95%酒精Ⅱ 1 min、95%酒精Ⅲ 1 min,再酒精上行脱水,入二甲苯,最后中性树胶封片,置于光学显微镜下观察。视野可见尼氏体呈深蓝色,细胞核呈浅蓝色,背景为无色或者淡蓝色。
神经元密度评价方法:根据神经元形态和神经纤维排列的不同,海马本部被分为CA1、CA2、CA3和CA4 4个区。从海马切片中随机选取6张相同定位切片,在放大400倍条件下,从CA1区和CA3区含有完整结构的神经元区域开始,连续采集3个不重叠的视野,计数每个视野内结构完整的神经元数量,求均值以代表正常形态神经元密度[20]。
1.2.3 镀银染色 将新鲜取材的猪脑半球放入4%多聚甲醛中固定一周以上,然后使用1.5%重铬酸钾铬化,3%的硝酸银溶液浸泡镀银48 h,脱水、包埋、切片、封片后即可进行观察。
树突测量标准。在孕猪海马CA3区选取具有代表性的锥体细胞,在齿状回(dentate gyrus,DG)选择独立的与周围神经元交叉较少的颗粒细胞进行图像采集、图像处理和分析,神经元采集标准:1)选取位于切片厚度中部的锥体细胞进行统计,尽量避免树突的缺失;2)尽量选取相对独立的,与周围的神经元树突有较少交叉的神经元进行分析。照片使用Olympus成像系统在20倍物镜下连续采集图像,通过均匀微调细准焦螺旋在切片不同焦距采集连续的神经元的图像,每个视野采集6张图像。神经元的二维重建采用Neuronstudio软件,图像的测量分析使用Image-J win64软件,数据统计分析使用SPSS软件。数据描述为“平均值±标准差”,数据比较P≤0.05 视为有显著差异,Graphpad软件作图[21]。
Sholl分析法是一种对神经元树突复杂度进行定量分析的经典方法,可用于确定树突形态。从神经元胞体开始,每隔相同距离画一个圈覆盖树突,由同心圆与树突交叉点的数量来评估神经元树突的复杂性,神经元树突追踪可获得神经元树突分支点的数量以及神经元树突的总长度。
树突棘测量标准。树突棘是神经元树突上的微小突起,是和其他神经元的轴突末梢形成突触的结构。树突棘的主要形状包括瘦长型、短粗型、蘑菇形和丝状伪足。每张切片选择3个处于切片正中、树突尽量完整的神经元参与统计,每个神经元选取5根只有一个分支点的二级树突参与统计,在100倍油镜下选取和背景无交叉的、总体处于同一焦距的、平行于镜头的树突,通过均匀微调细准焦螺旋在切片不同焦距采集连续的树突图像,使用Photoshop合成一个较为清晰的视野,每个视野选取相对直的长20 μm的树突节段进行计数,树突棘密度即为视野内总树突棘数目除以树突分支长度。
1.2.4 Western blot 新鲜组织提取蛋白。用RIPA倍比稀释蛋白样品并使用酶标仪测量吸光光度值,做出标准曲线得到蛋白样品浓度后用RIPA将蛋白样品浓度调平。将未变性蛋白与Loading buffer混合煮样使之变性后,进行电泳,然后冰浴转膜,转膜完成后将PVDF膜放入脱脂奶中封闭,用一抗(BDNF)孵育过夜,用TBST洗涤后再放入HRP标记的羊抗兔二抗中,室温摇床孵育2 h,之后进行荧光显色,最后使用全自动数码凝胶图像分析系统进行图像采集。目的蛋白和内参蛋白的面积和光密度使用ImageJ软件统计。目的蛋白表达量=(目的蛋白面积×光密度)/(内参蛋白面积×光密度)。
1.3 数据统计
使用软件 SPSS 23.0(SPSS Sciences,Chicago,USA)进行数据分析。采用独立样本T检验分析对照组与应激组的差异显著性。试验数据采用“平均值± 标准误”,P≤0.05为差异显著。
2 结 果
2.1 孕猪血浆中应激相关激素的水平
在制动应激处理18 d后,应激组血浆CRH水平较应激前上升221.65%(t=2.71,P=0.046),较同时间的对照组显著上升296.36%(t=3.026,P=0.038,图1A)。由放射免疫法测得,在第18天时应激组血浆ACTH水平较应激前上升64.97%(t=5.151,P=0.007),较同时间的对照组高出62.98%(t=4.549,P=0.010,图1B);而COR水平较应激前上升97.76%(t=5.131,P=0.007),较同期对照组显著高出 109.86%(t=5.602,P=0.005,图1C)。制动应激处理后,孕猪血浆中的各级应激激素水平均显著上升,表明成功建立孕猪制动应激模型。
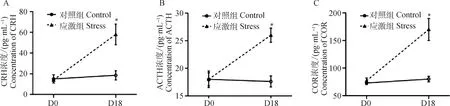
D0 表示制动应激开始前1 d,D18 表示制动应激第18天。*表示制动应激组与相同日龄的对照组具有显著性差异(P≤0.05)D0 represents the day before the restraint stress treatment,and D18 represents the 18th day of restraint stress treatment.* indicates that the difference is significant between the control group and the stress group (P≤0.05)图1 制动应激对孕猪血浆CRH、ACTH和COR水平的影响Fig.1 The effect of restraint stress on plasma CRH,ACTH and COR level in pregnant sows
2.2 制动应激对孕猪海马组织结构的影响
尼氏染色法是一种通过碱性染料染色神经组织的方法,本研究使用尼氏染色来对神经元进行计数,观察是否有神经元丢失的情况发生。将孕猪海马石蜡切片进行尼氏染色后,在DG的颗粒细胞层中,对照组的颗粒细胞整体染色均匀,胞核大且呈卵形,细胞排列紧密;应激组中,颗粒细胞胞核排列整体松散,胞核染色不均且整体呈锥形,颗粒细胞内侧的胶质细胞和多形细胞的细胞形态基本一致,无明显可见差异(图2A)。而在海马CA1区和CA3区中,对照组锥体细胞层的锥体细胞核大而圆,顶树突长而直,投向分子层,其中CA3区整体排列整齐紧密,CA1区较为松散,尼氏体染色均匀、无凝集、无分散;应激组海马的CA3区部分锥体细胞出现空泡状,排列松散,肉眼可见部分神经元位置空缺,而在应激组CA1区的锥体细胞中可见尼氏小体分布减少,染色较浅。
通过神经元计数分析发现,应激组CA1区中的锥体细胞数量和对照组无显著差异(P=0.221 9,图2B),应激组海马CA3区的锥体细胞层显著低于对照组11.3%(t=2.318,P=0.034,图2C),应激组齿状回中颗粒细胞数量较对照组也下降31.7%(t=3.407,P=0.003,图2D),故在应激组的CA3区和DG均发生了神经元丢失的情况。

A.海马组织学结构,图中黑色箭头指示齿状回中的颗粒细胞层,红色箭头指示 CA1 区和 CA3 区中的锥形细胞层,图中比例尺=100 μm;B.CA1 区锥体细胞层;C.CA3 区锥体细胞层;D.齿状回颗粒细胞层,*表示对照组和应激组差异显著(P≤0.05)A.Hippocampal stracture,the black arrow in the figure indicates the granulosa cell layer in the dentate gyrus,and the red arrow indicates the pyramidal cell layer in the CA1 and CA3 regions,scale bar =100 μm;B.Pyramidal cell layer in CA1 regions;C.Pyramidal cell layer in CA1 regions;D.Granule cell layer in DG,* indicates that the difference is significant between the control group and the stress group (P≤0.05)图2 制动应激对孕猪海马结构的影响及孕猪海马尼氏染色的结果统计Fig.2 The effect of restraint stress on Nissl staining of hippocampus in pregnant sow and statistics of Nissl staining results in pregnant sows
2.3 制动应激对孕猪海马神经可塑性的影响
2.3.1 制动应激对孕猪海马CA3区神经元复杂度的影响 镀银染色可显示出神经元的胞体、树突、轴突以及更微小的树突棘结构。为了评估制动应激对妊娠母猪大脑海马CA3区(图3A)神经元可塑性的影响,对孕猪海马切片进行镀银染色(图3B),利用ImageJ软件对神经元的树突追踪后采取Sholl分析,结果表明:在孕猪海马CA3区中,应激组中海马锥体细胞神经元与同心圆交点的数量较对照组下降(图3C)。应激组和对照组CA3区中的锥体细胞顶树突和基树突的树突平均长度均无显著差异(P=0.847 6和P=0.938 5,图3D)。应激组CA3区锥体细胞的顶树突终末点的数量较对照组减少61.3%(t=3.245,P=0.005,图3E),基树突终末点的数量较对照组减少46.1%(t=2.542,P=0.02,图3E)。故制动应激后,孕猪海马CA3区的锥体神经元树突复杂度较对照组显著下降。
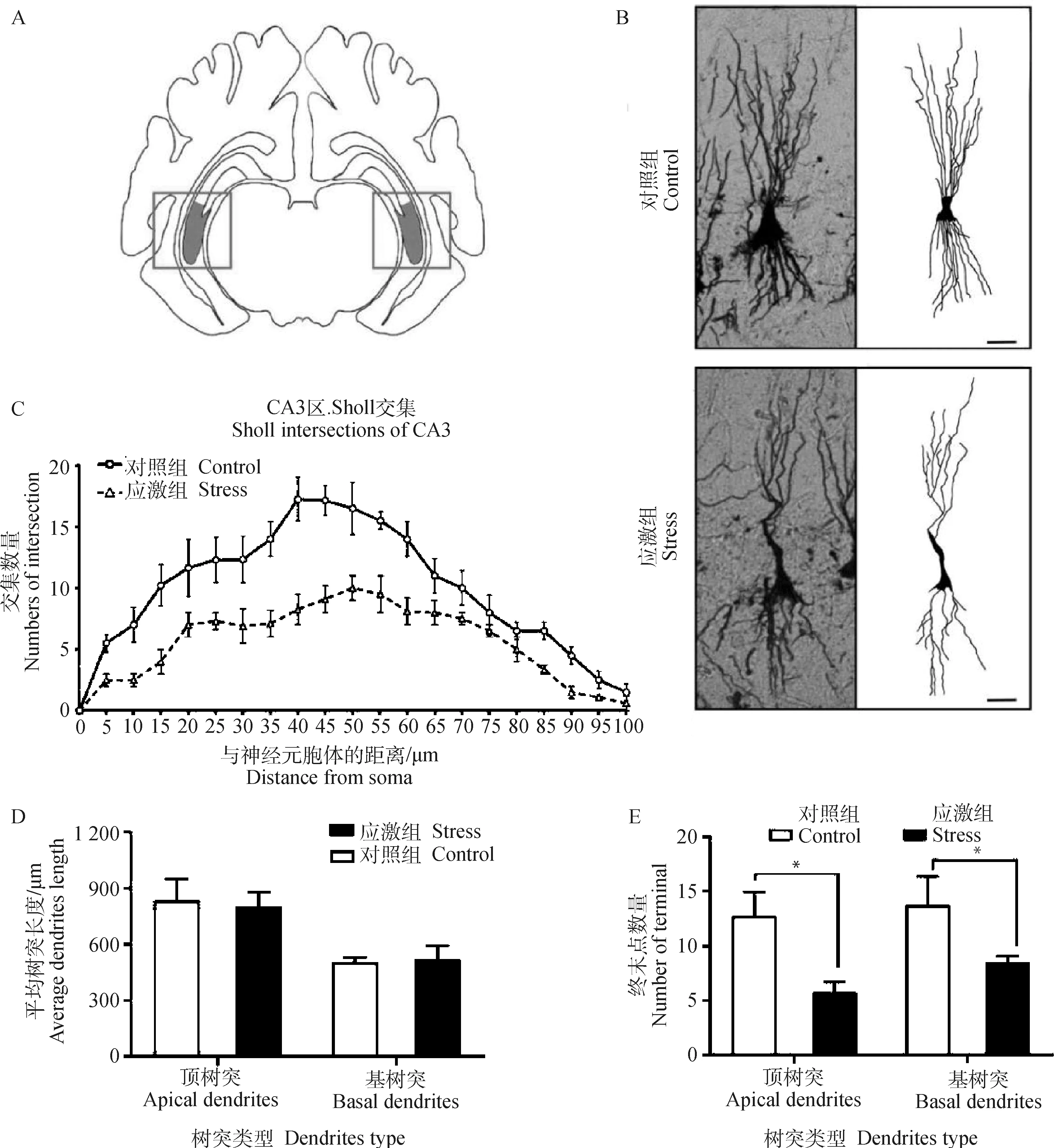
A.成年猪海马 CA3 区示意图;B.CA3 区锥体细胞的镀银染色及树突追踪结果,图中比例尺为 20 μm;C.CA3 区树突 Sholl 交叉点分析;D.CA3 区平均树突长度;E.CA3 区树突终末点数量。*表示对照组和应激组差异显著(P≤0.05)A.Schematic diagram of hippocampal CA3 area of grown-up pig;B.Golgi’s staining and dendrite tracing results of pyramidal cells in CA3 region,scale bar=20 μm;C.Sholl intersection of CA3 region;D.Average dendritic length in CA3 region;E.Dendrite terminal number in CA3 region.* indicates that the difference is significant between the control group and the stress group (P≤0.05)图3 制动应激对孕猪海马 CA3 区神经元复杂度的影响Fig.3 The effect of restraint stress on neuronal dendrites complexity in hippocampus CA3 region of pregnant sow
2.3.2 制动应激对孕猪DG神经元复杂度的影响 海马中新生神经元发生在DG(图4A)的亚颗粒区,这些神经元在发育成熟后会整合到现有的神经网络中。锥体细胞的镀银染色及树突追踪结果见图4B。Sholl分析结果显示,应激组妊娠母猪海马DG中颗粒细胞的神经元与同心圆交点的数量较对照组无显著变化(图4C)。应激组DG的树突平均长度(P=0.644)和颗粒细胞树突终末点的数量(P=0.786)也较对照组无显著性差异(图4D和E)。故在18 d制动应激后,孕猪海马DG中颗粒细胞的树突复杂度无明显变化。
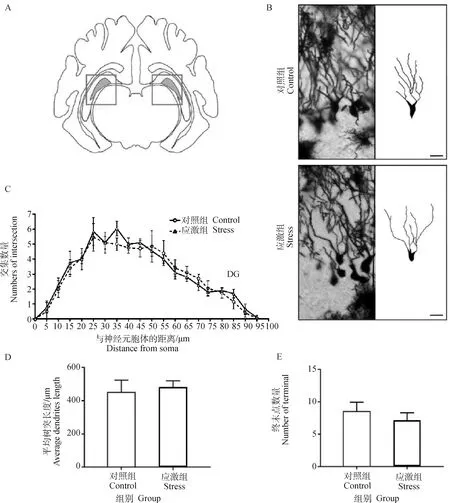
A.成年猪海马 DG 示意图;B.DG 锥体细胞的镀银染色及树突追踪结果,图中比例尺为 20 μm;C.DG树突 Sholl 交叉点分析;D.DG 平均树突长度;E.DG 树突终末点数量。*表示对照组和应激组差异显著(P≤0.05)A.Schematic diagram of hippocampal DG area of grown-up pig;B.Golgi’s staining and dendrite tracing results of pyramidal cells in DG region,scale bar=20 μm;C.Sholl intersection of DG region;D.Average dendritic length in DG region;E.Dendrite terminal number in DG region.* indicates that the difference is significant between the control group and the stress group (P≤0.05)图4 制动应激对孕猪海马DG神经元复杂度的影响Fig.4 The effect of restraint stress on neuronal dendrites complexity in hippocampus CA3 region of pregnant sow
2.3.3 制动应激对孕猪海马CA3区和DG神经元树突棘的影响 镀银染色能显示出神经元树突上的细小突起,这种突起就是承载着哺乳动物中枢神经系统中大多数兴奋性突触功能的树突棘,树突棘根据其形态通常被分为4类:蘑菇型树突棘(mushroom spines)、细树突棘(thin spines)、短粗树突棘(stubby spines)和丝状伪足(filopodia),见图5A。树突、树突棘形态等见图5B、C。一般丝状伪足和细树突棘无法十分准确地区分计数,故将丝状伪足也计入未成熟树突棘中。树突棘统计结果表明(图5D~G):在18 d制动应激后,孕猪海马CA3区的锥体细胞树突上的树突棘总数较对照组降低17.8%(t=2.115,P=0.046,图5E)。DG中颗粒细胞树突上的树突棘总体数量较对照组降低19.3%(t=2.701,P=0.013,图5G)。而将未成熟树突棘和成熟树突棘分开统计比较后发现,应激组CA3区未成熟树突棘数量下降17.9%(t=3.099,P=0.01,图5D),成熟树突棘数量下降31.28%(t=2.255,P=0.024,图5D)。DG的成熟树突棘数量下降26.8%(t=2.463,P=0.022,图5F),未成熟树突棘数量变化不显著(P=0.50,图5F)。综上所述,18 d的制动应激降低孕猪海马CA3区和DG中的新生树突棘的形成,同时增加CA3区中成熟树突棘的消除,共同造成应激组海马CA3区和DG中神经元树突棘密度的减少。
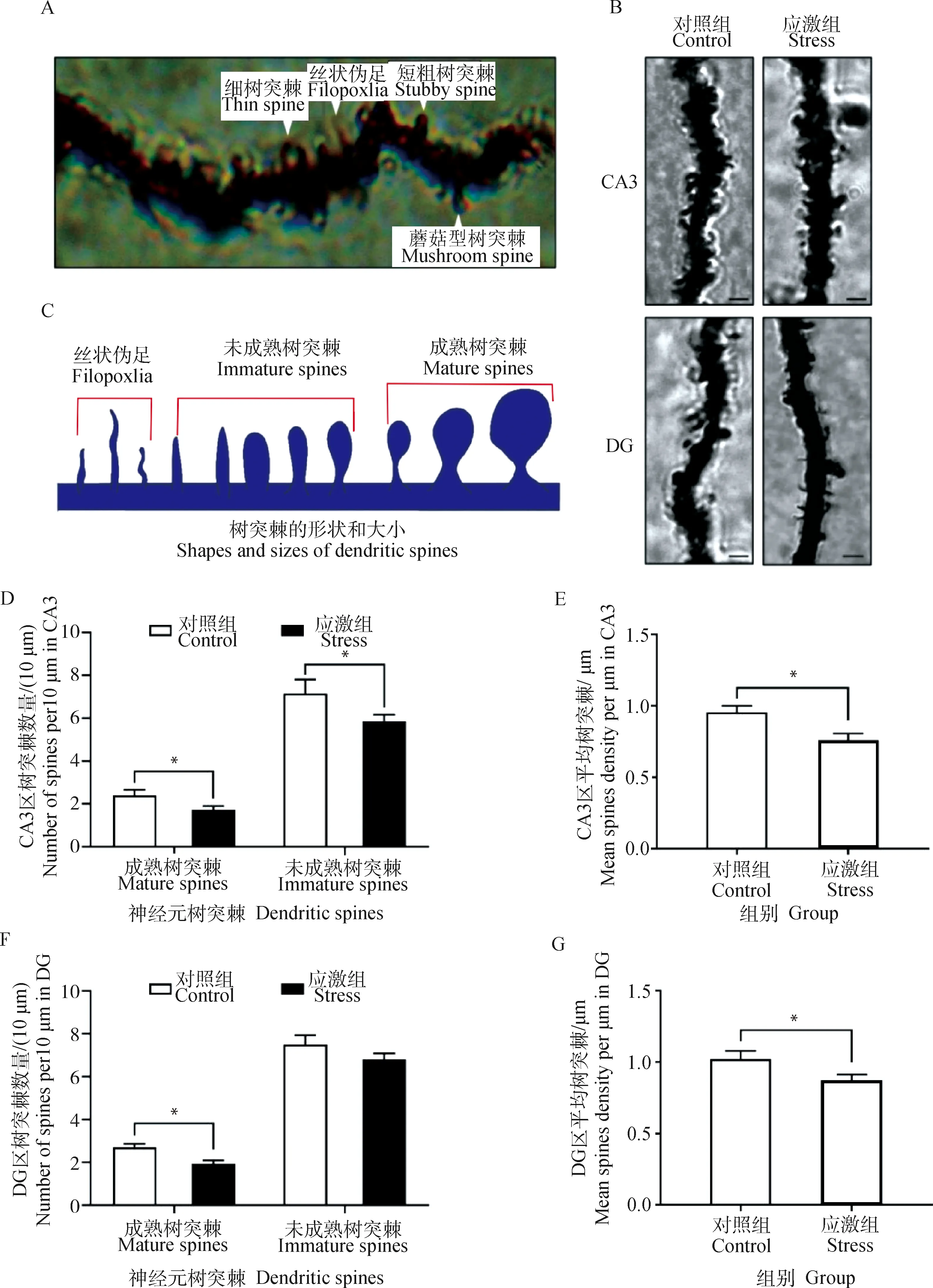
A.树突棘的典型形态,包括细树突棘、丝状伪足、短粗树突棘和蘑菇型树突棘;B.应激组和对照组的树突形态;C.树突棘的形状和大小,图中包括丝状伪足、未成熟树突和成熟树突;D~G.树突棘密度(即视野内总树突棘数除以树突分支长度)A.Four typical dendritic spines morphology,including thin spines,filopodia,stubby spines and mushroom spines;B.Dendrite morphology in the stress group and the control group;C.shapes and sizes of dendritic spines,including filopodia,immature spines and mature spines;D-G.Dendrite spine density(Number of dendritic spines in the visual field divided by the length of dendritic branches)图5 制动应激对孕猪CA3区和DG神经元树突棘的影响Fig.5 The effect of restraint stress on neuronal dendrites spines in hippocampus CA3 region and DG of pregnant sow
2.4 制动应激对孕猪海马BDNF蛋白表达水平的影响
BDNF是神经元和神经胶质细胞的中央神经营养因子(central neurotrophic factor,NTF)[22],在海马中高表达[23-24],与海马相关的众多神经损伤性疾病有关[25]。Western blot结果显示,应激组中孕猪海马内的BDNF蛋白表达量较对照组降低70.6%(t=6.642,P=0.00,图6)。
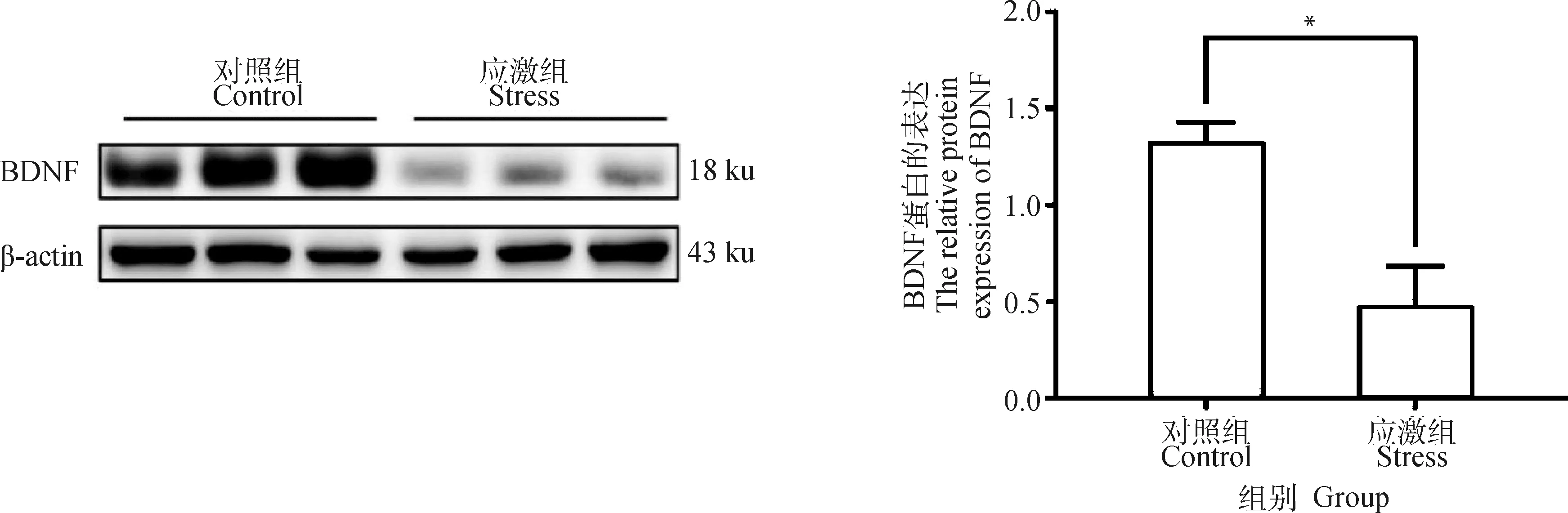
*表示对照组和应激组差异显著(P≤0.05)* indicates that the difference is significant between the control group and the stress group (P≤0.05)图6 制动应激对孕猪海马BDNF蛋白表达水平的影响Fig.6 The effect of restraint stress on BDNF level of hippocampus in pregnant sows
3 讨 论
关于慢性应激对中枢神经系统产生的影响已经有了众多进展,如慢性轻度应激(chronic mildstress,CMS)可降低小鼠海马内分子层的突触囊泡密度[26],慢性隔离应激(social instabilitystress)的雄性小鼠海马中新生神经元中存活率降低,且新生比例降低[27]。考虑到猪和人在应激激素类型和海马结构上的相似性,因此我们认为用猪作为妊娠期心理应激的模型动物更具有临床意义。同时,探索限位栏养殖模式对于妊娠母猪生理、心理的影响也是学者和养殖界关心的重要课题。因此,作者通过构建着床期孕猪制动应激模型,探索了着床期慢性心理应激对孕猪海马神经可塑性的影响。
突触可塑性(synaptic plasticity)是指突触的形态会朝着有利于某些神经元通路的方向改变,同时减少与其他神经元通路的联系,这种可塑性被认为是神经系统应对内、外部刺激时产生的适应性结构重组以改变功能的能力。而神经可塑性不仅反映在海马神经元构建新的神经通路的能力中,同时也反映在海马神经元的组织学特性里,包括树突棘的大小和数量、突触的数量以及新神经元形成的可塑性。本研究的结果显示,慢性应激使孕猪海马的部分细胞形态结构发生了变化,应激组孕猪海马DG颗粒细胞胞核排列松散,染色不均且整体呈锥形,并发生了神经元丢失的情况;CA3区部分锥体细胞出现空泡状,整体排列松散,肉眼可见部分神经元位置空缺;而在应激组CA1区的锥体细胞中可见尼氏小体分布减少,染色较浅。CA3区的树突复杂度也显著下降,树突长度则无显著变化,但本研究镀银染色切片的厚度较薄,树突并不一定能展现其全长并纳入统计,这可能会影响树突长度结果的可信度。树突棘统计结果显示,在CA3区,未成熟和成熟树突棘数量较对照组均有显著下降,在DG中成熟树突棘也有显著下降,这表明制动应激可减少海马神经元新生树突棘的形成或影响新生树突棘的存活率,同时加速成熟树突棘的消除,共同造成海马神经元树突棘密度的降低。细胞形态的变化、树突复杂度和树突棘的数量的变化共同表明,慢性心理应激对于海马的神经元可塑性功能造成了负面影响。
慢性应激通常会引起大脑中BDNF表达水平的降低,降低的程度和应激的性质和程度以及不同脑区都有直接关联。大量研究表明,糖皮质激素和BDNF表现出对海马结构和细胞可塑性的相反作用[34],糖皮质激素对海马神经元可塑性的慢性负面效果可能是通过降低BDNF的表达并下调与其相关的信号通路来达成的[35]。在Radecki等人的研究中,BDNF的缓慢灌注逆转了慢性应激诱导的海马长时程增强(LTP)[36-39]和记忆功能的损伤,证明慢性应激造成大脑中神经元可塑性负面变化可能是通过降低神经元营养供给这一方式达成[40]。在本研究中,制动应激后孕猪海马内的BDNF蛋白表达的显著下降也可能参与了海马神经可塑性的负面转归。
限位栏养殖对于神经可塑性的影响或许不仅仅与制动应激有关,还可能与运动量的减少有关。有研究显示[41],运动量对于大脑血管系统的发生也有影响,在有氧运动参数条件下,运动皮层中的血管结构可塑性主要表现为新生血管生成,运动大鼠大脑区域毛细血管直径增加,内皮细胞核直径增大。因此,作者推测,限位栏养殖所致的母猪运动量减少,对大脑供血造成影响,可能也是限位栏养殖模式影响神经细胞可塑性的一个因素。
4 结 论
制动应激使应激组孕猪海马的DG和CA3区出现了神经元丢失现象,CA3区锥形细胞树突复杂度下降,神经元成熟树突棘和未成熟树突棘数量均显著降低,DG的成熟树突棘显著降低。故制动应激减弱了孕猪大脑海马中CA3区和DG的神经元可塑性。
