多巴胺对出血性脑卒中大鼠胶质纤维酸性蛋白和脑源性神经营养因子表达的影响及保护机制*
2021-12-31曹玉萍孟剑霞程宏伟
曹玉萍 王 倩 孟剑霞 程宏伟
(1 宿州市第一人民医院神经内科 宿州 234000;2 上海交通大学医学院附属第九人民医院药剂科,上海 200011;3 安徽医科大学第一附属医院神经内科,合肥 230022)
脑出血(intracerebral hemorrhage,ICH)是脑卒中的一种常见类型,具有较高的发病率、致残率和死亡率[1-2]。脑出血发生后会引发脑水肿,神经系统功能障碍,以及细胞死亡和凋亡等继发性的神经功能损伤[3-4]。脑出血会增加反应性星形胶质细胞,进而产生胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)。有研究表明GFAP 能通过抑制轴突再生,抑制神经干细胞(NSCs)的增殖和分化;还能减少谷氨酸盐,让脑组织重建时促进血管再生,进而对脑组织进行保护,恢复脑组织的神经功能[5]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对中枢神经系统的发育有重要作用,可维持成年脑组织的正常功能[6]。多巴胺是一种内源性儿茶酚胺类神经递质,在中枢神经系统中有重要的作用,因其具有调节运动的作用被广泛认知[7]。有研究显示,精神障碍疾病会导致多巴胺功能失调,介导神经退行性疾病[8-9]。研究显示[10],多巴胺和白介素等单克隆抗体可保护损伤后的脑组织,但其具体的作用机制尚不清楚。本研究对出血性脑卒中大鼠给予多巴胺进行干预治疗,观察其对出血性脑卒中大鼠脑组织中GFAP 和BDNF 的表达,并分析其对脑组织的保护机制。
1 材料和方法
1.1 实验动物
本实验所有大鼠均来自北京化阜康生物科技股份有限公司,共计60 只健康大鼠,所有大鼠体质量均为(300±20)g,正常饲养大鼠,保证实验室清洁,昼夜交换更替,保持实验室温度在24℃。
1.2 试剂和仪器
盐酸多巴胺注射液(上海禾丰制药有限公司);GFAP 抗体(北京中杉生物试剂公司);BDNF 抗体(武汉博士德生物工程有限公司);TUNEL 染色液(Boehringer Mannheim 公司)。
1.3 动物分组与模型建立
将大鼠分为3 组,即假手术组(sham 组),大鼠脑出血模型组(ICH 组),大鼠脑出血模型给予多巴胺治疗组(DA 组),每组20 只。本研究采用Fredrik[11]的方法制备大鼠脑出血模型,ICH 组和DA 组大鼠分别于右侧脑组织基底核内注入大鼠新鲜的自体不凝血。腹腔麻醉大鼠后,取出大鼠右侧股动脉血,以备颅内注射用。取动脉血后固定大鼠,将大鼠脑切开,暴露前卤;将微量注射器的针端固定于前卤前0.2 mm 处,以及中线右侧旁开3 mm 处,在此处钻出直径为3 mm 的小孔。注射器从孔内进针6 mm,进针处约为大鼠基底核的位置;将大鼠自体的50 μL 的动脉血5 min 内完全注入,15 min后再将注射针慢慢拔出。将颅骨开的小孔用骨蜡进行封闭,把大鼠皮肤完全缝合后消毒。假手术组大鼠除不进行脑内自体血注射外,其他的步骤与ICH组和DA 组大鼠相同。大鼠脑出血模型标准:可见大鼠脑组织切片中有明显的水肿,并且脑室内没有血肿破入。
DA 组大鼠腹腔注射多巴胺溶液干预治疗,20 mg/kg;假手术组和ICH 组大鼠均腹腔注射等量的生理盐水干预,3 组大鼠均连续干预7 d。
1.4 标本采集
将大鼠麻醉,断头处死,取出脑组织,并分离脑组织中血肿的部位,放置于-20℃冰箱中冷藏备用。在制备模型过程中,没有大鼠死亡,全部用于实验。
1.5 神经功能障碍评分
给药后48 h,按照Garcia[12]方法对3 组大鼠的神经功能障碍进行评分,其中自主活动、活动对称性和前肢对称性为0~3 分;触摸触须反应、金属丝鼠笼攀援和触摸双侧躯干反应为1~3 分。累计大鼠最后的得分,分数越低代表神经功能障碍越严重。
1.6 神经元形态比较[13]
神经功能测定后麻醉大鼠,并处死,将去除的脑组织固定于多聚甲醛溶液中,石蜡包埋并切成5 μm 的切片,尼氏染色观察神经元形态,将切片放进入A 液中56℃染色60 min,PBS 漂洗,置于B 液分色数秒至2 min 直至背景色接近无色,自然晾干切片组织,中性树胶封片,显微镜下观察尼氏小体数量。
1.7 脑水肿的测定
单独一批大鼠用于脑水肿的测试。麻醉每组部分大鼠,PBS 溶液从左心室开始灌注,直至留出的液体呈透明时停止灌注。取出血肿周边100 mg 的脑组织,并为脑组织进行称量,称其为湿质量(W);将大鼠的脑组织放在烤箱中烘干处理,对烘干后的质量进行称量,称其为干质量(D)。对脑组织的含水量进行计算,(W-D)/W,最后再乘以百分之百。
1.8 脑组织病理学形态观察
分别将3 组大鼠的脑组织取出,固定后进行石蜡包埋、切片,每个切片均为5 μm,切片脱蜡后行H-E 染色。观察脑组织形态的变化。
1.9 TUNEL 染色检测脑细胞凋亡
取出3 组大鼠脑组织,石蜡包埋后切片,切片脱蜡后加入蛋白酶K 工作液,放置孵育箱中进行孵育,孵育温度为37℃,20 min 后将TUNEL 反应液加入,再孵育1 h,保证孵育环境全程避光,洗涤后将酶标记抗体加入其中,同等环境继续孵育30 min,最后用DAB 显色10 min,再用苏木精进行复染,封片后在显微镜下选取5 个清晰的高倍视野进行观察,计算细胞的凋亡率。
1.10 免疫组织化学显色检测GFAP 和BDNF 的表达
将3 组大鼠的脑组织用福尔马林钠溶液浸泡,石蜡包埋、切片、免疫组织化学显色。阳性细胞为胞质清晰,且呈棕色颗粒状;阴性细胞为无棕色染色颗粒。用图像分析仪对阳性反应物和阳性细胞的百分数进行测定。其中A 为阳性细胞数量的分级[14],0~1%=0+,>1%~10%=1+,>10%~50%=2+,>50%~80%=3+,>80%~100%=4+;阳性细胞显色程度分级用B 表示,阴性为0,弱阳性为1,阳性为2,强阳性为3,最后对免疫组织化学显色进行评分。阳性细胞数量的分级乘以阳性细胞显示程度分级即为免疫组织化学评分。
1.11 统计学处理
采用SPSS 19.0统计学软件进行分析,计量资料用±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评分
与假手术组(17.12±0.52)大鼠相比较,ICH组(8.94±2.36)大鼠的神经功能障碍评分显著减少(P<0.05);与ICH 组相比,DA 组(11.96±0.15)大鼠的神经功能障碍评分显著增加(P<0.05)。
2.2 大鼠神经元形态比较
与假手术组尼氏小体数量(124.5 个±10.3 个)比较,ICH 组尼氏小体数量(35.1 个±5.6 个)显著减少(P<0.05);与ICH 组相比,DA 组尼氏小体数量(82.7 个±7.8 个)明显增加(P<0.05)(图1,见封二)。

图1 大鼠神经元形态比较(尼氏染色,标尺=50 μm)。
2.3 大鼠脑水肿情况比较
与假手术组(77.82%±1.32%)大鼠相比,ICH 组(85.91%±1.82%)大鼠脑组织含水量明显增加(P<0.05);与ICH 组相比,DA 组(78.56%±1.33%)大鼠脑组织含水量明显减少(P<0.05),表明多巴胺可有效改善大鼠脑水肿情况。
2.4 大鼠脑组织形态变化比较
与正常的脑组织形态相比,ICH 组大鼠的脑组织出现了不同程度的水肿,其中一部分神经细胞出现了明显的肿胀,间质之间明显增宽,神经元结构受到了严重的破坏,严重的神经元出现坏死,且有大量的炎性细胞浸润;干预后的DA 组大鼠的脑组织形态得到了明显的改善(图2,见封二)。
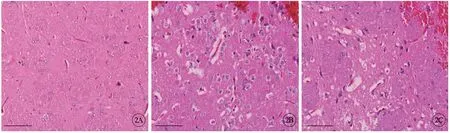
图2 大鼠脑组织H-E染色图,标尺=50 μm。
2.5 脑细胞凋亡情况比较
结果显示,假手术组大鼠无凋亡细胞。ICH组脑细胞凋亡率显著多于假手术组(P<0.05);与ICH 组大鼠相比,DA 组脑细胞凋亡率显著减少(P<0.05)(图3,见封二)。

图3 大鼠脑组织TUNEL染色图,标尺=50 μm。
2.6 大鼠脑组织中GFAP 和BDNF 蛋白表达比较
与假手术组大鼠相比较,ICH 组大鼠脑组织中GFAP 阳性表达增加,BDNF 蛋白阳性表达显著降低(P<0.05);与ICH 组大鼠相比,DA 组大鼠脑组织中GFAP 阳性表达显著降低,BDNF 蛋白阳性表达明显增多(P<0.05)(图4、5,见封二)。

图4 大鼠脑组织中GFAP(A1~C1)和BDNF(A2~C2)蛋白免疫组织化学显色,标尺=50 μm。

图5 3 组大鼠脑组织中GFAP 和BDNF 蛋白表达比较
3 讨论
脑出血通常是指原发性、且非外伤引起的脑实质内出血,占所有脑卒中的30%以上,其中有50%的患者在发病后1 个月内死亡,因此脑出血一直以来都备受临床的广泛关注[15]。目前对脑损伤后神经系统的有效保护,不仅可以减轻患者的脑出血症状,还能一定程度降低死亡率和致残率[16]。当前在临床上有多种神经保护剂,但治疗的效果都不是非常满意,多种因素综合干预脑损伤的神经元损伤是其主要的一种原因,因此单纯的依靠药物治疗很难取得理想疗效。在中枢神经系统损伤后对调节性T 细胞活性混合物的研究中,一种或几种可能传输一个早期信号给调节性T 细胞,疼痛相关的生理化合物在中枢神经系统损伤后被加强,其主要是让调节性T 细胞的运输大量减少,并且对调节性T 细胞的活性进行了抑制。多巴胺和P 物质等都在脑组织和免疫系统中有一定的作用,并且彼此之间能相互作用[17]。但通过实验研究显示,T 细胞的生物活性只有多巴胺能进行有效降低,并且多巴胺多是通过ERK 依赖途径完成[18]。多巴胺能对物质的活性进行抑制。顾新霞等[18]在对小鼠的实验研究中,让小鼠的中枢神经系统发生一定的机械性和化学性的损伤,用多巴胺或D1 受体刺激剂给予小鼠干预治疗,由此发现神经系统受到一定的保护,其可能是通过抑制调节性T 细胞的活性来完成的。本实验通过对脑出血大鼠模型给予多巴胺进行干预治疗,观察多巴胺对脑出血损伤的作用,以及探讨其对脑组织中GFAP 和BDNF 蛋白的影响。
脑出血患者中最为常见的并发症之一是神经功能障碍,在临床上主要表现为反应迟钝和记忆力下降等[19-20]。本研究结果显示,脑出血大鼠模型的神经功能障碍明显加重,且神经细胞的活性明显降低;经过多巴胺干预治疗后大鼠的神经功能和细胞的活性均得到了显著改善。对比3 组大鼠的脑水肿情况显示,脑出血大鼠的水肿情况明显加重,多巴胺治疗后大鼠的脑水肿情况得到了显著的改善,可见多巴胺可一定程度的减轻大鼠的神经功能障碍,同时让脑水肿得到明显改善。贾志英等[21]通过实验研究证实,对于轻度及中度脑缺血缺氧的新生儿,在早期给予多巴胺联合纳洛酮进行干预治疗,新生儿领域评分均得到了显著提高,同时改善患儿神经行为发育情况。在脑出血发生后,脑组织会出现大量细胞凋亡甚至死亡。本研究结果显示,脑出血大鼠脑组织中可见大量的凋亡细胞,给予多巴胺治疗后大鼠脑组织细胞凋亡明显减少,并且该组大鼠的脑组织形态也得到了明显改善。俞茹云等[22]通过动物实验研究显示,多巴胺可有效减少炎症小体的活性,其可能是通过CART 进行,从而保护缺血性脑卒中大鼠的脑组织。
在脑组织中,GFAP 是一种较为特殊的中间丝蛋白,也是星形胶质细胞特异性的主要标志物,作为细胞骨架的GFAP 可有效对抗细胞损伤。本研究结果显示,GFAP 在脑出血大鼠脑组织中表达升高,可见脑出血大鼠脑组织中GFAP 呈高表达。在成熟的神经系统内,神经元的正常功能和活性均需BDNF 进行维持,BNDF 可为损伤的神经元提供必要的营养,同时还能让中枢神经损伤后的运动和感觉功能得到有效恢复。本研究结果显示,ICH 组大鼠脑组织中BDNF 的表达显著低于假手术组,DA组大鼠脑组织中的BDNF 表达得到了显著提高。袁宇等[23]研究表明,多巴胺能有效上调脑出血大鼠脑组织中GFAP 和BDNF 的表达,对神经症状的好转有一定促进作用。刘宇明等[24]对脑出血患者研究显示,患者血清中NSE、GFAP 和BDNF 的表达影响脑出血后患者的认知功能障碍,因此脑出血患者的认知功能障碍可用NSE、GFAP 和BDNF 的表达来进行判断。
综上,多巴胺能抑制脑组织中GFAP 表达,促进BDNF 表达,改善脑出血脑组织的神经功能障碍,进而对出血性脑卒中受损脑组织起到保护作用。
