四十八份青花菜品种SSR指纹图谱构建
2021-12-26林朦婕温慧萍肖建中
林朦婕,温慧萍,肖建中,郑 强,*
(1.丽水学院 生态学院,浙江 丽水 323000;2.华南师范大学 生命科学学院,广东 广州 510631)
青花菜(BrassicaoleraceaL.var.italicPlanch.)是十字花科芸薹属甘蓝种中以花球为产品的一个变种,营养价值高、具较好的抗癌活性[1],是国际流行蔬菜,也是中国大宗的重要蔬菜种类之一,在全国各地均有种植[2]。但目前中国蔬菜种子经营主体数量众多,青花菜种子市场秩序比较混乱,鱼龙混杂,大量伪劣套牌种子的出现不仅造成种子质量下降,也导致病害频发,对种植农户与地方经济造成巨大的负面影响。因此,建立一套准确高效的青花菜品种真实性鉴定技术体系,对打击假冒伪劣种子与规范我国种子市场尤为重要。
农作物的品种鉴定方法主要包括形态学鉴定法、物理化学鉴定法、生化鉴定法和DNA分子标记法等[3]。形态学鉴定法耗时长,易受环境条件的影响,且鉴定结果具有一定的主观性;物理化学鉴定法与生化鉴定法在应用范围上有较大的局限,对于近似品种往往难以区分;DNA分子标记法通过分析DNA水平的差异来进行品种鉴定,具有快速、高效、准确、易实现自动化等优点,越来越受到重视[4]。简单重复序列(simple sequence repeat,SSR)标记,因其具有多态性丰富、稳定性与重复性好、技术简单易于操作等特点,在指纹图谱的构建与品种真实性鉴定方面得到广泛应用。段艳凤等[5]利用筛选到的6对多态性引物成功构建了中国88个马铃薯审定品种的指纹图谱,并能将其完全区分;Zhu等[6]用18对多态性丰富的SSR引物成功构建了浙江省主栽的48个水稻品种的DNA指纹图谱,并成功用指纹图谱进行品种鉴定;王庆彪等[7]利用20对EST-SSR引物构建了中国50个甘蓝代表品种的指纹图谱并用于品种鉴定;赖运平等[8]从952对SSR引物中筛选得到47对核心引物,构建了184份甘蓝型油菜的指纹图谱;公丹等[9]用14对SSR引物系统构建了88份豇豆品种的DNA指纹图谱。近年来,在SSR分子标记技术的基础上,国内已经出台了一系列重要蔬菜品种的分子鉴定技术标准,包括芸薹属的白菜与甘蓝等[10],为解决品种争议、保护育种权益、规范市场奠定了基础。尽管目前有利用分子标记对青花菜进行遗传多样性分析或指纹图谱构建相关的研究,但大多采用的是ISSR(inter-simple sequence repeat)、RAPD(random amplified polymorphic DNA)等分子标记对少数品种样本进行聚类分析或指纹图谱构建[11-12],或者由于采用的引物不具备核心引物特质[13-18],这些研究尚不能系统地应用于青花菜品种的真实性鉴定。为此,本研究以12份遗传差异较大的品种为材料,从945对芸薹属的SSR引物中筛选到了20对核心SSR引物,并构建了48份国内市场常见的青花菜栽培品种的DNA指纹图谱,旨在为开发青花菜品种真实性分子鉴定技术标准或规程,以及为促进国内青花菜DNA指纹图谱库的系统构建奠定基础。
1 材料与方法
1.1 供试材料
48份青花菜材料部分来源于中国青花菜育种单位(北京蔬菜花卉研究所、浙江省农业科学院蔬菜研究所、台州市农业科学研究院等),部分来源于种子经销实体店或网店,涵盖了目前中国市场上主要的青花菜品种,具体信息见表1。

表1 四十八份青花菜代表品种特性与来源
1.2 基因组DNA的提取
称取0.2 g青花菜种子,放入-20 ℃预冷的研钵,加入液氮研磨至细粉状,按照植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司,试剂盒型号DP350]的操作说明,提取青花菜种子基因组DNA,用微量核酸蛋白分析仪测定DNA浓度与纯度,并稀释至40 ng·μL-1备用。
1.3 SSR引物
依据参考文献[13-18]报道的序列,由生工生物工程(上海)股份有限公司合成共合成945对SSR引物,并挑选12份性状差异较大的品种(炎秀、优秀、耐寒优秀、阳光、喜鹊、幸运、黛兰诺、B1199、南秀366、万宝金、TBR-800、曼陀绿)进行引物初筛。
1.4 PCR扩增
1.4.1 降落式PCR
引物初筛过程采用降落式PCR程序。反应体系为20 μL,包括ddH2O 14.4 μL、10× Buffer缓冲液2 μL、Mg2+(25 mmol·L-1)1.2 μL、dNTP Mixture(25 mmol·L-1)0.2 μL、Taq酶(5 U·μL-1)0.2 μL、DNA模板(40 ng·μL-1)1 μL、上下游引物(10 μmol·L-1)各0.5 μL。降落式PCR程序为:94 ℃预变性2 min,94 ℃变性40 s,62.5 ℃退火30 s,72 ℃延伸45 s,每循环降1 ℃,共10个循环;94 ℃变性40 s,52.5 ℃退火30 s,72 ℃延伸45 s,共28个循环;72 ℃延伸5 min,4 ℃保存。
1.4.2 三引物巢式PCR
引物复筛过程与指纹图谱构建则采用了三引物巢式PCR。三引物巢式PCR中的3条引物分别是常规反向引物、5’端带有M13序列的正向引物和荧光标记的M13引物。反应体系25 μL,包括ddH2O 18 μL、10×Buffer缓冲液2.5 μL、Mg2+(25 mmol·L-1)1.5 μL、dNTP Mixture(25 mmol·L-1)0.25 μL;Taq酶(5 U·μL-1)0.25 μL、DNA模板(40 ng·μL-1)1 μL、上游引物(16 μmol·L-1)0.5 μL、下游引物(4 μmol·L-1)0.5 μL、FAM或HEX荧光M13引物(16 μmol·L-1)0.5 μL。三引物巢式PCR程序为:94 ℃预变性5 min,1个循环;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸45 s,共30个循环;94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸45 s,共8个循环;72 ℃延伸10 min,4 ℃保存。
1.5 等位基因检测
引物初筛采用6%非变性聚丙烯酰胺凝胶电泳对PCR产物进行检测,恒定功率80 W[19]。三引物嵌套式PCR产物则采用基于荧光标记的DNA分析检测仪,测定PCR产物片段大小[20]。
1.6 核心引物的确定、指纹图谱的构建
在上述凝胶电泳检测与荧光毛细管检测技术的基础上,根据条带是否清晰可辨、多态性丰富程度、是否在9对染色体上均匀分布等原则,从945对引物中筛选出核心SSR引物,并在这些核心引物的基础上构建48份青花菜品种构建指纹图谱。指纹图谱的构建采用“0,1”阵列模式[21]。
1.7 数据分析
利用Power Marker V3.25软件计算多态性等位基因数量、基因型数目、引物多态性信息含量(PIC)与杂合率。
2 结果与分析
2.1 SSR核心引物筛选
引物初筛采用非变性聚丙烯酰胺凝胶电泳检测,按照扩增条带清晰易辨、等位基因数≥3、品种区分能力强、在染色体上分布均匀等标准,从945对SSR引物中共挑选出46对多态性丰富、带型清晰的引物。按照5号染色体上的扩增位点设计的8对引物(P C5-1~P C5-8)对12份青花菜品种(依次为B1-B8、B10-B12、B16)进行PCR扩增的检测,结果见图1。

十二份青花菜品种依次为B1~B8、B10~B12、B16。
对上述筛出的46对引物进行三引物嵌套式PCR扩增,其扩增产物会带上FAM或HEX荧光标记,可通过DNA分析仪对扩增产物的峰型和等位基因大小进行分析。如图2所示,用荧光标记引物CB10234、Na12A02扩增12份青花菜品种,DNA分析结果表明,所测得12个品种均出现5种不同类型特征峰。FAM荧光标记引物CB10234对应第1种类型的峰值分别为140、148,第2种类型的峰值分别为148、154,第3种类型的峰值分别为140、154,第4种类型的峰值为138,第5种类型的峰值分别为138、148。HEX荧光标记引物Na12A02对应第1种类型的峰值分别为184、196,第2种类型的峰值分别为178、184,第3种类型的峰值分别为178、196,第4种类型的峰值分别为174、196,第5种类型的峰值为184。

图2 引物CB10234(A)、Na12A02(B)在12份青花菜品种中检测到的等位基因类型
按照峰型简单、主峰明显、主峰与次高峰相对位置稳定的筛选标准,最终从46对初筛引物中选择出了20对核心SSR引物,具体信息见表2。
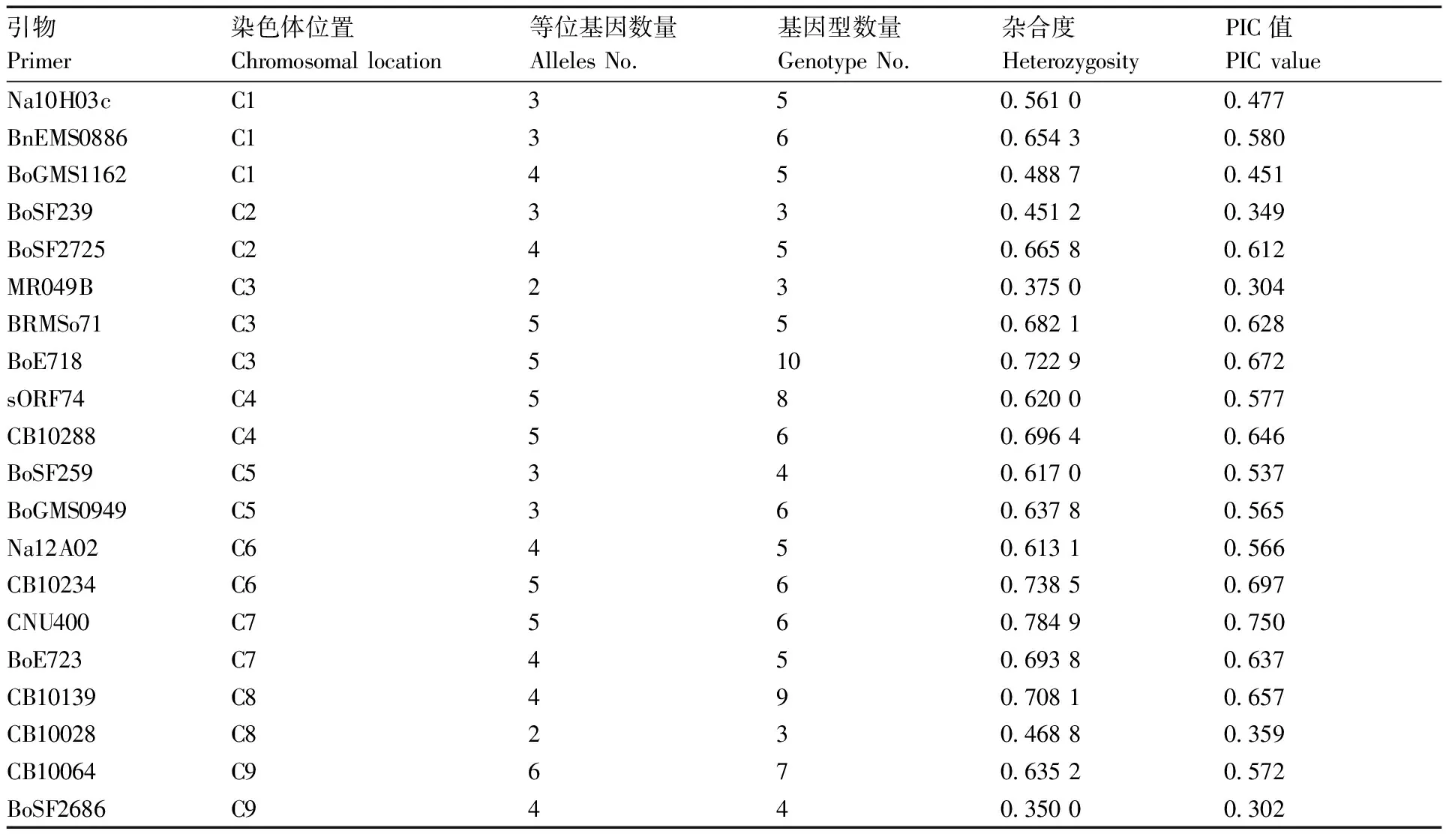
表2 二十对核心SSR引物多态性信息
2.2 SSR指纹图谱的构建
根据20对引物在青花菜品种中的扩增情况,结合聚丙烯酰胺凝胶电泳与荧光标记的DNA分析,构建了48份青花菜栽培品种的DNA指纹图谱。凝胶电泳(图3)能够较为直观地显示不同青花菜品种在某个扩增位点的扩增情况,但由于其分辨率较低,难以准确判断出扩增条带的大小,同时也难以区分条带差异较小的片段,因而只作为DNA指纹图谱的补充。图4为基于20个扩增位点的荧光电泳分型结果构建得到的48份青花菜品种的DNA指纹图谱。该图谱以青花菜品种编号、扩增位点名称和“0,1”阵列为基础制作,其中,“0”代表在相应扩增位点无扩增条带,“1”代为在相应扩增位点有扩增条带,每个青花菜品种均有包含20个位点信息的指纹代码,具有唯一性,每一个指纹代码可作为一个品种的标识。
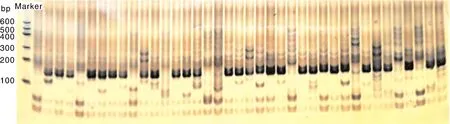
图3 引物Na12A02对39份青花菜品种(依次为B1~B39)扩增的凝胶电泳图

图4 四十八份青花菜品种的DNA指纹图谱
20对核心SSR引物构建的48份青花菜品种的指纹图谱显示:该套核心引物共检测到等位基因79个,平均每条染色体上等位基因4.39个,平均每对引物扩增得到等位基因和基因型数量分别为3.95、5.55个。除了C3上的MR049B位点与C8上的CB10028位点仅有2个等位基因外,其余位点等位基因数量均大于或等于3;其中,等位基因数量最多的是位于C9染色体上的CB10064,共检测到6个,而BRMS071、BoE718、sORF74、CB10288、CB10234、CNU400这6个位点的等位基因数均达到了5个。PIC介于0.302~0.750,平均为0.547。综上信息表明,该套核心引物扩增效果好、多态性丰富,符合核心引物要求。
3 讨论
DNA指纹技术在农作物品种鉴定领域具有无可替代的优势与潜力,逐渐取代传统的形态学鉴定法而成为品种鉴定方法的主流[22]。在众多不同类型的分子标记中,SSR分子标记具有稳定性好、多态性高、共显性遗传等优势,被国际植物品种权保护组织(International Union for the Protection of New Varieties of Plants,UPOV)分子测试指南推荐为品种鉴定与数据库构建的两种优选标记之一。SSR标记进行品种鉴定一般采用一套固定的核心位点组合[22],通过该套核心位点组合的扩增差异进行农作物品种的真实性或身份鉴定。核心引物的筛选和确定是构建指纹图谱的重要环节,本研究借助凝胶电泳检测平台与荧光毛细管检测平台,筛选出的20对引物扩增条带清晰、多态性丰富、在染色体上分布较均匀,通过特异标记及其组合可以有效鉴别市面上大多数青花菜品种的真实性。
优良的种子是保证优良品种遗传特性得以稳定发挥的基础,因此明确品种的真实性是确保优良品种的关键,该图谱可作为青花菜品种鉴定和分类的依据,对青花菜品种真实性的快速、高效、准确鉴定具有重要意义。在构建指纹图谱的方法中,采用“0,1”格式的DNA指纹图谱[21]:以青花菜品种编号、扩增位点名称,以及“0”“1”阵列为基础制得。该方式构建的指纹图谱不仅清晰直观,更重要的是可以利用存储软件(如Excel)的搜索功能对图谱库中的指纹数据进行快速搜索,能够在短时间内从大量的指纹数据中找到目标数据或对目标数据进行对比。
青花菜品种的真实性鉴定可采用2种方法:DNA指纹图谱法或对照品种比对法[22]。DNA指纹图谱法是将待鉴定品种的DNA指纹信息数据与48份青花菜品种的DNA指纹图谱进行比对,若待鉴定品种的DNA指纹信息数据与青花菜DNA指纹图谱库中的某个品种信息一致,则可判断待鉴定品种与指纹图谱库中的该品种为同一品种;若待鉴定品种的DNA指纹信息数据与青花菜DNA指纹图谱库中的48份指纹信息均不一致,则可判断待鉴定品种不属于48份青花菜品种中的任一品种。而对照品种比对法则是利用核心SSR引物组合分别扩增待鉴定品种与对照品种,获得相应的DNA指纹信息数据,并将两者的DNA指纹信息数据进行比较,若两者的指纹信息数据相同,则可判定待鉴定品种与对照品种为相同品种;若两者的指纹信息数据不同,则判定待鉴定品种与对照品种为不同品种。基于SSR分子标记技术的真实性鉴定法在48 h内即可完成青花菜品种鉴定工作,与传统的田间种植鉴定法相比有极大的技术优势。此外,基于此指纹图谱的遗传分析,可以为青花菜品种的谱系研究、分子育种等提供参考信息。
