程序性死亡受体1及其配体信号通路在哮喘发病机制中的作用
2021-12-26戴丽雪汪俊
戴丽雪,汪俊
支气管哮喘是由多种细胞(肥大细胞、嗜酸性细胞等)和细胞组分参与的气道慢性炎症性疾病,临床上反复发作喘息、气急、胸闷和咳嗽,包括了气道高反应性、气道慢性炎症、黏液分泌和气道重构等机制[1]。近年来,全球哮喘的发病率呈不断升高,2014年底哮喘患者已达3.34亿[2],而预计在2025年将达到4亿左右[3]。程序性死亡受体1(PD-1)是属于CD28/CTLA4家族的免疫受体,与配体PD-L1或PD-L2协同负调节宿主免疫反应,而阻断PD-1/PD-Ls信号通路能激活宿主免疫系统。本文就PD-1及其配体信号通路在哮喘机制中的作用作一综述。
Th1/Th2失衡被认为是哮喘发生的经典途径[4],但研究发现,往往哮喘患者中只有1/3的人是通过经典途径介导哮喘的发展,Th1/Th2失衡机制不足以完全解释哮喘的发病机制,其他CD4+T细胞亚群可能在哮喘中扮演一定的角色。T细胞识别抗原提呈细胞(APC)后可介导免疫反应,也可以促进过敏性疾病的发展。而T细胞的激活需要两个信号,第一个是信号免疫应答特异性,TCR识别抗原提呈细胞上的主要组织相容性II类肽复合物;第二个是不可或缺的非特异性共刺激信号(激活或者抑制),共信号受体通常在免疫突触处与TCR分子共定位,与TCR信号协同促进或抑制T细胞活化和功能。共刺激分子[5]能够精细的调控炎症疾病发生发展,主要分为两大类(表1):B7:CD28家族的分子,如程序性死亡配体(PD-Ls)、细胞毒性T淋巴细胞相关抗原4(CTLA-4)、CD80和CD86;肿瘤坏死因子受体(TNFR)超家族的分子,如OX40、CD27、CD30和CD40。程序性死亡受体(PD-1)及其配体(PD-Ls)属于B7/CD28家族,在T细胞活化和耐受中具有广泛的表达和免疫调节作用,生理状态下PD-1/PD-Ls信号通路能保护机体自身组织免受攻击[6]。因此,了解PD-1/PD-Ls信号通路与哮喘之间的相关机制有利于进一步发现治疗过敏性疾病的潜在靶点。

表1 共刺激分子在过敏性疾病和哮喘中的作用Table 1 Role of costimulatory molecules in allergic disease and asthma
1 PD-1/PD-Ls的结构和表达
程序性细胞死亡受体-1被称为刹车分子,具有一个IgV结构域的残基,是免疫球蛋白超家族的一员,常表达于T细胞表面,并且能诱导T细胞、B细胞以及单核细胞的激活,在外周耐受中起着抑制作用从而避免机体处于过度活跃的状态。缺乏PD-1受体的小鼠最终能发展成自身免疫性疾病,导致外周耐受的丧失[7]。PD-1有两个配体PD-L1(也称为B7-H1或CD274)和PD-L2(也称为B7-DC和CD273),属于B7:CD28受体家族,PD-L1和PD-L2二者在氨基酸同源性上可达40%,高于B7家族的其他配体[8]。可以发现PD-L1和PD-L2都能在肥大细胞上表达,但静息状态下T细胞和B细胞均不表达PD-1。而相较于PD-L2,PD-L1表达范围明显更宽,PD-L1不但能表达于树突状细胞(DC)、巨噬细胞、T细胞、培养的骨髓源性肥大细胞和间充质干细胞以及多种非造血细胞上表达[9-10],Dong等[11]报告PD-L1高表达于大多数癌组织中,癌细胞可以通过其表面的PD-L1与T细胞上的PD-1结合来逃脱免疫系统的追杀,起到损害抗肿瘤的T细胞反应,这就为通过阻断PD-1治疗肿瘤提供了一条新道路[12]。PD-L2只在树突状细胞、巨噬细胞和骨髓来源的肥大细胞上诱导表达,但PD-L2的亲和力却是PD-L1的2~6倍。
2 PD-1/PD-Ls信号通路在哮喘中的作用机制
2.1 PD-1/PD-Ls信号通路的生物学功能
利用单克隆抗体的Fab片段来研究PD-1和PD-L1/PD-L2相互作用及主要差异,发现PD-L1的配体不仅为PD-1,还存在的另一个配体CD28,能促进T细胞活化和存活[13]。PD-L1、PD-L2不仅可以诱导不同的功能,而且二者之间存在竞争交叉,在结合和解离特征水平上存在显著差异,PD-L1发生的构象变化使与PD-1的结合机制更复杂[14]。PD-1/PD-Ls信号通路(图1、2)通过抑制PI3K/Akt和Ras/MEK/Erk途径,抑制SKP2的转录和激活Smad3来靶向细胞周期机制。同时PD-1/PD-Ls信号通路会使细胞周期发生停滞,使其在细胞周期的G0/G1期聚集,少部分可能是由于该途径能够减少IL-2的生来阻碍T细胞进入细胞周期的数量导致的。PD-1/PD-L1信号通路的刺激信号使得PD-1胞质结构域的免疫受体酪氨酸抑制基序(ITIM)与免疫受体酪氨酸转换基序(ITSM)磷酸化,聚集蛋白酪氨酸磷酸SHP-1和SHP-2,继而抑制AKt上游活化因子PI3K,使得AKt无法发生磷酸化且细胞存活因子Bcl-xl也被抑制,产生负性刺激,抑制T细胞活化。
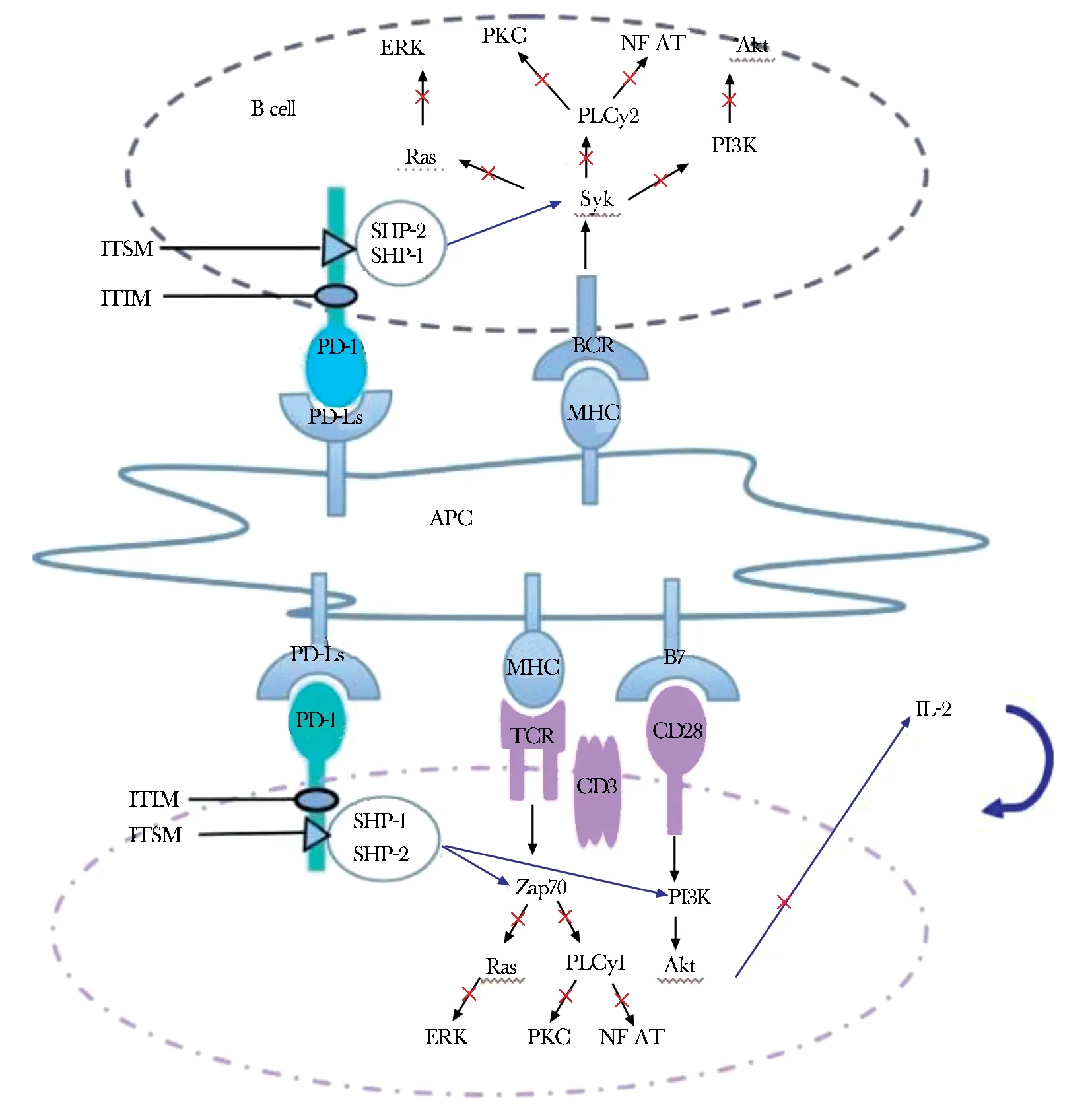
图 1 PD-1/PD-Ls通路的抑制信号
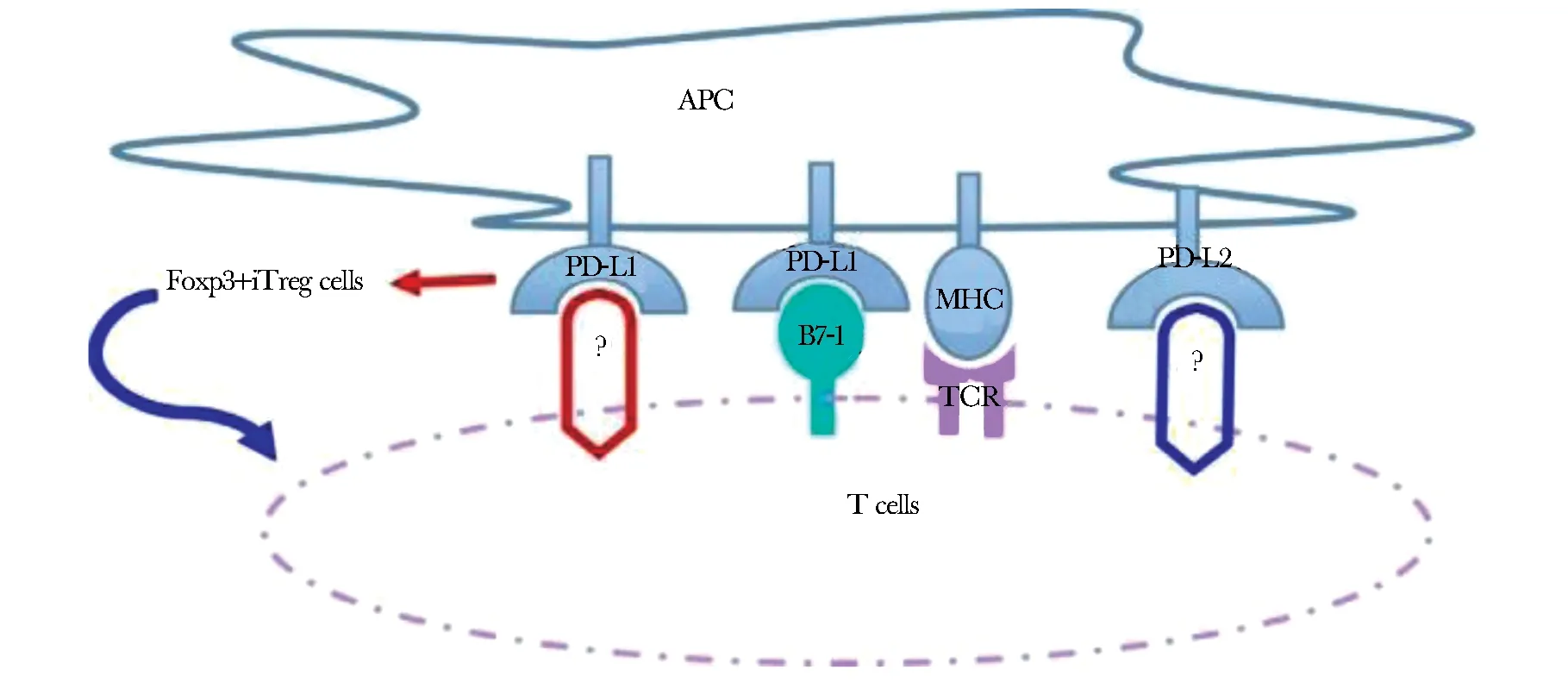
图 2 PD-Ls介导的其他信号通路
2.2 PD-1/PD-Ls信号通路通过iNKT细胞介导哮喘发生
在哮喘小鼠中,我们通过检测PD-L1和PD-L2配体,发现二者对过敏性气道和iNKT细胞的作用效应,表明了分别缺乏PD-L1和PD-L2配体对气道高反应性的诱导有截然不同的效应[15]。PD-L2与PD-1的结合能使得IL-4、IL-13的降低从而降低气道高反应性[16-17],而PD-L1与PD-1结合后的作用恰恰相反会使AHR升高。缺乏PD-L1或PD-L2配体表达对iNKT细胞的发育不存在影响,而对于缺陷iNKT细胞的小鼠,在致敏原的刺激之下能检测到TH2细胞因子的变化,但最终并没有气道高反应性的增高,但从野生型哮喘小鼠转移iNKT细胞可促进AHR的激发,间接证实了iNKT细胞是AHR的必备条件,进一步表明了iNKT细胞在哮喘中的重要作用。
iNKT细胞激活需要如CD4+T细胞一样需要TCR和共刺激分子的共同刺激信号,PD-L2能与iNKT细胞上的相应受体结合并激活。过敏源(OVA)致敏小鼠时,缺乏PD-L2配体的小鼠AHR和气道炎症的严重程度都明显高于野生型小鼠,并且相应的iNKT细胞产生的Th2细胞因子(如IL-4)也多于野生组。抗PD-L2单抗作用小鼠肺中嗜酸性粒细升高以及Th2细胞因子生成,能增强哮喘反应,猜测是因为阻断了PD-L2对IL-5和IL-13产生的负信号[18]。由PD-L2介导的IL-4反馈环能抑制其自身的持续增加从而控制哮喘的严重程度,而缺乏PD-L1配体的小鼠iNKT细胞分泌的IFN-γ水平相较于野生型小鼠的iNKT细胞分泌的IFN-γ水平显著提PD-1/PD-L1信号通路的刺激信号使得PD-1胞质结构域的免疫受体酪氨酸抑制基序(ITIM)与免疫受体酪氨酸转换基序(ITSM)磷酸化,聚集蛋白酪氨酸磷酸SHP-1和SHP-2,继而抑制AKt上游活化因子PI3K,使得AKt无法发生磷酸化且细胞存活因子Bcl-xl也被抑制,抑制细胞活化,从而降低下游分子的激活;PD-1:程序性死亡受体1;PD-Ls:程序性死亡配体;ITIM:免疫受体酪氨酸抑制序列;ITSM:免疫受体酪氨酸转换基序;ERK:细胞外调节蛋白激酶;PKC:蛋白激酶C;NFAT:活化T细胞核因子;PLCy1:磷脂酶Cy1;PLCy2:磷脂酶Cy2;SYK:脾酪氨酸激酶;PI3K:磷脂酰肌醇3-激酶;AKT:丝氨酸/苏氨酸激酶(蛋白激酶B);SHP-1:蛋白酪氨酸磷酸酶1;SHP-2:蛋白酪氨酸磷酸酶2;BCR:B细胞表面受体;TCR:T细胞表面受体;MHC:主要组织相容性复合体;APC:抗原呈递细胞;CD3:白细胞分化抗原3;CD28:白细胞分化抗原28;Zap70:70 kDa的酪氨酸激酶;IL-2:白细胞介素-2高,气道高反应性降低,但抗PD-1单抗治疗哮喘反应却没有明显反应效果[19]。因此,了解调节PD-L2/PD-L1和iNKT细胞之间的复杂机制有利于制定哮喘治疗的新方案,靶向iNKT细胞的治疗可能在临床上有效的限制气道高反应性和哮喘的发展。
2.3 PD-1/PD-L1信号通路通过Treg/Th17平衡介导哮喘发生
PD-1及其配体能在调节T细胞上面表达,而PD-L1在调节诱导的iTreg细胞发育和维持功能方面具有关键作用,在缺乏PD-L1配体小鼠中,功能性Foxp3+iTreg细胞的发育存在缺陷。Treg细胞具有免疫调节和免疫抑制能力,叉头翅转录因子盒3蛋白(Foxp3)是Tregs的最佳标记物[20]。目前可将其分为两类,一类是来源胸腺并且能够高度表达叉头状/螺旋状转录因子P3(Foxp3)的CD4+CD25+Treg细胞,另一类是由变应原诱导产生的诱PD-L1可以通过连接B7-1介导抑制信号,单独PD-L1可以诱导幼稚CD4+T细胞转化为Foxp3+诱导的Treg细胞积极抑制效应T细胞;PD-L1和PD-L2同样可以通过非PD-1受体提供刺激阳性信号; PD-L1:程序性死亡配体-1;PD-L2:程序性死亡配体-2;B7-1(CD28):白细胞分化抗原80;MHC:主要组织相容性复合体;APC:抗原呈递细胞;TCR:T细胞表面受体;Foxp3+iTreg cells:为表达叉头状家族转录因子Foxp3的调节T细胞导性Treg细胞,能分泌IL-10、TGF-β等发挥抑炎作用,此外也能直接刺激或改变T细胞表型和功能引起Th1细胞反应。
Treg/Th17在调节哮喘经典途径TH1/TH2比例失衡中具有内在平衡能力,在维持机体免疫稳态和变态反应中方面发挥的重要作用[21]。PD-1在PD-L1中的部分作用可能是通过Treg/Th17免疫发挥功能来实现平衡的免疫应答。PD-L1一方面能够通过降低Akt及其下游底物mTOR信号、减弱p42/ERK2的磷酸化来诱导iTreg细胞的发生,而另一方面通过增强Foxp3的表达来促进iTreg细胞的诱导和维持来抑制T细胞的反应,保护组织免受损伤。阻断PD-L1导致Treg细胞数量不足,诱导Treg细胞凋亡和降低Treg/Th17比率破坏机体免疫耐受[22]。继来自肺或脾组织的NTregs和iTregs受体小鼠经历了AHR和过敏性气道炎症的逆转,治疗效果从第4周明显表现。我们研究了PD-1在Tregs治疗中的作用,分离绿色荧光蛋白转基因小鼠肺组织当中的Treg细胞,可观察到小鼠气道炎症以及气道高反应性的增加,当抗PD-1基因敲除分离过后的Treg在体外对T细胞的抑制减弱,而使用雌激素治疗可发现功能恢复,猜测Tregs通过PD-1受体起到抑制部分效应T细胞的作用,抗PD-1抗体能阻断Treg的治疗作用[23]。
我们应该了解PD-1受体对Tregs调节过敏性哮喘的AHR和气道炎症至关重要,PD-L1可调控Treg细胞从而作为哮喘的有利治疗靶点,通过提高PD-1及其配体PD-L1/PD-L2的表达和活性,为治疗过敏性哮喘开辟新的里程碑。
2.4 PD-L2独立于PD-1/PD-L1信号通路介导哮喘发生
PD-L1虽然在DC上高表达,但暂时还未发现PD-L1对DC的内在作用,但对于同一细胞上同时存在PD-L1和PD-L2,可能由于二者之间存在竞争作用而无法观察到PD-L2的效应[24]。在哮喘小鼠模型中,致敏小鼠肺DCs和巨噬细胞中高表达PD-L2,当哮喘小鼠注射PD-L2抗体,而不是PD-1抗体或PD-L1抗体,可增强气道高反应性和促进TH2细胞因子(IL-4、IL-13等)的产生,Matsumoto等[25]也通过实验比较缺乏PD-L2小鼠及其野生型对照组之间的哮喘表型,探讨了PD-L2诱导的下游途径。当小鼠被致敏时,其肺泡灌洗液(BALF)中的嗜酸性粒细胞数量明显高于对照组。PD-L2缺乏小鼠的AHR以及BALF中的IL-5和IL-13的浓度明显高于对照组,而IFN-Y的浓度明显低于对照组。PD-L2相较于PD-L1阻断具有更大的效应导致T细胞的大部分增强,间接说明了PD-L2对于抑制T细胞增殖的起主导重要地位[26]。同时我们还发现了PD-L2对自身的DCs存在内在的作用,区别于PD-1/PD-L2信号通路产生的效果,它能介导IL-12细胞因子增多和T细胞的激活来增强免疫应答[27],PD-L2在哮喘中的作用存在相互矛盾的现象。
哮喘的严重程度与PD-L2的表达程度相关,在中重度哮喘小鼠中尤其明显。过敏源致敏小鼠后,在效应期中单纯阻断PD-L2降低了小鼠气道的高反应性,但其IgE、EOS数量却未见明显变化,而当阻断PD-1时AHR却无明显变化,这个过程与IL-12的降低有关[28],变应原致敏APC与PD-L2抑制IL-12的产生,而IL-12能抵抗IL-13的基因诱导和激活因子STAT6的磷酸化从而导致气道高反应性,在效应期阻断IL-12,PD-L2直接促进IL-13促进过敏性哮喘高反应性,从侧面也表明了IL-12的生成并不是借由TH2细胞反应的相对减弱造成的,而是IL-12与IL-13之间的存在重要联系。由于对于分别阻断PD-L2和PD-1可观察到AHR的不同结果以及PD-L2能在抑制PD-L2与PD-1相互作用之下还能抑制的IL-12的产生,我们从中可以得知PD-L2可能以独立于PD-1作用于其他配体的方式促进AHR,从而调节哮喘的严重程度,靶向PD-L2对哮喘具有潜在治疗作用。
2.5 PD-L2通过Th9细胞(不同的T细胞亚群)介导哮喘发生
PD-L2可以通过不同的T细胞亚群来影响哮喘的发生机制。TH9是CD4+T细胞的不同亚群之一,体外研究表明,Tn9亚群的极化需要TGF-β和IL-4的存在以及IFN-γ的缺失。PD-L2能通过IFN-γ依赖性机制调节哮喘。慢性过敏源暴露后,Kerzerho等[29]研究中发现致敏小鼠4周前肺的Th2细胞因子分泌,而在第6周之后可见TH9 因子的大量堆积,肺中由于缺乏TGF-β、IL-1a存在Th9细胞发生。试验中借用缺陷的PD-L2小鼠来观察其对Th9的作用效应以及AHR的调控情况,数据显示PD-L2缺陷小鼠肺组织TGF-β的显著提升,促进Th9细胞因子增强发展和粘液分泌,导致肺部炎症过程严重。PD-L2缺陷小鼠的肺组织IL-9浓度和疾病严重程度具有一定的相关性,用抗IL-9抗体能过减轻AHR和肺部炎症[30]。PD-L2在对慢性哮喘患者中Th9细胞因子、气道高反应性调节中起着重要效果,深入研究PD-L2、Th9细胞之间的认识能为过敏性哮喘以及自身免疫性疾病提供了新的策略,但在急性重症哮喘中的作用还未明确阐述。
3 讨论
哮喘是一种异质性疾病,受到众多因素调控但具体发病机制还未明确。哮喘严重影响患者的生活水平,增加社会医疗负担,已成为现今社会中日益突出的健康问题。免疫疗法即靶向药物治疗已成为精准医疗的主要潮流[31],共刺激分子在过敏性疾病和哮喘中起到不可或缺的作用,PD-1/PD-Ls信号通路相互作用机制复杂,B7-2在一定程度上也促进了哮喘的发生,B7-H3也能通过调节不同T细胞亚群活性促进自身免疫性疾病[32],研究人员也发现先天性淋巴样细胞(ILC)在过敏源刺激下能高水平表达PD-1,引起肺部炎症,它们之间对哮喘的影响程度不一[33]。目前研究最多热议的就是PD-1/PD-Ls信号通路。PD-1刺激一方面有助于移植耐受、维持自身免疫平衡以及减少自身免疫性疾病的发生[34],但另一方面也同时参与慢性病毒感染和癌症的免疫逃逸机制[35],目前PD-1/PD-L1抑制剂(例如纳武利尤单抗,帕博利珠单抗等)常用于癌症疾病的治疗,药物不良反应也是常常存在的,在过敏性疾病上的应用研究还较少。不过相信通过深入研究阐述它们之间的发病机制,提高PD-1及其配体PD-Ls的表达和活性,可以为精准治疗过敏性哮喘开辟新纪元,但如何在免疫性疾病和肿瘤治疗之间达到最佳平衡还是需要进行探索思考。
