中国伞形蜈蚣藻和亚栉状蜈蚣藻的合种研究
——基于形态观察、早期发育及分子分析
2021-12-24张昕陶王宏伟
马 跃 卞 瑶 温 馨 张昕陶 王宏伟
(1. 辽宁师范大学生命科学学院,大连 116081; 2. 辽宁师范大学,辽宁省植物生物技术重点实验室,大连 116081)
伞形蜈蚣藻Grateloupia corymbcladia仅记载于《中国海藻志》[1], 是李伟新等根据采自浙江省温州市南麂岛构托的四分孢子体的外部形态和内部结构特征建立的新种。 《中国海藻志》共记载了31种蜈蚣藻属Grateloupia海藻, 其中有10种是根据外部形态及部分内部结构特征命名的新种, 但是由于蜈蚣藻属海藻的外部形态具有多样的特点, 仅通过外部形态很难对藻体进行区分; 《中国海藻志》对于藻体内部结构特征的记录也不甚完整; 受到当时实验条件的限制, 没有更为准确的方法用于海藻分类, 这些新种是否成立存在着争议。针对这些问题, 作者团队运用形态观察、早期发育和生活史等与分子分析相结合的分子辅助的形态分类学方法,对海藻志中记载的我国产的部分蜈蚣藻属新种进行了重新鉴定, 其中除阳江蜈蚣藻G. yangjiangensisLi et Ding[2]作为新种成立外, 其余种类陆续被重新修订。李芳等[3]运用分子辅助形态分类学方法对帚状蜈蚣藻G. fastigiataLi et Ding进行了重新鉴定,结果显示帚状蜈蚣藻与亚洲蜈蚣藻G. asiaticaKawaguchi et Wang为同一种; 刘芳等[4]运用相同的方法将对枝蜈蚣藻G. didymecladiaLi et Ding进行了重新鉴定, 结果表明对枝蜈蚣藻为亚栉状蜈蚣藻G. subpectinata的同物异名; Liu等[5]对青岛蜈蚣藻G. qingdaoensisLi et Ding重新鉴定, 同样发现其作为新种不成立, 并将其作为亚洲蜈蚣藻的同物异名。
亚栉状蜈蚣藻是在1912年由Holmes[6]最初命名的, 由于其多变的外部形态, 有学者又将其作为长枝蜈蚣藻G. prolongataJ. Agardh和G. filicina(Lamouroux) C. Agardh的同物异名[7—9], 直到2004年, Faye等[10]的研究才将其恢复为一个独立的种。21世纪以来, 法国、西班牙、新西兰、日本和韩国等多个地方被证实有亚栉状蜈蚣藻的分布[11,12],2016年刘芳等[4]将对枝蜈蚣藻修订为亚栉状蜈蚣藻, 证明了亚栉状蜈蚣藻在中国也有分布。
本研究利用分子辅助的形态分类学方法对分布于我国浙江省温州市南麂岛(模式标本产地)的伞形蜈蚣藻和亚栉状蜈蚣藻进行了比较研究, 明确了二者的分类地位及关系。本研究结果将为《中国海藻志》内容的更新及修订提供新信息和资料。
1 材料与方法
1.1 材料的采集与处理及形态观察
伞形蜈蚣藻样本和亚栉状蜈蚣藻雌配子体样本于2017年5月26日和2019年5月19日采自模式标本产地浙江省温州市的南麂岛。
将采集到的伞形蜈蚣藻标本去除附着在表面的杂质和其他藻类, 选择成熟带有囊果的活体标本空运回实验室, 其他结构完整的藻类用于制作腊叶标本, 硅胶干燥标本。活体标本用于孢子早期发育研究, 腊叶标本用来观察藻体外部形态, 冰冻切片用于观察内部结构, 硅胶干燥标本用于提取DNA;将采集到的成熟有囊果的亚栉状蜈蚣藻活体标本空运回实验室用于孢子早期发育研究。冰冻切片用Olympus BH2数字显微镜观察, 再从中选取效果好的切片通过Nikon HFX-IIA照相机记录。本研究所用标本存放于辽宁师范大学生命科学学院植物标本室(LNU; 表 1)。
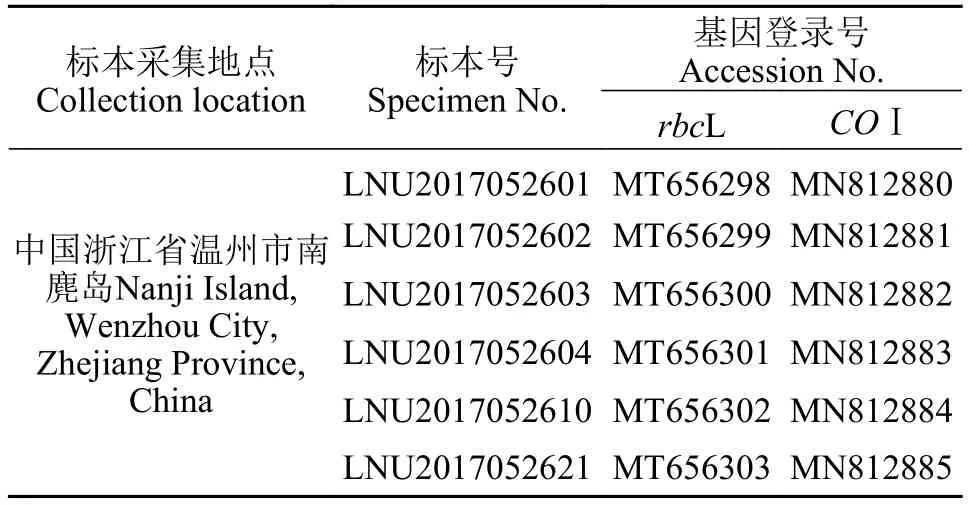
表1 伞形蜈蚣藻标本采集地点、标本号及基因登录号Tab. 1 Collection location, specimen numbers and GenBank accession numbers of G. corymbcladia
1.2 早期发育
首先, 玻璃培养容器提前用清水冲洗并用75%酒精浸泡的脱脂棉擦拭, 晾干后再用灭菌海水冲洗3次。然后, 在培养容器底部铺满载玻片, 将处理干净的新鲜藻体及灭菌的氧气泵放入容器中, 倒入灭菌海水直至没过海藻。氧气泵通电, 将培养容器放入光照培养箱(LRH-250-GB)内, 培养条件设置为温度20 ℃, 光照强度80 μmol/(m2·s), 光周期(Light∶Dark)12L∶12D, 等待孢子释放。24h后, 观察孢子释放情况, 当显微镜视野(10×10)下孢子释放量达到20—30个时, 把载玻片移入培养液中, 放进光照培养箱(LRH-250-GB)继续培养。每天观察一次孢子的变化, 并用Olympus BX53荧光显微镜和Olympus BH2数字显微镜观察记录。每2天更换1次培养液。
1.3 分子分析
按照植物基因组DNA提取试剂盒(TIAGEN,Valencia, CA, Beijing)的步骤提取伞形蜈蚣藻藻体全基因组DNA, 用于PCR扩增。rbcL和COⅠ基因引物设计参考并改进Wang等[13]的方法, 引物组合为:rbcF57—rbcR753,rbcF654—rbcR1381,COⅠF1-COⅠR1(表 2)。根据Yang等[14]的设计进行PCR扩增及产物的电泳检测, 引物合成、扩增产物的纯化和测序均由上海生工生物公司完成。

表2 PCR扩增所需引物Tab. 2 Primers used for PCR
rbcL序列分析: 从GenBank中选取并下载了包括产地为浙江省温州市南麂岛的亚栉状蜈蚣藻(基因登录号为: KY047357)在内的23个蜈蚣藻属物种[2,4,10,13—22]及海膜属Halymenia的H. durvillei和海柏属Polyopes的P. constrictus[23]2个外群种的rbcL基因序列与6个伞形蜈蚣藻rbcL基因序列进行比对分析。
COⅠ基因序列: 从GenBank中选取下载了包括产地为浙江省温州市南麂岛的亚栉状蜈蚣藻(基因登录号为: KY047379)在内的14个蜈蚣藻属物种及2个外群种H. floresia和P. affinis[14,24]的COⅠ基因序列与6个伞形蜈蚣藻COⅠ基因序列进行比对分析。
基因序列比对应用软件Clustalx(1.83)。应用MEGA6.0软件构建系统进化发育树并分析各物种碱基之间的差异度, 计算遗传距离的模型为Number of differences和双参数遗传距离(K2-P), Bootstrap值设置为1000次。
2 结果
2.1 伞形蜈蚣藻的外部形态
藻体直立(图 1a), 紫红色, 软骨质, 高15—30 cm。主枝扁平, 长4—6 cm, 末端延长为亚扁形, 宽2—5 mm。藻体主枝两侧分布有小羽枝, 分布方式为对生或互生, 且基部不缢缩(图 1b和1c); 主枝两侧也分布有1—2回羽状分枝, 基部缢缩, 有的分枝上不生小枝,有的则在分枝上再生出小羽枝, 分布方式亦为对生或互生。囊果呈球形, 稍突出藻体表面, 散乱分布于除固着器外的整个藻体上(图 1d)。
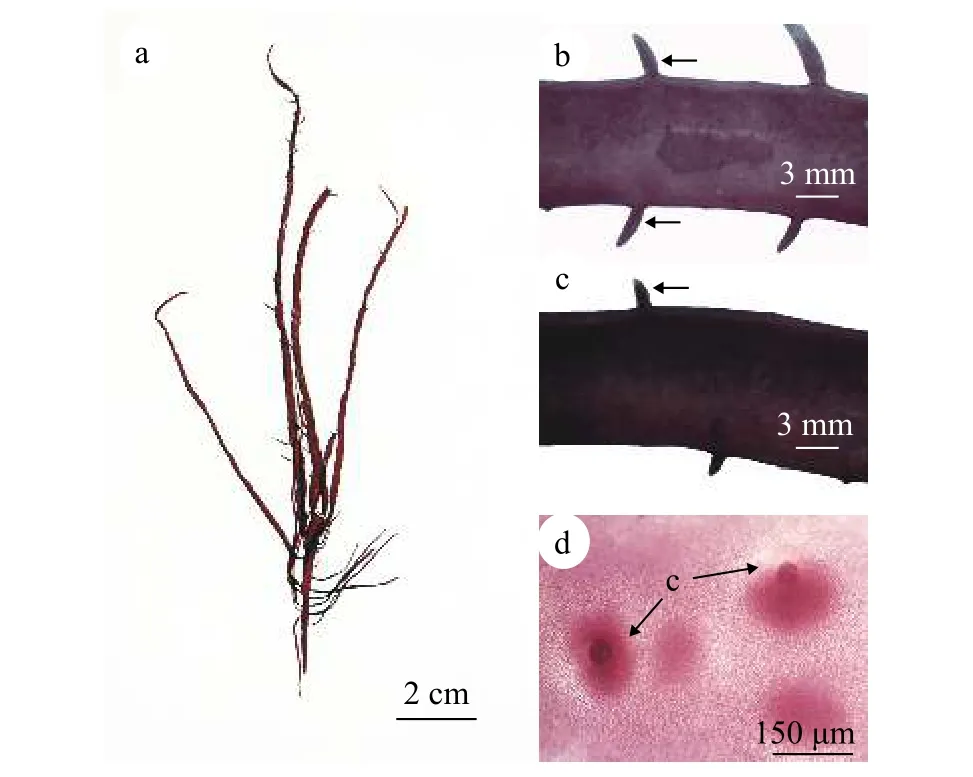
图1 伞形蜈蚣藻的外部形态及表面观Fig. 1 External morphology and surface view of G. corymbcladia
2.2 伞形蜈蚣藻的内部结构
营养结构: 藻体厚度约为85—110 μm, 由皮层及髓部构成(图 2a和2b)。皮层由5—11层细胞构成,其中外皮层细胞有3—5层, 呈圆形或长椭圆形, 内皮层细胞2—6层, 呈不规则多角边形。髓部由髓丝组成, 髓丝长16—36 μm, 宽2—3 μm, 在髓部纵走或交织在一起。藻体幼嫩时髓部致密, 且髓丝随着藻体生长而增长, 藻体衰老时髓部中空或髓丝少。
生殖结构: 果胞枝生殖枝丛产生于内皮层细胞, 其主枝由5个细胞构成, 分别为末端带有受精丝的壶形果胞, 1个椭圆形的下位细胞和3个卵圆形细胞。主枝上的每个细胞都带有不育侧枝, 且这些不育侧枝以指向藻体表面并向内弯曲的状态共同形成瓶状体(图 2c和2d)。辅助细胞生殖枝丛也产生于内皮层细胞, 其主枝包括4个细胞, 其中相对较大的细胞为辅助细胞。该枝丛主枝上的每个细胞同样都带有不育侧枝, 同时也以与果胞枝生殖枝丛同样的状态形成瓶状体(图 2e)。
精子是由雄配子体藻体表面的精子囊释放的,精子囊由皮层细胞产生。精子可以通过雌配子体表面的受精丝到达果孢, 与其中的卵子结合完成受精作用。受精后的果胞先后与下位细胞和果胞枝上的基细胞融合形成融合细胞。融合细胞能够产生联络丝, 联络丝逐渐延伸与相邻的辅助细胞相连,随后相近的融合细胞与辅助细胞发生融合。融合后的辅助细胞再与周围的瓶状体中其他细胞继续融合形成融合复合体(图 2f)。接着融合复合体中一部分细胞横向分裂延伸成营养丝, 另一部分向藻体表面纵向分裂延伸成产孢丝, 并在产孢丝的顶端产生果孢子。而后营养丝与周围髓丝相互缠绕逐渐发育为囊果被, 果孢子被包裹在其中, 即为囊果(图 2g和2h)。随着囊果的成熟, 果孢子会从藻体表面的囊果孔释放(图 2i)。成熟囊果可在藻体表面观察到(图 1d), 其直径范围为180—240 μm。
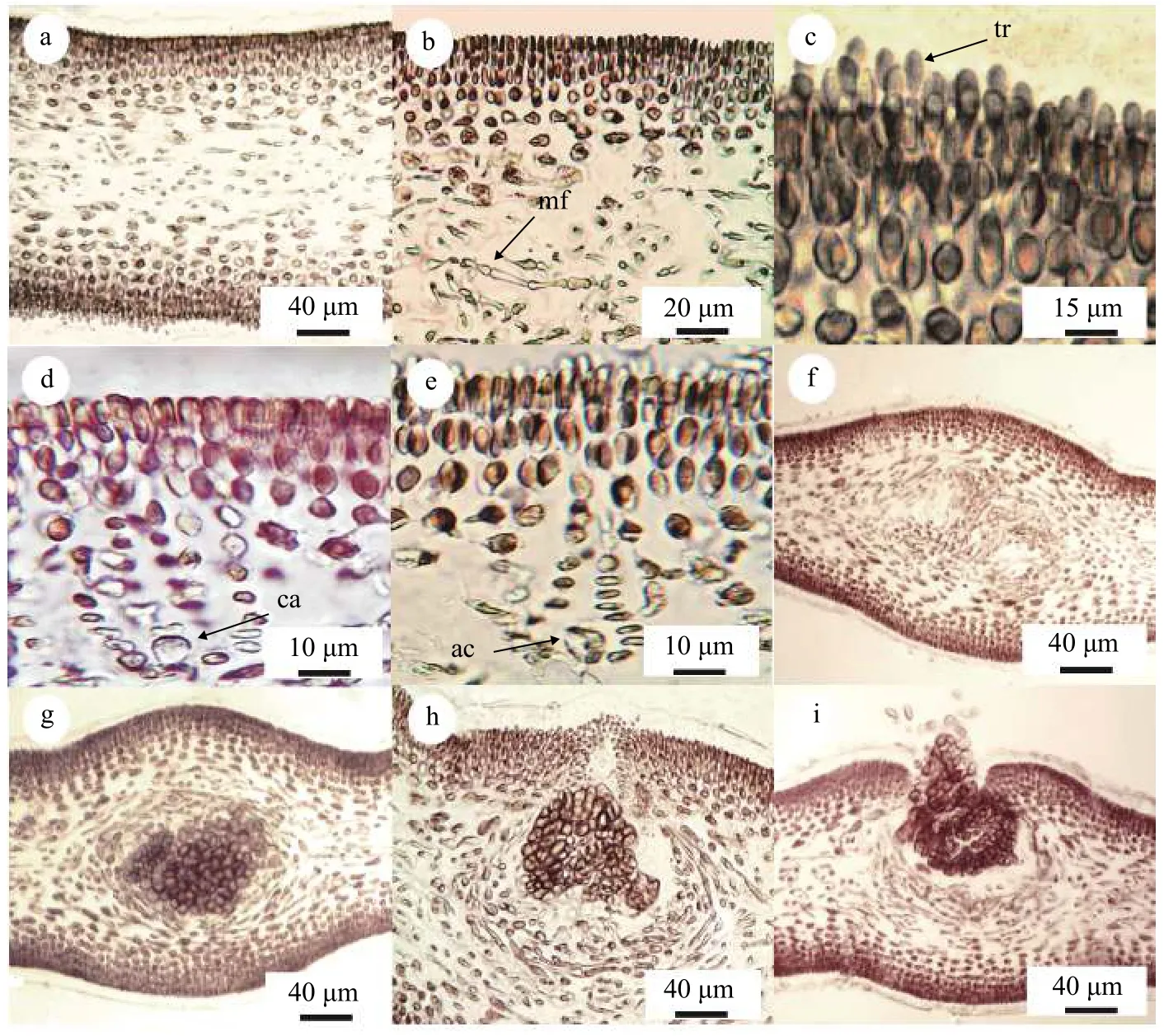
图2 伞形蜈蚣藻内部结构Fig. 2 The internal structure of gametophyte of G. corymbcladia
图3a为伞形蜈蚣藻四分孢子体表面观, 四分孢子囊产生于藻体皮层细胞, 成熟的四分孢子囊稍突出于藻体表面, 散落分布于伞形蜈蚣藻的主枝和小枝上(图 3a)。成熟的四分孢子囊呈十字形分裂, 长为50—60 μm, 宽15—20 μm, 由四分孢子囊母细胞(图 3b)经减数分裂先形成二分体(图 3c), 再分裂形成四分体(图 3d)。
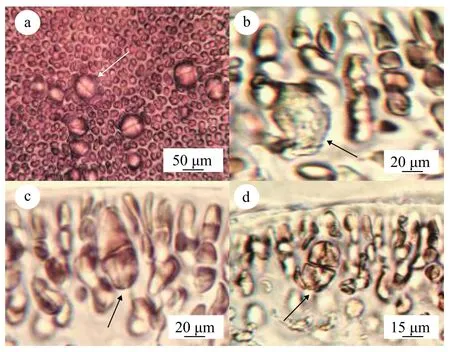
图3 伞形蜈蚣藻四分孢子体内部结构(LNU2017052601)Fig. 3 The internal structure of tetrasporophyte of G. corymbcladia (LNU2017052601)
2.3 伞形蜈蚣藻和亚栉状蜈蚣藻的早期发育
在实验室条件下同时培养了伞形蜈蚣藻和亚栉状蜈蚣藻。伞形蜈蚣藻成熟雌配子体表面分布有囊果, 藻体上成熟的囊果释放大量果孢子至载玻片(图 4d)。果孢子球形, 紫红色, 直径20 μm左右(图 4a)。24h后, 果孢子一端形成萌发管且原生质体开始向萌发管移动, 原位置会形成空泡, 空泡中含有透明的胶状物质(图 4b)。当原生质体全部移动入萌发管后, 原生质体与空泡间形成隔膜(图 4c和4e)。随后, 原生质体开始分裂, 随着分裂产生细胞数量的增多, 空泡及其内部的透明胶质逐渐变小消失, 至此到达细胞团阶段(图 4f—j)。当细胞团水平方向分化出基细胞且垂直方向分化出顶细胞时进入到盘状体阶段(图 4k)。几个盘状体会相互靠近并发生盘状体融合(图 4l—m), 当盘状体到达一定大小, 会逐渐向上发育为直立枝(图 4n), 而后进一步发育为幼苗(图 4o)。亚栉状蜈蚣藻早期发育过程与伞形蜈蚣藻完全一致。
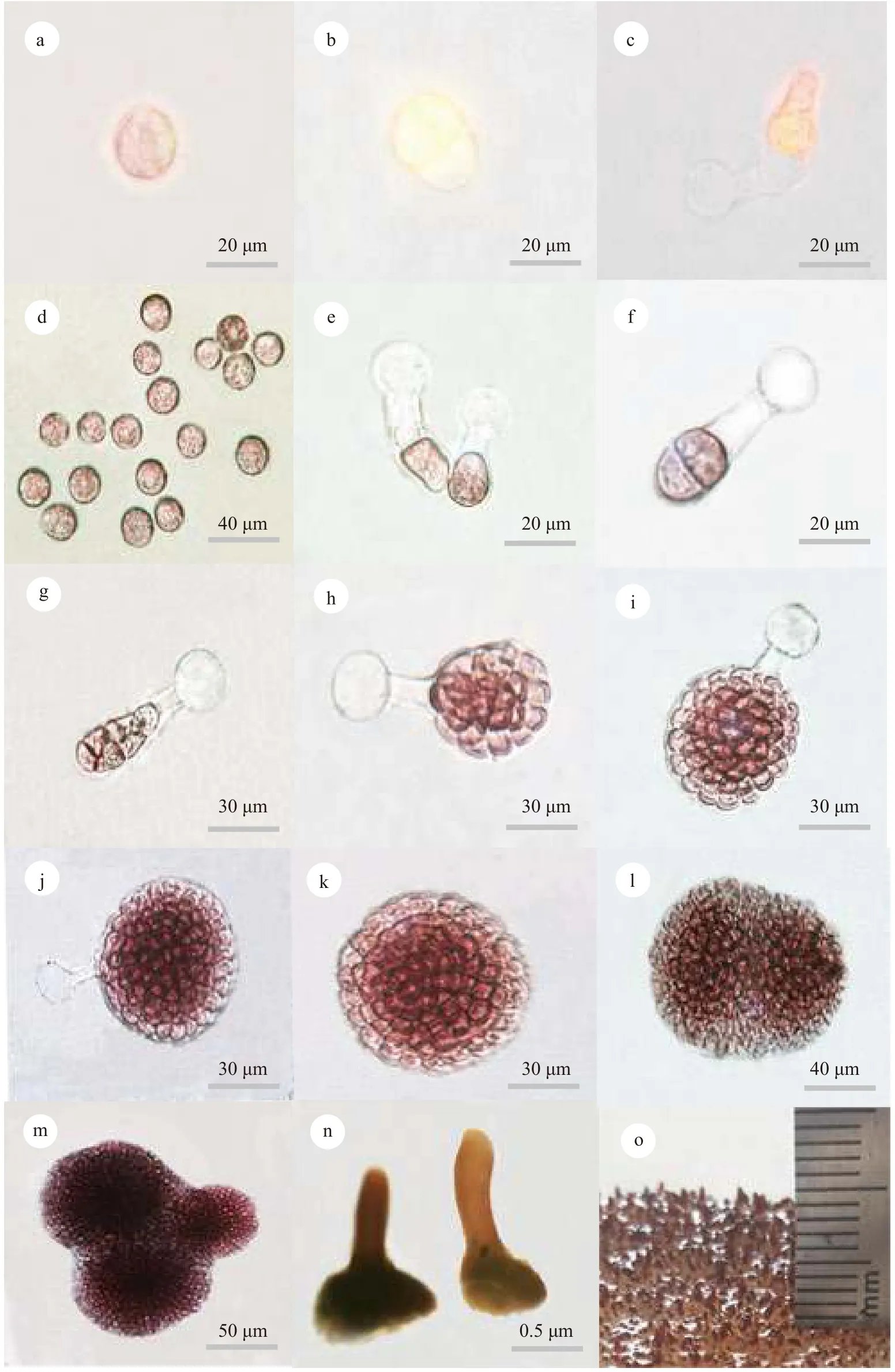
图4 伞形蜈蚣藻的早期发育Fig. 4 Early development of G. corymbcladia
2.4 基因序列分析
rbcL基因序列分析 本研究共获得6条伞形蜈蚣藻的rbcL基因序列, 序列长度均为1317 bp, 比对校正后的长度为1124 bp。
rbcL基因序列比对(MAGE6.0)结果显示(图 5),伞形蜈蚣藻的6个样本之间无碱基差异, 与亚栉状蜈蚣藻无碱基差异, 形成一个单独的小分支, 区别于其他种。伞形蜈蚣藻和亚栉状蜈蚣藻与带形蜈蚣藻G. turuturu的碱基差异为12 bp(1.089%), 与东方蜈蚣藻G.orientalis的碱基差异为38 bp(3.366%);与2个外群种H. durvillei和P. constrictus的碱基差异分别为63 bp(5.564%)和65 bp(5.780%)。
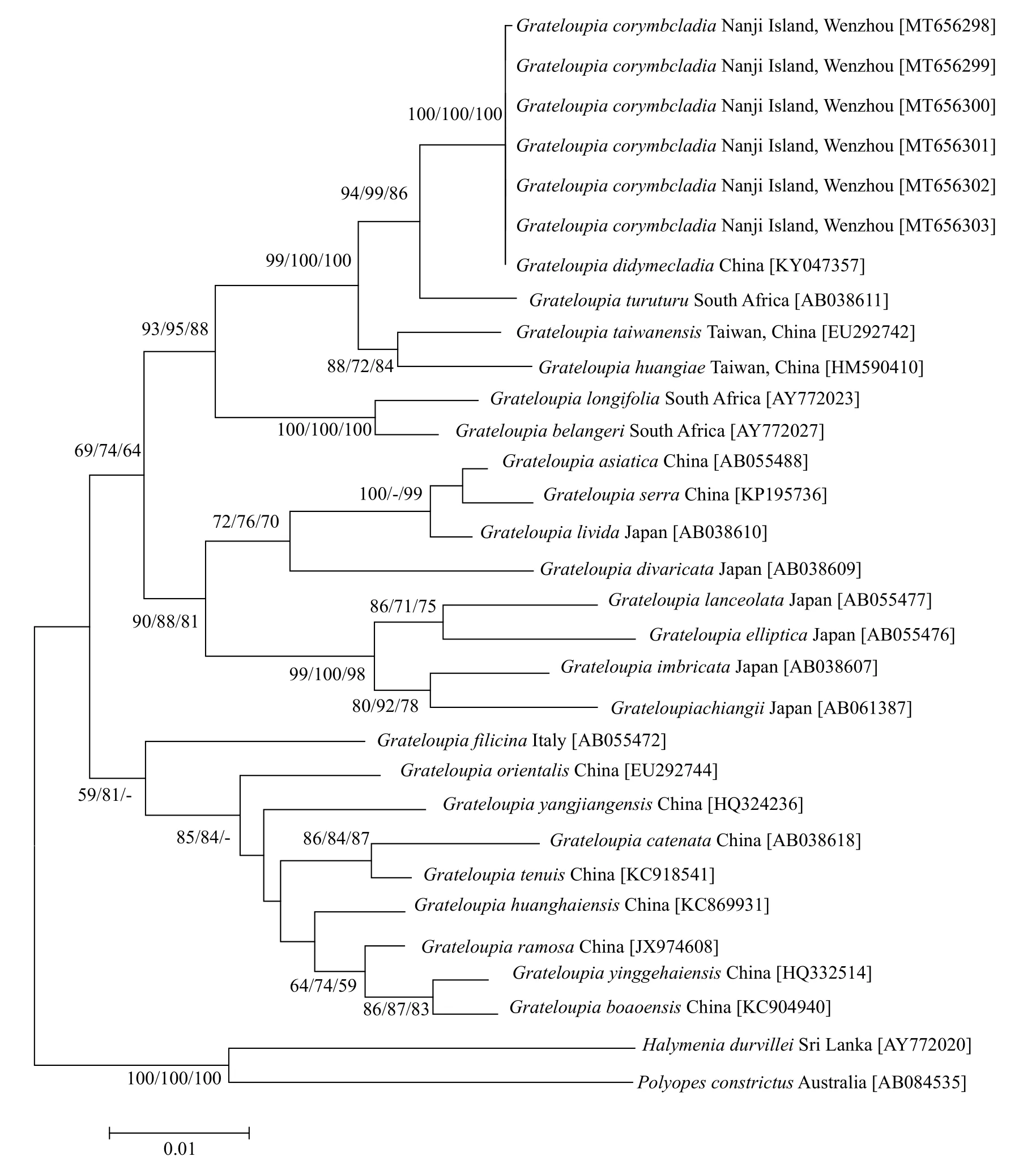
图5 基于rbcL基因构建的ML系统发育树Fig. 5 Phylogenetic tree based on partial rbcL sequences data
COⅠ基因序列分析本研究共获得6条伞形蜈蚣藻的COⅠ基因序列, 序列长度均为649 bp,比对校正后长度为552 bp。
COⅠ基因序列比对(MAGE6.0)结果显示(图 6),伞形蜈蚣藻的6个样本之间无碱基差异, 与亚栉状蜈蚣藻无碱基差异, 形成一个单独的小分支, 区别于其他种。伞形蜈蚣藻和亚栉状蜈蚣藻与带形蜈蚣藻的碱基差异为16 bp(2.983%), 与链状蜈蚣藻G. catenata的碱基差异为35 bp(6.440%); 与2个外群种H.floresia和P. affinis的碱基差异分别为42 bp (7.570%)和48 bp(8.638%)。
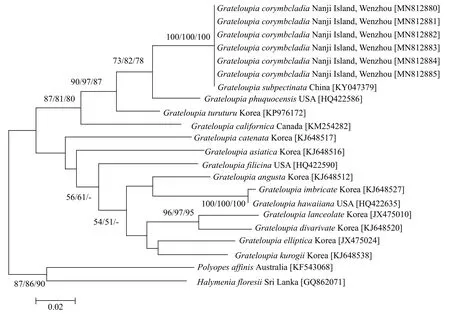
图6 基于COⅠ基因构建的ML系统发育树Fig. 6 Phylogenetic tree based on partial COⅠ sequences data
3 讨论
海藻分类最初运用的是经典的形态学分类方法, 该方法主要通过藻体的外部形态及生殖结构来区分鉴定物种, 但当面对形态相似的藻类时, 其鉴定结果就会缺乏准确性[25]。随着分子技术的发展,分子分析逐渐取代形态观察成为更为准确的鉴定种的方法, 而形态观察更倾向于用作藻类的初步归类以及作为分子结果的补充, 在这种趋势下, 分子
辅助的形态分类学方法应运而生。分子辅助的形态分类学方法的提出不但解决了形态分类学与分子分类学之间的矛盾, 还可以通过分析基因序列建立新的形态学分类标准, 对鉴定已知种和发现新种等都具有重要意义。该方法一经提出便在国际上获得广泛认可, 不仅成为国外海藻分类重要方法[26—28],在国内也得到了广泛应用: 作者团队应用该方法对蜈蚣藻属藻类进行了更为准确的鉴定, 报道了莺歌海蜈蚣藻G. yinggehaiensisWang et Luan和齿状蜈蚣藻G. serraWang et Lou等8个新种[15—20,29], 获得普遍认可。以上事实充分显示了分子辅助的形态分类学方法在海藻分类学中的地位及其可靠性。
本研究运用分子辅助的形态分类学方法对伞形蜈蚣藻和亚栉状蜈蚣藻进行了研究。通过观察外部形态发现二者基本相同但略有差异(表 3)。2016年李芳等[3]指出蜈蚣藻属海藻外部形态变化较大,同一物种也会因为标本采集的时间、地点和生态环境的不同而存在差异; 伞形蜈蚣藻的内部结构特征与亚栉状蜈蚣藻相关研究中报道的内部结构特征一致, 二者的辅助细胞生殖枝丛类型均为Grateloupia型(5cpb-4auxb型)。1970年Chiang[30]指出海膜科的辅助细胞生殖枝丛类型有5种, 其中Grateloupia型为蜈蚣藻属典型类型, 可作为鉴定蜈蚣藻属海藻的重要特征, Kawaguchi等[31]随后再次明确了生殖枝丛结构对于蜈蚣藻属分类鉴定的重要意义; 在实验室条件下培养伞形蜈蚣藻和亚栉状蜈蚣藻的雌配子体, 观察到二者释放的孢子均先产生萌发管再分裂形成盘状体, 孢子早期发育类型均为“间接盘状体”型。作者团体还对缢基蜈蚣藻和披针形蜈蚣藻等[32—36]几种蜈蚣藻的孢子早期发育进行了研究, 结果均为“间接盘状体”型, 可见“间接盘状体”型为蜈蚣藻属海藻孢子早期发育的一种重要类型; 基于rbcL和COⅠ基因序列分析结果显示, 伞形蜈蚣藻与产自浙江省温州市的亚栉状蜈蚣藻之间无碱基差异, 聚集在一个单独的分支上。2016年李芳等[3]提出rbcL序列在蜈蚣藻属中的种内遗传变异为0.0—1.0%, 2015年Yang等[14]提出COⅠ基因序列在蜈蚣藻属中的种内遗传变异为0.0—1.6%, 本研究中伞形蜈蚣藻和亚栉状蜈蚣藻与蜈蚣藻属其他种之间的差异均大于上述范围, 属于种间差异。综合上述结果, 伞形蜈蚣藻与亚栉状蜈蚣藻在外部形态、内部结构、早期发育及分子分析等方面均一致, 即《中国海藻志》记载的伞形蜈蚣藻和亚栉状蜈蚣藻为同一种。同时我们也可以得出, 相比于传统分类学参照的形态学分类方法, 分子辅助的形态学方法从多个方面研究并最终明确伞形蜈蚣藻的分类学地位, 得到的结果更具科学性和可靠性,对传统分类方法具有指导意义。

表3 伞形蜈蚣藻和亚栉状蜈蚣藻的形态特征比较Tab. 3 Comparison of morphological characteristics of G. corymbcladia and G. subpectinata
4 结论
本研究运用分子辅助的形态分类学方法, 从形态观察、早期发育及分子分析等方面对伞形蜈蚣藻与亚栉状蜈蚣藻进行了详细研究, 结果显示二者为同一种, 伞形蜈蚣藻不成立。根据优先法则, 将伞形蜈蚣藻作为亚栉状蜈蚣藻的同物异名。
