中华鳖组蛋白H2A变体克隆及其在卵母细胞中的表达分析
2021-12-24祝骏贤刘晓莉王亚坤洪孝友于凌云徐红艳朱新平
祝骏贤 陈 辰 刘晓莉 王亚坤 雷 骆 洪孝友 于凌云 徐红艳 李 伟* 朱新平 *
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院珠江水产研究所农业农村部热带亚热带水产资源利用与养殖重点实验室, 广州 510380)
中华鳖(Pelodiscus sinensis)是我国常见的水产养殖品种, 年产量达30余万吨[1]。一直以来, 水产养殖业选取效益较高的性别进行单性养殖, 是很多学者研究的目标, 中华鳖养殖业也具有高效全雄繁育的需求。近些年, 虽然国内外学者围绕中华鳖的性别控制及单性繁育已开展了一系列的探索性研究,但仍未取得实质性进展[2]。开展中华鳖性控育种,首先需要了解其性别差异的理论机制, 特别是在分子生物学层面上, 为此我们做了一些研究尝试。在之前的工作中, 我们通过对中华鳖发育初期雌雄性腺转录组进行差异分析, 筛选到许多与性别相关的基因, 组蛋白H2A变体就是其中之一, 其相对表达量与中华鳖雌性性别显著相关(数据未发表)。因此, 我们以组蛋白H2A变体为目标基因, 对其进行初步研究。
组蛋白H2A是染色质核小体的核心组蛋白之一(H3、H4、H2A和H2B), 是维持染色体结构和功能所必需的[3,4], 组蛋白H2A广泛参与了转录调控、DNA修复和染色质浓缩等生物学过程[5—7]。此外,组蛋白H2A还拥有众多变体, 其中包括H2A.X、H2A.Z、H2A.BbD和macroH2A等[8—10]。它们的差异主要在于C端的长度和序列的不同[11]。MacroH2A和H2A-Bbd仅限于脊椎动物或哺乳动物[12], MacroH2A主要富集在哺乳动物雌性中的非活性X染色体上[13], H2A Bbd则定位于活性X染色体和常染色体[12], 而H2A.X和H2A.Z则在整个基因组中组成性表达和定位[14]。在小鼠(Mus musculus)中, H2A.Z几乎不存在于正在生长的卵母细胞核中(第5天卵母细胞除外), 但是在囊胚期的细胞核中可以检测到荧光信号[11]。在裂殖酵母(Schizosaccharomyces pombe)中, H2A.Z还可以通过调节染色体结构, 以促进减数分裂中DNA双链断裂(DSB)的形成, 从而促进配子的发生[15]。H2A.X在小鼠整个卵子发生过程中和植入前的胚胎的核中都可检测到其表达[11],同时敲除H2A.X可以导致雄性小鼠不育[16]。H2A.Bbd在小鼠胚胎原核期和2细胞期的细胞核中均显示较弱的表达信号, 但从4细胞期到胚泡期的细胞核中可以检测到强信号[11]。同时, 也有研究表明H2A.Bbd也存在于哺乳动物睾丸的高级生精组分和人类成熟精子的染色质中[17]。然而, 目前在龟鳖类动物中有关组蛋白H2A变体在性别分化中的功能尚未得到很好的解析。在这里, 我们克隆了中华鳖PsH2A的同源物, 分析其表达模式, 并对其转录本在卵巢组织中进行卵母细胞定位, 以研究其在卵母细胞发育成熟过程中的作用。
1 材料与方法
1.1 实验动物的收集和处理
实验于2019年1、4、7和10月份选取1、2和3冬龄健康的中华鳖, 雌雄各6只, 共144只, 全部来自于广东惠州财兴实业有限公司。将鳖麻醉后放血, 解剖, 掀开背甲, 然后采集精巢、卵巢、心脏、肝脏、脾脏、肾脏、脑和肌肉等组织, 速冻后,-80℃保存, 用于总RNA提取。另外, 再取一部分卵巢组织用4%多聚甲醛(Solarbio, China)固定, 4℃冰箱过夜。然后用甲醇/1×PBS(DEPC水配制)梯度脱水, 并置于100%甲醇中, -20℃保存, 用于制备切片。
1.2 RNA的提取与cDNA的合成
采集的组织使用Eastep®Super试剂盒(Promega, China)提取总RNA, 浓度和纯度由NanoQTM分光光度计测定, RNA的完整性由1%琼脂糖凝胶电泳检测, 使用M-MLV反转录试剂盒(Invitrogen,USA)进行cDNA第一链的合成。
1.3 中华鳖PsH2A cDNA的克隆
根据测序所得的中华鳖PsH2AcDNA序列, 设计上下游特异性引物Ps-H2A-F和Ps-H2A-R (表 1)。以中华鳖卵巢cDNA为模板进行PCR扩增, 反应条件为: 94℃ 2min; 98℃ 30s, 55℃ 30s, 72℃ 90s (共35个循环); 72℃延伸10min。PCR产物使用Gel Extraction Kit (Omega, China)试剂盒回收。然后将目的片段连接到pMD19-T (TaKaRa, China)载体, 转化至DH5α感受态细胞(TaKaRa, China)中, 克隆筛选,并将阳性克隆送广州天一辉远基因科技有限公司测序。DNAMAN软件预测氨基酸序列, Clustal W(BioEdit)软件进行氨基酸序列对比, 按MEGA 7软件的邻近法(Neighbour-Joining, NJ)构建系统进化树。

表1 用于中华鳖PsH2A基因克隆和表达分析的引物Tab. 1 Primers used for cDNA cloning and expression analysis of PsH2A in P. sinensis
1.4 组织表达
根据测序所得的中华鳖PsH2AcDNA序列, 设计一对特异的定量引物PsDL-H2A-F和PsDL-H2AR, 并以中华鳖EF1α为内参基因(表 1)。以成体卵巢、精巢、心脏、肝脏、脾脏、肾脏、脑和肌肉的cDNA为模板, 进行RT-qPCR和RT-PCR扩增。RT-qPCR扩增反应在StepOnePlus real-time PCR System (Applied Biosystems)中完成, 每组3个平行重复, 采用2-ΔΔCt法来计算目的基因的相对表达量,反应程序如下: 95℃预变性10min; 95℃ 15s, 60℃15s, 72℃ 15s (共40个循环); 95℃ 15s, 60℃ 30s,95℃ 15s。RT-PCR使用与RT-qPCR相同的特异性引物(PsDL-H2A-F/PsDL-H2A-R, 表 1)进行扩增, 反应程序如下: 94℃ 2min; 98℃ 30s, 58℃ 30s, 72℃40s (共30个循环); 72℃延伸10min。作为对照, 从相同的cDNA样本中扩增出内参基因(EF1α)。RTPCR产物由1%的琼脂糖凝胶进行分离, 并拍照(Alpha Innotech, USA)。
1.5 探针的制备
根据测序所得的中华鳖PsH2AcDNA序列设计一对特异性引物PsCISH-H2A-F和PsCISH-H2AR(表 1), PCR扩增产物通过1%的琼脂糖凝胶分离, 并用Gel Extraction Kit试剂盒(Omega, China)进行胶回收。将纯化后的产物连接到pMD19-T(TaKaRa, China)载体中, 然后转入DH5α感受态细胞(TaKaRa, China)中, 筛选阳性克隆, 提取质粒,送至天一辉远生物技术有限公司进行测序。使用SP6/T7 Enzyme Mix (Roche, Germany)和Digoxigenin (DIG) RNA Labeling试剂盒(Roche, Germany)体外合成正反义探针。
1.6 冰冻切片的制备
将现取的卵巢组织, 置于4%的多聚甲醛(Solarbio, China)中, 4℃冰箱固定过夜。使用甲醇/1×PBS(DEPC水配制)梯度脱水, -20℃保存。待切片时, 使用甲醇/1×PBS(DEPC水配制)梯度复水, 并置于30%蔗糖溶液中, 4℃冰箱过夜, 具体步骤按张飘逸等人的方法进行[18]。待组织块完全沉入管底后,取出, 用OCT(SAKURA, USA)包埋, Leica冷冻切片机(CM1950)切成4—6 μm厚的切片贴于防脱载玻片上。
1.7 化学原位杂交
化学原位杂交操作过程按照Xu等[19,20]的方法进行。采用BCIP/NBT(Roche, Germany)显色液进行化学显色, 50%甘油(PBS配置)封片, 使用尼康Ri2显微镜观察并用NIS Elements成像系统拍照。根据中华鳖卵子发生过程中滤泡细胞及透明带等结构特征, 对其进行分期和鉴定[21,22]。
1.8 数据分析
每个实验独立重复至少3次。所有实验数据均以平均值±标准误表示, 并使用SPSS软件进行方差分析和Duncan氏多重比较,P<0.05表示差异显著。
2 结果
2.1 中华鳖PsH2A cDNA序列特征
克隆获得的中华鳖PsH2AcDNA (GenBank登录号: MZ546415)序列全长为575 bp, 5′端非编码区(5′-UTR) 68 bp, 3′端非编码区(3′-UTR) 108 bp, 开放阅读框(Open reading frame, ORF)为399 bp, 共编码133个氨基酸, 具有H2A超家族特有的结构功能域,我们将其命名为PsH2A。氨基酸序列同源性比对结果显示: 其与三趾箱龟(Terrapene carolina triunguis)和绿海龟(Chelonia mydas)的同源性最高, 分别为82.71%和80.45%; 与白喉带鹀(Zonotrichia albicollis)和朱红蜂鸟(Calypte anna)的同源性分别为56.92%和51.11%; 与非洲爪蛙(Xenopus tropicalis)和蚓螈(Microcaecilia unicolor)的同源性分别为52.38%和49.59%; 与斑马鱼(Danio rerio)和虹鳟(Oncorhynchus mykiss)的同源性分别为53.49%和54.26%; 与人(Homo sapiens)和褐家鼠(Rattus norvegicus)的同源性分别为52.71%和54.55%。NJ系统进化树结果表明,PsH2A在进化关系上与龟类动物较近, 其次是鸟类、两栖类和鱼类, 与哺乳动物较远(图 1)。
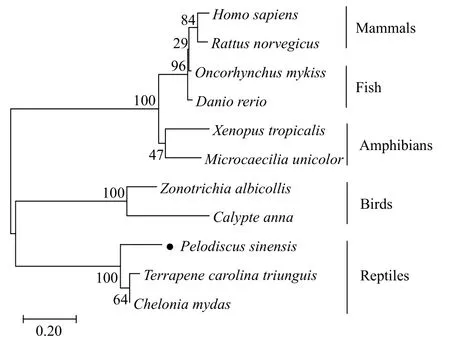
图1 采用NJ法构建中华鳖PsH2A系统进化树Fig. 1 Phylogenetic tree using the neighbor-joining method
2.2 中华鳖PsH2A mRNA组织表达
以EF1α为内参基因, 利用RT-qPCR和RTPCR检测PsH2A转录本在4月份, 1冬、2冬和3冬龄中华鳖各组织中的相对表达。结果显示, 在1冬、2冬和3冬龄中华鳖个体中,PsH2AmRNA在卵巢中具有较高水平的表达(P<0.01), 而在精巢、肌肉、脑、肾脏、脾脏、肝脏和心脏等体组织中几乎检测不到, 提示中华鳖PsH2AmRNA的表达具有组织特异性和性别二态性。PsH2AmRNA在1冬龄到3冬龄中华鳖雌雄性腺的表达见图 2。PsH2AmRNA在3冬龄中华鳖体组织中的表达见图 3。
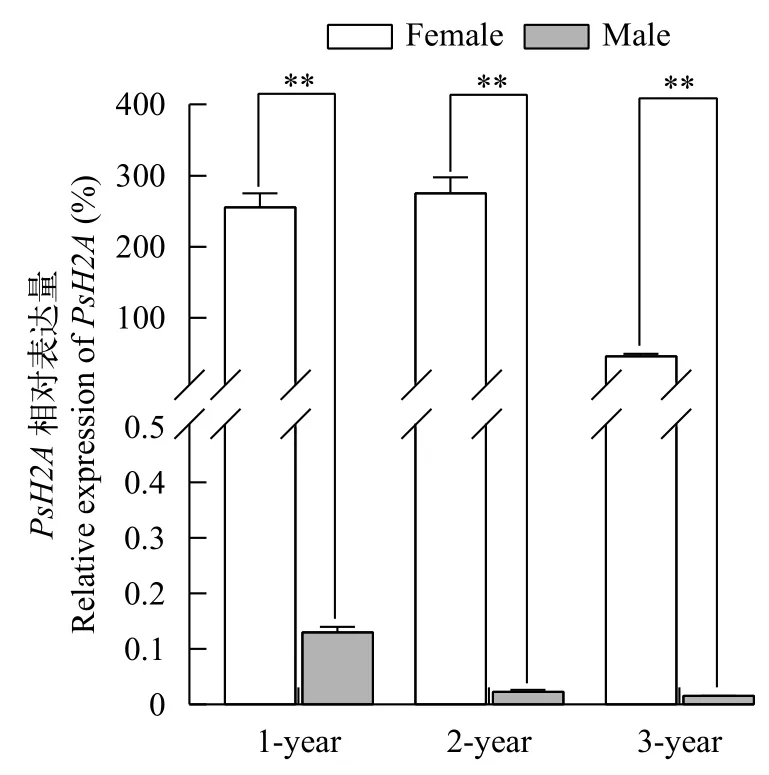
图2 中华鳖PsH2A mRNA在4月份不同冬龄雌雄性腺中的相对表达Fig. 2 The relative expression of PsH2A mRNA in female and male gonads of different ages in April
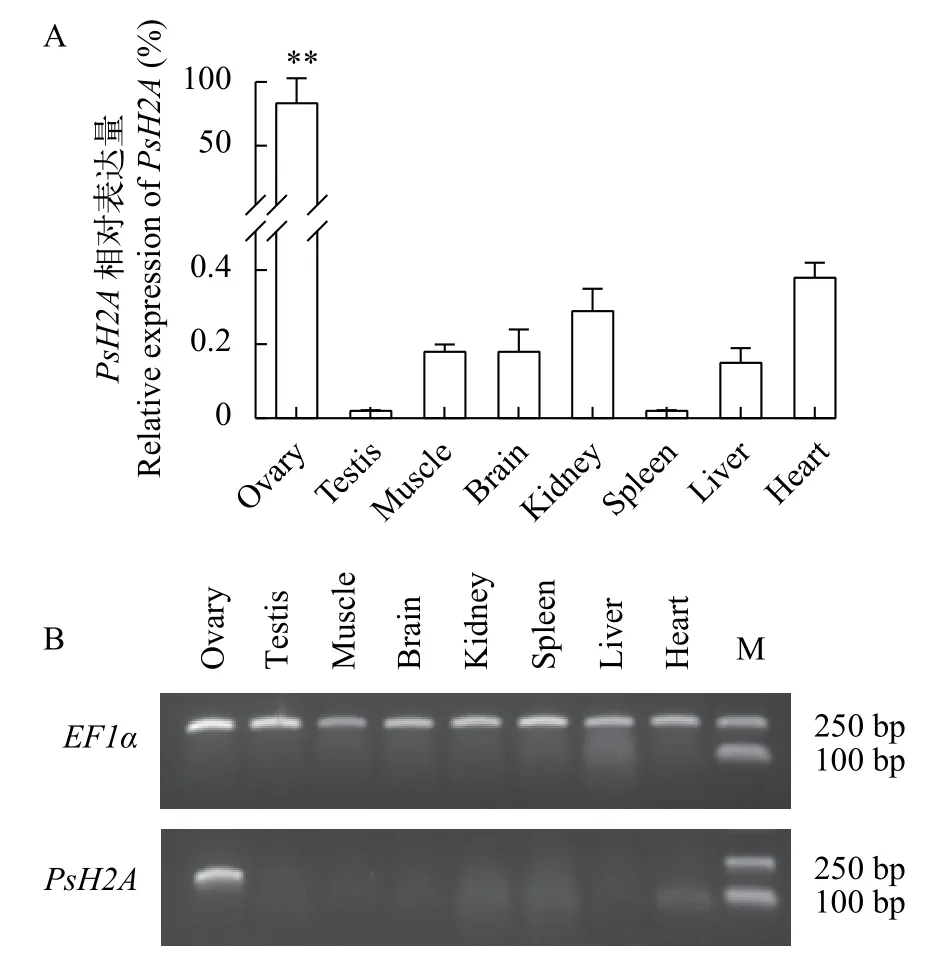
图3 中华鳖PsH2A mRNA在3冬龄成体组织中的特异性表达Fig. 3 Specific expression analysis of PsH2A mRNA in 3-yearold adult tissues
2.3 中华鳖PsH2A mRNA在卵母细胞发生过程中的表达分布
1冬龄中华鳖卵巢发育至初级卵泡期, 初级卵母细胞核位于细胞中央, 部分细胞核由于染色质空泡的出现被挤压到细胞边缘; 2冬龄中华鳖卵巢进入生长期, 卵巢内具有各个时期的卵泡, 少部分卵泡进入成熟期, 卵黄颗粒在卵的周围开始积累; 3冬龄中华鳖卵巢已经进入成熟期, 输卵管附近可见石灰质壳的卵[23,24]。我们选取2冬龄中华鳖卵巢切片,对PsH2A进行细胞定位, 化学原位杂交结果显示:PsH2A转录本通过反义探针显示化学信号(图 4A和4B), 而正义探针检测不到信号(图 4C和4D)。PsH2AmRNA在卵母细胞中特异性表达, 并且在初期卵母细胞发育至第Ⅲ期的时候, 表达信号最强,且均匀地分布在卵母细胞质中。在初级卵母细胞发育至第Ⅴ期的时候, 目的信号减弱, 信号从细胞核周围至细胞质外围逐渐递减。随着发育进程, 卵母细胞逐渐增大, 进入生长期和成熟期, 目的信号逐渐减弱。在生长期(第Ⅶ期)卵母细胞中, 目的信号呈片状分布在细胞核周围区域, 信号强度较第Ⅴ期的卵母细胞更弱, 细胞质外围几乎很难检测目的信号(图 4A)。在成熟期(第Ⅸ期)卵母细胞中, 目的信号在细胞核周围呈斑点状分布, 而在细胞质外围已经检测不到目的信号(图 4B)。PsH2A的这种特殊表达模式, 提示其在中华鳖卵母细胞发育过程中的重要作用。
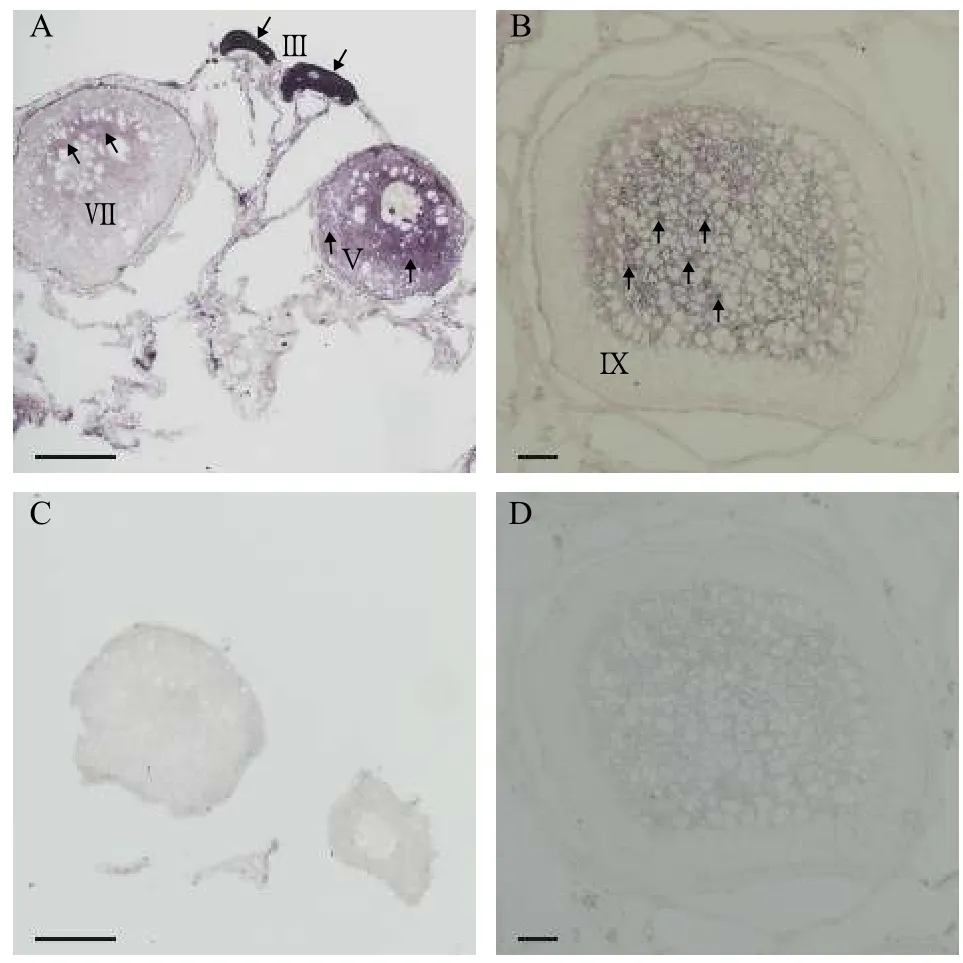
图4 通过化学原位杂交分析中华鳖PsH2A mRNA在卵巢中的表达Fig. 4 The PsH2A mRNA expression in ovary by chemical in situ hybridization
2.4 中华鳖PsH2A mRNA季节表达模式
中华鳖属于季节性繁殖动物, 我国南方养殖的中华鳖一般4—8月为产卵季节, 5—7月为产卵高峰期, 11月开始冬眠, 并将交配后的精子储存在输卵管中, 供来年受精使用[25,26]。用RT-qPCR检测中华鳖卵巢组织中PsH2A不同季节的表达水平变化, 结果显示: 1冬龄个体卵巢PsH2A转录本的相对表达量先上升后下降再上升, 10月的表达量最高; 2冬龄个体PsH2A转录本的相对表达量先上升后下降, 在4月达到峰值; 3冬龄个体PsH2A转录本的相对表达量随着月份整体呈上升趋势。此外, 在相同月份中,随着中华鳖年龄的增长,PsH2A转录本的相对表达量整体呈现下降趋势, 即PsH2A表达量与年龄增长呈负相关(图 5)。
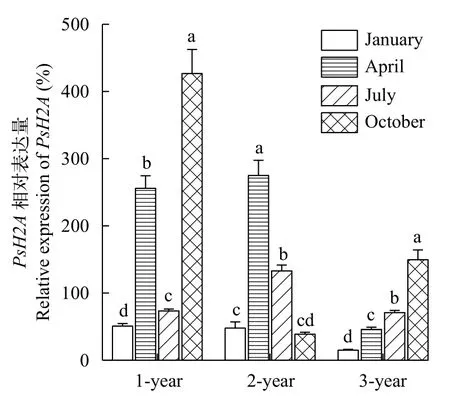
图5 中华鳖PsH2A mRNA在不同季度和不同冬龄卵巢中的相对表达Fig. 5 The Relative expression of P. sinensis PsH2A mRNA in ovary of different seasons and ages
3 讨论
卵母细胞发育过程中的重要事件之一是染色质重塑, 其中就包括组蛋白的修饰和交换[27]。本研究克隆的中华鳖PsH2AcDNA序列全长为575 bp,编码133个氨基酸, 具有H2A超家族特有的结构功能域。在进化上, 与龟类亲缘关系最近。使用RT-qPCR和RT-PCR技术, 对中华鳖PsH2A组织差异性表达情况进行分析, 发现PsH2AmRNA在卵巢组织中高表达, 而精巢和其他组织几乎不表达, 表明PsH2A的表达在中华鳖中具有性别二态性和组织特异性。这与鱼类中发现的表达模式类似, 在异育银鲫(Carassius auratus gibelio)中,h2af1o转录本仅在成体卵巢中被检测到。在蛋白水平上, 也仅在彩鲫(Carassius auratus)和斑马鱼的卵巢中检测到类似的蛋白带[28]。
为了进一步确定PsH2A在中华鳖卵巢组织中的细胞定位, 我们对其转录本在卵巢切片中进行了原位杂交实验。结果发现PsH2AmRNA在卵母细胞中特异性表达, 在初级卵母细胞中表达信号最强,且均匀的分布在卵母细胞质中, 此时卵母细胞发育到第Ⅲ期, 卵母细胞中灯刷染色体明显[21], 卵母细胞进行第一次减数分裂并停留在双线期, 染色体加倍。随着卵母细胞发育成熟, 细胞增大, 目的信号逐渐减弱, 主要分布在核周区域, 此时卵母细胞已经进入生长期(第Ⅶ期)和成熟期(第Ⅸ期), 已观察不到灯刷染色体的存在[21], 完成第一次减数分裂。中华鳖PsH2AmRNA在卵母细胞不同发育阶段中的表达模式似乎与减数分裂中染色体的动态变化相契合。在哺乳动物中, 组蛋白H2A的翻译后修饰和组蛋白H2A变体与染色质的结合参与了卵母细胞染色质的重塑, 对雌性配子的减数分裂和发育能力是至关重要的[29]。PsH2A这种特殊表达模式提示其在中华鳖卵母细胞发育和成熟中可能发挥着重要作用。中华鳖PsH2AmRNA在卵母细胞发育过程中的表达模式与鱼类相似[28], 而与小鼠[11]和牛(Bos indicus)[30]有所不同。在异育银鲫中,H2A变体h2af1o在整个卵子发生期间特异性表达, 在卵原细胞和初级卵母细胞中,h2af1o转录本信号均匀地分布在细胞质中, 从皮质肺泡卵母细胞到成熟卵母细胞, 转录信号主要集中在细胞质外周, 呈斑点式分布, 而在体细胞中检测不到信号。在牛的卵母细胞中,H2A转录本的表达随着卵泡的增大而逐渐增加, 暗示其对于卵母细胞的发育至关重要。Osakabe等[11]认为, 组蛋白H2A与其变异体在C端上存在差异, C端的异质性决定了其功能的不同, 解释了组蛋白H2A及其变异体在不同物种的差异表达的可能原因。
不同年龄中华鳖卵巢组织中PsH2AmRNA的相对表达量, 随着年龄增长, 呈现下降趋势。此外,同一年龄中华鳖在不同季节中, 卵巢组织中PsH2AmRNA的水平也存在显著差异。这可能与中华鳖性成熟过程中卵巢的发育程度有关。1冬龄的中华鳖没有性成熟, 卵巢组织中主要是初级卵母细胞[24],PsH2AmRNA的相对表达量整体呈上升趋势; 2冬龄中华鳖开始性成熟, 卵巢进入生长期, 卵巢内具有各个时期的卵泡, 少部分卵泡进入成熟期[23],PsH2AmRNA在4月和7月高表达, 可能与气温逐渐升高, 卵子发生比较活跃有关; 3冬龄中华鳖完全性成熟, 其卵巢已经进入成熟期, 输卵管附近可见石灰质壳的卵[23],PsH2A的转录水平随月份逐渐升高,可能因为卵巢已进入成熟期, 卵巢一直经历着由卵原细胞到成熟卵子的周期性过程。这也与PsH2AmRNA在卵母细胞发育过程中的原位杂交结果相一致。中华鳖PsH2AmRNA主要在初级卵母细胞中表达, 随着卵母细胞发育成熟, 表达信号逐渐减弱。中华鳖PsH2AmRNA的相对表达与卵子发育的成熟程度呈负相关, 因此可以在生产实践中将其作为评估中华鳖卵巢成熟程度和高繁殖力群体的一个潜在指标。总之, 本研究提示PsH2A在卵母细胞发育成熟过程中起着重要作用, 同时也为今后研究龟鳖类动物生殖细胞发育调控机制拓展了新思路。
