民族药白桐树干枝的化学成分研究
2021-12-23贾历力王志尧
陈 飞, 贾历力, 滕 飞, 王志尧
(1.河南省纳普生物技术有限公司,郑州 450002; 2.河南省科学院化学研究所有限公司,郑州 450002;3.河南省科学院地理研究所,郑州 450052)
白桐树Claoxylon indicum(Reinw.ex Bl.)Hassk.,又名丢了棒、刁了棒、追风棍、咸鱼头大叶大青、赶风债、赶风柴、追风根、美巧怀,为大戟科(Euphorbiac eae)白桐树属(ClaoxylonA.Juss.)植物(见图1),主产于广东、海南、广西、云南等地,味辛微苦,有小毒,性平,归脾、肾经,功效祛风除湿,消肿止痛,《生草药性备要》记载其“祛风湿脚痛……. 敷跌打,消肿痛”,可用于风湿类风湿性关节炎,腰腿痛,跌打肿痛,脚气水肿,还可以用于治疗烧、烫伤,外伤出血,作为一种壮族药物,在民间多用于风湿类风湿骨病的治疗.《中国药典(1977年版)》《广西壮族自治区壮药质量标准》《湖南中药饮片炮制规范(2010 年版)》《甘肃省中药饮片炮制规范(1980 年版)》等法定规范中均有收载白桐树作为临床药物使用,在治疗风湿类风湿性关节炎及其骨病方面白桐树均有使用,如中华跌打丸(中国药典2010年版一部)、中华跌打酒(中华人民共和国卫生部药品标准——中药成方制剂第十九册)、伤筋正骨酊(国家中成药标准汇编——骨伤科分册)、新力正骨喷雾剂(国家中成药标准汇编——骨伤科分册)、驳骨水(中华人民共和国卫生部药品标准——中药成方制剂第十一册)等多种中成药处方及许多壮族药方[1-4]都运用了白桐树这味药.

图1 白桐树Fig.1 Claoxylon indicum(Reinw.ex Bl.)Hassk.
目前关于白桐树的化学研究报道很少,文献调研结果表明,白桐树属植物含酚类、生物碱、二萜、三萜、皂苷等化学成分,其中酚类(主要是木脂素、新木脂素、香豆素)是该属植物主要成分,也是有效成分,且具有抗炎、调节免疫等多种活性[5-9]. 但对白桐树的化学成分及其现代药理研究并不多,主要分离得一些倍半萜新木脂素类、二聚新脂素类、二酮呱嗓生物碱类和三萜类化合物[5,10-11],其药理学研究仅有解热镇痛、抑菌作用、抗肿瘤、抗氧化等生物活性,而有关白桐树在抗风湿、类风湿性关节性的物质基础和作用机制方面研究鲜见报道,这严重制约了常用民族药白桐树的广泛临床应用,亟待加强该方面的研究工作,以利于白桐树资源的充分开发和利用.
壮族是中国人口最多的少数民族,主要聚居于岭南,特别是广西一带,气候炎热,多雨多湿,病多瘴毒时疫,风湿挛痹. 在远古时期便萌发了的壮医壮药,积累了与风湿挛痹疾病做斗争的一些有效方法和药物. 我们前期研究了壮药白桐树对小鼠CIA膝骨关节炎疼痛模型的抗RA活性,发现白桐树总酚类明显可改善CIA模型小鼠的各种体征,并推测白桐树酚类成分通过影响DC细胞,进行调节IL-27和OPN的表达分泌,进而改变滑膜组织IL-27/OPN调控轴,改善Th细胞极化及相关细胞因子偏移平衡而实现抗RA作用的. 为了进一步开发具有民族特色、地域特色的壮族药用植物资源白桐树,本课题组开展了基于共无定型固体分散技术的天然活性成分组增溶增效及其作用机制研究,在分析白桐树抗类风湿性关节炎的酚类成分组时,得到6个化合物,经鉴定分别是:6-姜烯酚(1)、6-姜酚(2)、cleomiscosin A(3)、cleomiscosin C(4)、羽扇豆醇(5)、莨菪亭(6),化合物物1-6均为首次从该属中分离得到,以前未见诸报道,本论文为壮药白桐树抗类风湿的物质基础工作的一部分,为白桐树资源的开发利用提供了参考.
1 仪器与材料
仪器:Bruker DPX 400型核磁共振波谱仪;分析型Agilent 1260高效液相色谱仪;制备型Waters 600E高效液相色谱仪;天津博纳艾杰尔FS-82000s中压快速纯化制备系统.
材料:凝胶Sephadex LH-20(40~70 μm)为瑞典Amersham Pharmacia Biotech AB 公司产品;反相填充材料Lichroprep RP-18 gel(40~65 μm)为德国默克公司产品;MCI填充材料MCI-gel CHP-20为日本三菱公司生产;柱层析用硅胶(100~200 目和200~300 目)为青岛海洋化工厂产品;分析型色谱柱为Zorbax Eclipse XDB-C18(Agilent,4.6 cm×150 cm);制备型色谱柱为Sunfire C18 OBD Prep Column(Waters,10 mm×250 mm);薄层层析硅胶GF254薄层预制板为青岛海洋化工厂产品;显色剂为3%的H2SO4-乙醇溶液(喷洒后110 ℃加热15 min显色).
2 试剂与药材
试剂:乙醇、乙酸乙酯、二氯甲烷、甲醇、丙酮、石油醚等试剂均为分析纯;HPLC 用甲醇、乙腈均为色谱纯.
药材:实验用白桐树枝干购自云南省红河州(原植物见图1),经河南中医药大学陈随清教授鉴定为大戟科植物白桐树Claoxylon indicum(Reinw.ex Bl.)Hassk.的干燥枝干,留样(标本号:DLB-201604)存放于河南省纳普生物技术有限公司.
3 提取与分离
白桐树干燥枝(7.6 kg),切成小段后,粉碎,用8倍量75%乙醇水溶液浸提3次,每次72 h,合并提取液,过滤,减压浓缩至2 L,用同等体积的乙酸乙酯萃取5次,减压回收乙酸乙酯,得浸膏83 g,通过硅胶柱层析,以二氯甲烷-丙酮溶液梯度(10∶1、8∶2、6∶4、1∶1)洗脱,共划分为4个极性部分(Fr10∶1、Fr8∶2、Fr6∶4、Fr1∶1),通过MCI填料中压柱除去Fr8∶2的色素,以甲醇-水溶液梯度洗脱,得到4个馏分(Fr8∶2-1、Fr8∶2-2、Fr8∶2-3、Fr8∶2-4). 通过MCI 填料中压柱除去Fr6∶4 的色素,以甲醇-水溶液梯度洗脱,得到4 个馏分(Fr6∶4-1、Fr6∶4-2、Fr6∶4-3、Fr6∶4-4). 选择Fr6∶4-3通过RP-C18中压柱层析,梯度洗脱,收集了5个馏分(Fr6∶4-3-1~Fr6∶4-3-5). 样品Fr6∶4-3-1-7通过凝胶柱色谱层析,以甲醇洗脱,得到2个馏分(Fr6∶4-3-1-1和Fr6∶4-3-1-2).样品Fr6∶4-3-1-8 通过反相C18 柱层析,以40%~50%甲醇-水洗脱,收集得到10 个馏分(Fr6∶4-3-1-8-1~Fr6∶4-3-1-8-10). 样品Fr6∶4-3-1-9经半制备HPLC纯化得到化合物1. 样品Fr6∶4-3-1-1/2/3经半制备HPLC纯化,得到化合物2和化合物3. 样品Fr6∶4-3-1-8-6经半制备HPLC纯化得到化合物4. 样品Fr8∶2-3-4-4经半制备HPLC纯化得到化合物5. 样品Fr6∶4-3-1-2经半制备HPLC纯化得到化合物6,如图2所示.
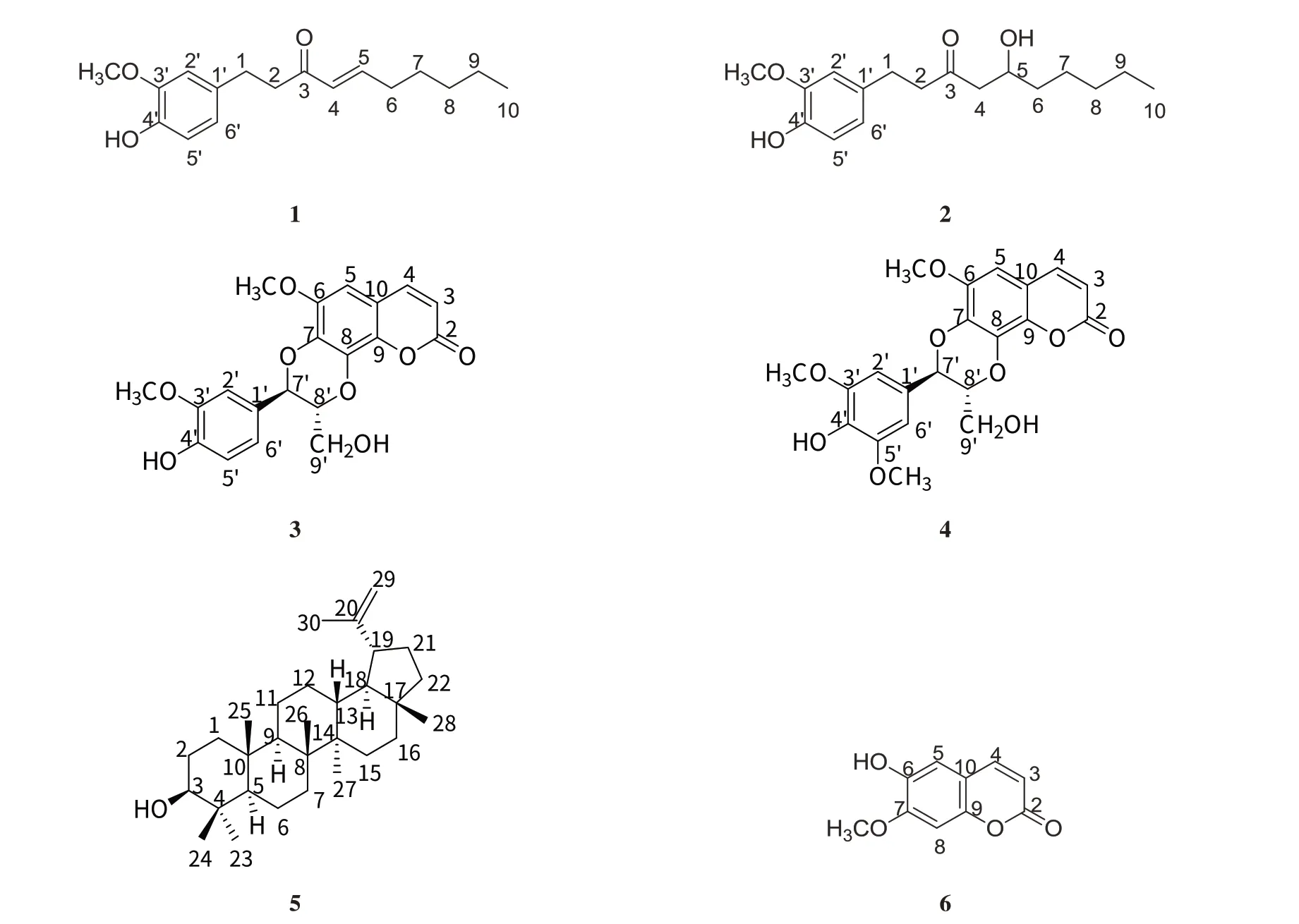
图2 化合物1~6的结构式Fig.2 Structures of compounds 1-6
4 结构鉴定
化合物(1):无色透明油状物,1H NMR(400 MHz,CDCl3)δH:6.82(1H,dt,J=16.0,8.0 Hz,H-4),6.81(1H,d,J=8.0 Hz,H-5′),6.70(1H,d,J=2.0 Hz,H-2′),6.68(1H,dd,J=2.0,8.0 Hz,H-6′),6.09(1H,dt,J=16.0,1.6 Hz,H-5),3.84(3H,s,-OCH3),2.82(2H,m,H-1),2.72(2H,m,H-2),2.53(2H,m,H-4),1.23~1.56(8H,m,H-6,H-7,H-8,H-9),0.89(3H,t,J=6.8 Hz,H-10).13C-及DEPT NMR(100 MHz,CDCl3)δC:29.9(C-1),42.0(C-2),199.9(C-3),130.3(C-4),147.9(C-5),32.5(C-6),23.8(C-7),31.3(C-8),22.4(C-9),14.0(C-10),133.2(C-1′),111.1(C-2′),146.4(C-3′),143.9(C-4′),114.3(C-5′),120.8(C-6′),55.9(-OCH3). 上述数据与文献对照一致[12],并通过DEPT、1H-1H COSY、HSQC、HMBC等1D、2D NMR技术对其所有NMR信号进行详细解析和全归属,故化合物(1)鉴定为6-姜烯酚,结构式见图2(1).
化合物(2):无色透明油状物,1H NMR(400 MHz,CDCl3)δH:6.81(1H,d,J=8.0 Hz,H-5′),6.70(1H,d,J=2.0 Hz,H-2′),6.68(1H,dd,J=2.0,8.0 Hz,H-6′),3.86(3H,s,-OCH3),2.81~2.89(4H,m,H-1,H-2),2.19(2H,dt,J=7.2,1.4 Hz,H-6),1.44(2H,m,H-4),1.23~1.36(4H,m,H-8,H-9),0.89(3H,t,J=6.8 Hz,H-10).13C-NMR(100 MHz,CDCl3)δC:36.4(C-1),31.7(C-2),211.5(C-3),49.3(C-4),67.7(C-5),45.4(C-6),25.1(C-7),29.2(C-8),22.6(C-9),14.0(C-10),132.6(C-1′),111.1(C-2′),146.6(C-3′),144.0(C-4′),114.5(C-5′),120.7(C-6′),55.8(-OCH3). 上述数据与文献对照一致[13],并通过DEPT、1H-1H COSY、HSQC、HMBC 等1D、2D NMR技术对其所有NMR信号进行详细解析和全归属,故化合物(2)鉴定为6-姜酚,结构式见图2(2).
化合物(3):白色粉末,1H NMR(400 MHz,DMSO-d6)δH:9.20(1H,br s,OH-4′),7.97(1H,d,J=9.6 Hz,H-4),6.84(1H,s,H-5),7.03(1H,d,J=1.6 Hz,H-2′),6.88(1H,dd,J=8.4,1.6 Hz,H-6′),6.84(1H,s,H-5),6.83(1H,d,J=8.4 Hz,H-5′),6.34(1H,d,J=9.6 Hz,H-3),5.10(1H,br s,OH-9′),4.99(1H,d,J=8.0 Hz,H-7′),4.25(1H,m,H-8′),3.82(3H,s,OCH3-6),3.81(3H,s,OCH3-3′),3.45(1H,m,H-9′a),3.78(1H,m,H-9′b),0.89(3H,t,J=6.8 Hz,H-10).13C-NMR(100 MHz,DMSO-d6)δC:160.0(C-2),113.2(C-3),144.8(C-4),100.7(C-5),145.2(C-6),137.0(C-7),131.7(C-8),138.0(C-9),111.2(C-10),126.2(C-1′),112.0(C-2′),147.6(C-3′),147.2(C-4′),115.3(C-5′),120.8(C-6′),76.2(C-7′),77.8(C-8′),59.8(C-9′),55.7(OCH3-6),55.8(OCH3-5′). 上述数据与文献对照一致[14],故化合物(3)鉴定为Cleomiscosin C,结构式见图2(3).
化合物(4):白色粉末,1H NMR(400 MHz,DMSO-d6)δH:8.50(1H,s,OH-4′),7.88(1H,d,J=9.6 Hz,H-4),6.74(2H,s,H-2′,6′),6.81(1H,s,H-5),6.28(1H,d,J=9.6 Hz,H-3),5.12(1H,br s,OH-9′),5.00(1H,d,J=8.0 Hz,H-7′),4.25(1H,m,H-8′),3.83(3H,s,OCH3-6),3.82(6H,s,OCH3-3′,5′),3.78(1H,m,H-9′b),3.45(1H,m,H-9′a),3.51(1H,s).13C-NMR(100 MHz,DMSO-d6)δC:160.0(C-2),114.0(C-3),144.8(C-4),100.7(C-5),145.2(C-6,4′),137.0(C-7),131.6(C-8),138.0(C-9),111.2(C-10),125.7(C-1′),105.6(C-2′,6′),147.9(C-3′,5′),136.2(C-4′),76.5(C-7′),77.8(C-8′),59.8(C-9′),55.8(OCH3-6),56.4(OCH3-3′,5′).上述数据与文献对照一致[15],故化合物(4)鉴定为Cleomiscosin A,结构式见图2(4).
化合物(5):白色粉末,1H NMR(400 MHz,CDCl3)δH:4.69(1H,d,J=2.2 Hz,H-29a),4.57(1H,d,J=2.2 Hz,H-29b),3,19(1H,dd,J=5.1,11.3 Hz,H-3),2.38(1H,td,J=11.1,5.8 Hz,H-19),1.68(3H,s,H-30),1.03(3H,s,H-26),0.97(3H,s,H-23),0.94(3H,s,H-27),0.83(3H,s,H-25),0.79(3H,s,H-28),0.76(3H,s,H-24).13C-NMR(100 MHz,CDCl3)δC:38.7(C-1),27.5(C-2),70.9(C-3),38.9(C-4),55.3(C-5),18.3(C-6),34.3(C-7),40.8(C-8),50.4(C-9),37.2(C-10),20.9(C-11),25.1(C-12),38.1(C-13),42.8(C-14),27.4(C-15),35.6(C-16),43.0(C-17),48.3(C-18),48.0(C-19),151.0(C-20),29.8(C-21),40.0(C-22),28.0(C-23),15.4(C-24),16.1(C-25),16.0(C-26),14.6(C-27),18.0(C-28),109.3(C-19),19.3(C-30). 上述数据与文献对照一致[16-18],故化合物(5)鉴定为羽扇豆醇,并通过DEPT、1H-1H COSY、HSQC、HMBC等1D、2D NMR技术对其所有NMR信号进行详细解析和全归属,结构式见图2(5).
化合物(6):白色粉末,1H NMR(400 MHz,CDCl3)δH:3.95(3H,s,7-OCH3),6.27(1H,d,J=9.5 Hz,H-3),6.85(1H,s,H-8),6.92(1H,s,H-5),7.61(1H,d,J=9.5 Hz,H-4).13C-NMR(100 MHz,CDCl3)δC:161.5(C-2),113.4(C-3),143.3(C-4),107.5(C-5),149.7(C-6),150.3(C-7),103.2(C-8),144.0(C-9),111.5(C-10),56.4(6-OCH3),上述数据与文献对照一致[19],故化合物(6)鉴定为Scoploetin,结构式见图2(6).
致谢:郑州大学分析测试中心的朱卫国及康建勋两位老师帮助进行核磁共振仪样品测试,河南省科学院天然产物重点实验室的赵天增研究员对样品核磁共振图谱数据解析方面给予指导,在此特致谢意!
