特发性膜性肾病79例临床病理特征及预后分析
2021-12-23邱明珠付晓宇曾也婷刘庆宏齐兴峰余英豪曲利娟郑智勇
邱明珠,付晓宇,曾也婷,刘庆宏,齐兴峰,李 敏,余英豪,曲利娟,郑智勇
膜性肾病是导致成人肾病综合征(nephrotic syndrome, NS)的常见病理类型[1],根据病因分类:特发性膜性肾病(idiopathic membranous nephropathy, IMN)占70%~80%,其余为继发性膜性肾病(secondary membranous nephropathy, SMN)及不典型膜性肾病(atypical membranous nephropathy, AMN)[2]。IMN的病程具有异质性,当前的研究重点是早期发现预后不良患者并给予积极治疗。近年,关于IMN疾病进展预测指标报道较多[3-8],但缺乏早期阶段具有预测价值的病理指标。本文着重探讨IMN的临床病理学特征,分析其与预后的关系及临床意义。
1 材料与方法
1.1 材料收集2014年6月~2017年9月中国人民解放军联勤保障部队第900医院病理科肾穿刺标本中确诊的79例IMN,对照组SMN 29例(狼疮性肾炎Ⅴ型20例,乙型肝炎病毒相关性肾炎膜性肾病型9例),正常对照组15例(外伤性肾切除标本正常肾组织)。肾小球数目≥8个,均有完整的临床资料,包括患者性别、年龄、发病至肾穿刺时的病程、临床诊断、血压、24 h尿蛋白、镜下血尿、血清白蛋白(sALB)、血清肌酐(sCr)、尿素氮(BUN)、血清学IgG及估计肾小球滤过率(estimated glomerular filtration rate, eGFR)。本实验经解放军联勤保障部队第900医院伦理委员会批准,患者均知情同意。
1.2 方法标本均行HE、PAS、PASM-Masson染色,免疫组化检测指标有PLA2R、IgG、IgG1、IgG2、IgG3、IgG4、IgA、IgM、C3d、C4d、C1q、HBsAg、HBcAg,采用透射电镜(transmission electron microscopy, TEM)观察(HITACHI,型号HT7700);随机抽取5例PLA2R/IgG4的多角形蛋白块(polygonal protein blocks co-expressed by PLA2R/IgG4, PPBCPI)行鼠抗IgG4/兔抗WT1免疫组化双标检测。抗体:PLA2R(SIGMA公司)、IgG(DAKO公司)、IgG2(EPITMICS公司)、IgG3(Abcam公司)、IgG4(福州迈新公司)、IgG1、WT1(北京中杉金桥公司);免疫组化EliVision试剂盒和免疫组化双标试剂盒(KIT-8801/8802),均购自福州迈新公司。
1.3 病理诊断标准按2016年ISN/RPS增生性肾小球肾炎病理分型[9]及Ehrenreich-Churg膜性肾病分期标准诊断。肾小管萎缩/间质纤维化(tubulointerstitial lesions, TIL)按病变范围评分:≤5%为0分、6%~25%为1分、26%~50%为2分、>50%为3分。本组IMN定义为:肾小球基膜上免疫复合物IgG呈细颗粒状沉积伴基膜增厚,排除继发性因素,如系统性红斑狼疮、慢性感染、恶性肿瘤或药物等。PPBCPI阳性定义:出现于肾小球小叶间的多突起蛋白块,并同时表达PLA2R与IgG4;PPBCPI数量≥1个判为阳性。根据是否存在PPBCPI,将IMN分为:PPBCPI阳性的IMN为PPBCPI-IMN组,而PPBCPI阴性者为非PPBCPI-IMN组。
1.4 病理评分标准免疫组化PPBCPI评分:肾小球中PPBCPI阳性的平均数目,无为0分,1~5个为1分,6~10个为2分,>10个为3分。TEM足细胞病变评分:(1)根据预实验观察结果,设定病变明显的四项指标为线粒体肿胀、空泡变性、脂滴及细胞膜破损;无病变为阴性,有病变为阳性。(2)自噬溶酶体计数[10]:按每个病例5~10个足细胞自噬溶酶体的平均数目计数。
1.5 疗效及随访本组临床治疗方案:糖皮质激素+免疫抑制剂+对症治疗,根据2012年改善全球肾脏病预后组织(KDIGO)指南进行判断。(1)完全缓解:24 h尿蛋白<0.3 g,sALB>35 g/L及sCr正常(<133.0 μmol/L)。(2)部分缓解:24 h尿蛋白0.3~3.5 g,sCr水平稳定(波动范围<15%)。(3)无效:治疗后未达上述指标。(4)复发:完全或部分缓解至少1个月后,24 h尿蛋白>3.5 g。肾活检后按月记录随访时间,通过门诊、电话等方式进行追踪随访,以eGFR降低>30%或进入终末期肾脏疾病(end-stage renal disease, ESRD)或患者死亡为终点,随访截至2020年9月5日。

2 结果
2.1 IMN与SMN免疫病理对比79例IMN免疫病理表现为肾小球毛细血管襻脏层上皮下免疫复合物呈细颗粒沉积伴基膜增厚,而29例SMN还伴系膜区免疫沉积及系膜细胞、内皮细胞增生等。IMN组血管襻上PLA2R、IgG4的阳性率均高于SMN组(93.67%vs22.41%、69.62%vs27.59%),而血管襻IgG1、系膜区IgA及C1q阳性率均低于SMN组(59.49%vs86.21%、16.46%vs48.28%、45.57%vs92.31%),差异均有统计学意义(P<0.05)。两组间IgG、IgG2、IgG3、IgM、C3d、C4d的阳性率,差异均无统计学意义(P>0.05)。正常对照组除了肾小球系膜区有少量IgM和C3d沉积外,无IgG、IgA、C4d、C1q等沉积,无血管襻阳性。
2.2 PPBCPI免疫病理特点与足细胞的关系PASM-Masson染显示,55例IMN(69.62%)肾组织除了免疫复合物沉积于增厚的肾小球基膜外,肾小球小叶之间可见少量红染的PPBCPI(图1)。PLA2R标记PPBCPI呈强阳性,肾小球毛细血管襻弱阳性(图2)。IgG亚型标记肾小球小叶间的PPBCPI阳性,血管襻为弱阳性,如IgG1(图3)及IgG4(图4),而IgM、IgA、C3d、C4d及C1q标记该物质均阴性。SMN组及正常对照组无PPBCPI特征。79例IMN分为55例PPBCPI-IMN(69.62%)和24例非PPBCPI-IMN(30.38%) 。55例PPBCPI-IMN组中的PPBCPI不同程度表达IgG及亚型,IgG4的阳性率与阳性强度最高(表1)。

①②③④⑤⑥⑦⑧⑨⑩

表1 PPBCPI-IMN中PPBCPI免疫表型
PPBCPI-IMN免疫组化双染(IgG4/WT-1)显示,疏松的PPBCPI(IgG4阳性红色)位于肾小球小叶间,不与足细胞(WT-1核阳性)直接相连;部分足细胞胞质呈IgG4弱阳性(图5、6)。
2.3 TEM观察足细胞病变TEM检查显示,79例IMN中53例标本可见肾小球(3~6个),其中34例PPBCPI-IMN,19例非PPBCPI-IMN。两组TEM下均可见足突融合及微绒毛变性;PPBCPI-IMN的足细胞线粒体肿胀(图7)、空泡变性、脂滴及细胞膜破损(图8)的病变阳性率明显高于非PPBCPI-IMN(图9),差异有统计学意义(P<0.05,表2)。两组间自噬溶酶体数量的比较,差异无统计学意义(P>0.05,表2)。正常对照组15例,均无足突融合、线粒体肿胀、空泡变性、脂滴、细胞膜破损等病变(图10)。
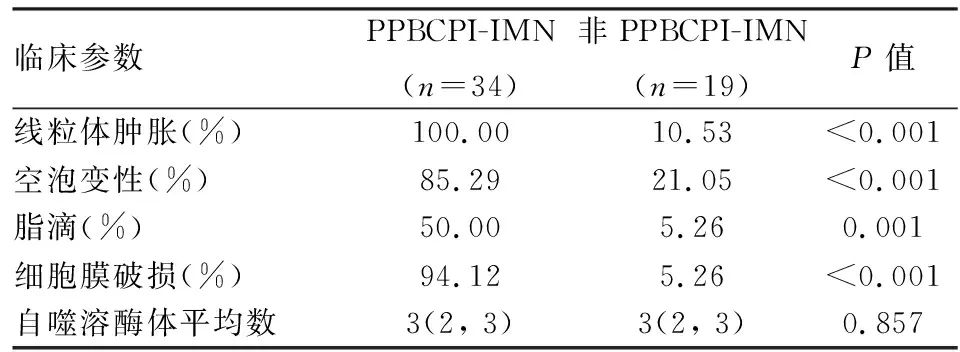
表2 PPBCPI-IMN与非PPBCPI-IMN的足细胞病变比较
2.4 IMN临床资料的基线特征79例IMN患者,男性56例(70.89%),女性23例(29.11%),平均年龄52岁;膜性早期组53例,中晚期组26例,TIL平均0.52分。PPBCPI-IMN组Ⅰ期39例(70.91%),非PPBCPI-IMN组Ⅰ期14例(58.33%)。PPBCPI-IMN与非PPBCPI-IMN 组间主要临床病理资料统计分析显示,PPBCPI-IMN组NS的发生率高于非PPBCPI-IMN(90.91%vs70.83%),差异有统计学意义(P<0.05,表3);而其他指标无统计学差异。

表3 IMN临床资料的基线特征
2.5 生存分析79例IMN中有2例失访,其余77例随访12~75个月,截至2020年9月5日,25例IMN出现肾功能不全且eGFR降低>30%,其中2例进入ESRD,4例肺栓塞死亡。IMN患者3、5年肾脏无瘤生存率(即不出现eGFR降低>30%或ESRD或死亡)分别为90.91%与72.73%(图11)。比较PPBCPI-IMN与非PPBCPI-IMN两组的疗效,前者的治疗缓解率低于后者(55.8%vs82.6%),差异有统计学意义(P=0.036)。肾脏生存分析显示,PPBCPI-IMN疾病进展的风险高于非PPBCPI-IMN(Log-rank:P=0.002,图12)。79例IMN肺栓塞的发生率为5.06%;PPBCPI-IMN组肺栓塞的发生率为7.27%(4例),非PPBCPI-IMN组肺栓塞的发生率为0,差异无统计学意义(P=0.308)。
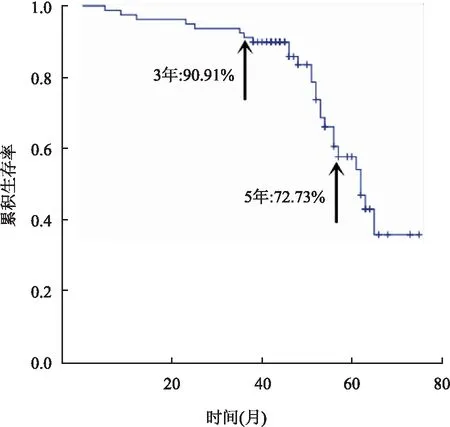
图11 IMN肾脏无瘤生存率(Kaplan-Meier曲线)

图12 PPBCPI-IMN与非PPBCPI-IMN的生存分析(Kaplan-Meier曲线)
2.6 IMN多因素分析多因素Cox比例风险回归预后分析显示,本组中独立影响IMN疾病进展的变量:病理分期(HR=5.257,P=0.043)、eGFR(HR=0.855,P=0.002)、PPBCPI(HR=1.516,P=0.009,表4)。PPBCPI预测肾脏进展的ROC曲线面积为0.675(P=0.021),敏感度为95.0%,特异性为40.0%(P=0.021,图13)。

表4 IMN肾脏的多因素Cox风险分析
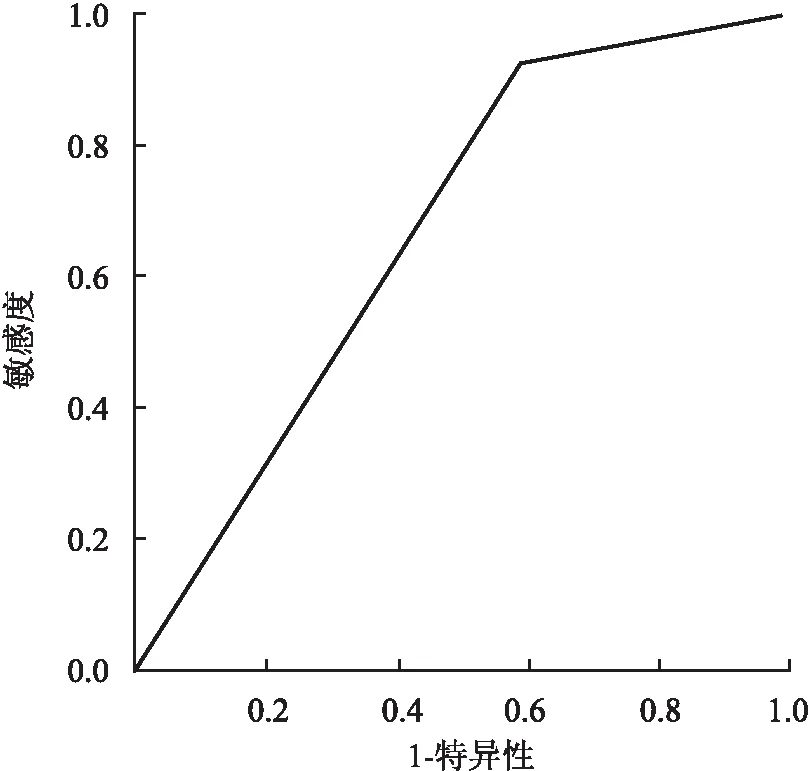
图13 PPBCPI预测肾脏进展的ROC曲线
3 讨论
近年,足细胞自身抗原PLA2R、1型血小板反应蛋白7A域(thrombospondin type-1 domain-containing7A, THSD7A)的发现与深入分析,对确诊IMN起关键作用[11-12]。多数研究显示,IMN中PLA2R占70%以上,而THSD7A占3%~5%,还有其他一些新抗原[13]。PLA2R联合IgG4高特异性(96.4%)识别IMN,PLA2R与IgG4在肾小球毛细血管襻上共表达是IMN的免疫病理诊断依据[14-17]。IMN的病程具有异质性,约1/3的患者可自发缓解,约1/3的患者10年后可进展为ESRD。单克隆抗体(如利妥昔单抗)被推荐用于IMN的治疗,特别对于易发展为ESRD的高危患者,美国肾脏病学会推荐进行一线治疗[18],对临床医师尽早发现高危患者提出了更高的要求。
本实验发现IMN除了肾小球毛细血管襻上PLA2R与IgG4共表达外,69.62%的病例于肾小球小叶间还存在PPBCPI免疫病理特征,查阅文献未见类似报道,本文为首次报道。本实验免疫组化双染结果显示,PPBCPI-IMN的足细胞胞质和PPBCPI均呈IgG4阳性,其中足细胞胞质表达较弱,PPBCPI表达较强;推测PPBCPI物质可能是IMN自身抗体攻击损伤足细胞胞体及足突后,退变、脱落、融合形成的蛋白团块。PPBCPI免疫表型显示PLA2R、IgG及其亚型不同程度阳性,显示其共表达的特点;而IgA、IgM、C3d、C4d和C1q均阴性,提示无激活补体系统。Meyer-Schwesinger等[19]在IMN转基因小鼠中发现足细胞损伤;本实验TEM显示PPBCPI-IMN足细胞的线粒体肿胀、空泡变性、脂滴及细胞膜破损阳性率高于非PPBCPI-IMN,差异具有统计学意义。PPBCPI-IMN与非PPBCPI-IMN之间存在足细胞超微结构病变的差异,可能是特异性抗体与足细胞结合后引起的细胞膜和细胞器损害不同所致,而其机制有待进一步分析。
临床病理资料分析显示,PPBCPI-IMN组的NS出现率高于非PPBCPI-IMN组(90.91%vs70.83%),差异有统计学意义。NS是IMN主要的临床表现,也是导致肾功能损害的重要因素。因此,出现NS往往提示其预后不良。对于IMN具有NS且易发展为ESRD的高危患者,美国肾脏病学会推荐利妥昔单抗作为一线治疗,但我国此应用尚处于起步阶段,本组未采用该治疗方案,具有PPBCPI特征的IMN患者对其治疗反应有待进一步分析。此外,IMN组肺栓塞的发生率为5.06%,与文献报道相近[20]。
本组77例IMN随访12~75个月,其3、5年肾脏无进展生存率分别为90.91%、72.73%,与文献报道相近。PPBCPI-IMN组的治疗缓解率低于非PPBCPI-IMN组(55.8%vs82.6%),差异有统计学意义。两组肾脏无进展生存率比较,PPBCPI-IMN疾病进展的风险高于非PPBCPI-IMN(Log-rank:P=0.002)。一些研究认为,持续性高蛋白尿、血清PLA2R抗体滴度高、eGFR降低、病理分期晚以及严重的TIL等是IMN的独立危险因子[5-10],但早期阶段具有预测价值的病理指标缺乏。本实验多因素分析显示PPBCPI为IMN疾病进展的独立影响变量,其ROC曲线下面积为0.675,敏感性为95.0%,特异性为40.0%。PPBCPI-IMN组中以早期病例为主(70.91%),即出现PPBCPI的IMN病例大多数为疾病早期阶段,提示PPBCPI可作为IMN早期阶段的独立预后指标。本实验ROC曲线特异性较低,存在一定的局限性,有待大样本数据或多中心研究进一步证实。
综上所述,IMN部分患者肾小球小叶间存在PPBCPI免疫病理特征,大多数为早期病例,多因素分析显示其为IMN疾病进展的独立影响变量。因此,PPBCPI可作为IMN疾病早期阶段的独立预后指标。具有PPBCPI病理特征的IMN患者其肾脏疾病进展风险较高,可采取积极的治疗方案或者单克隆抗体治疗。
