红曲发酵藜麦种子液培养及固态发酵条件优化
2021-12-22贺圣凌林雨蝶邓茹月周罗娜赵兴丽罗林丽周玉锋
贺圣凌,林雨蝶,邓茹月,周罗娜,赵兴丽,罗林丽,周玉锋*
(1.贵州省农业科学院生物技术研究所,贵阳 550006;2.贵州省农业生物技术重点实验室,贵阳 550006;3.大连海洋大学 食品科学与工程学院,辽宁 大连 116023;4.贵州省农业科学院水稻研究所,贵阳 550006)
藜麦(Chenopodiumquinoa)为苋科的藜亚科藜属(ChenopodiumL.)植物,是一种具有较高营养价值的安第斯原始假性谷物,与传统谷物相比具有更高的营养价值,在安第斯山地区已有超过7000年的种植历史,是古印加民族的主要粮食作物之一,藜麦蛋白质含量较高,优于中国食物成分表公布的其他谷物,藜麦中不仅含有丰富的蛋白质、脂肪、淀粉、维生素等常规营养成分,而且含有多酚、黄酮、皂苷等生理活性物质[1-6],2020年,陈志婧等[7]对藜麦的营养成分进行对比分析,证实藜麦含有丰富的矿质元素,其K、Ca、Cu、Mg的含量都高于小麦、水稻和小米。2019年,翁正杭等[8]对金针菇在藜麦固态培养基上的发酵条件进行了探讨,表明藜麦可以为金针菇提供充足的碳源及氮源。目前,藜麦的食用方式主要以粥类为主,2020年,梁霞等[9]研究了藜麦八宝粥的制备工艺,乐梨庆等[10]研发了藜麦奇亚籽冲调粉,和丽媛[11]研发了红薯藜麦饼干,闫志鹏[12]研制了藜麦姜汁酸奶。除了在食用方面,藜麦也开始应用于化妆品,2020年,丁瑞瑞等[13]研究了藜麦淀粉微球的制备。红曲菌作为药食两用丝状真菌,在中国已有1000多年的历史。使用红曲菌能产生多种次级代谢产物,例如红曲色素、莫纳可林K (Monacolin K,MK)、γ-氨基丁酸(GABA)等,其中部分代谢产物具有降血压、降血脂、抗菌、抗氧化和抗癌等重要的生理活性[14-15]。红曲菌不仅作为米制品发酵,也常用于酿酒工艺中,2020年,李富强等[16]证实了红曲菌应用于酿酒可以明显提升原酒质量。2016年,马帅等[17]利用红曲发酵豆浆成功生产Monacolin K。红曲还常用于中药研究,2016年,杨静云[18]利用山楂、泽泻、决明子与红曲霉混合发酵制备了降脂中药。目前,藜麦发酵食品极少,而红曲菌的功效广泛,若能选择红曲菌发酵藜麦,将益生菌与高营养食物相结合,通过生物转化,为藜麦开发功能性发酵食品提供了一定的基础。
1 材料与方法
1.1 材料与试剂
原料:红藜麦:产自山西忻州,由繁峙县玥晨贸易有限公司提供。
菌种:紫红曲霉3.4629(Monascuspurpureus),购自中国普通微生物菌种保藏管理中心。
试剂:蛋白胨(BS)、蔗糖(AR)、硫酸镁(AR)、PDA培养基(BR)、营养琼脂(BR)、无水乙醇(AR)。
1.2 仪器与设备
Epoch2酶标仪 美国BioTek公司;GI100DP型立式压力蒸汽灭菌锅 致微(厦门)仪器有限公司;BSD-YX3400摇床、BSP-250生化培养箱 上海博讯医疗生物仪器股份有限公司;SJ-CJ-2FD超净工作台 苏州苏洁净化设备有限公司。
1.3 方法
1.3.1 红曲菌孢子悬浮液的制备
取活化好的红曲菌斜面试管,在无菌操作台加上入无菌水,用接种环轻轻刮取琼脂表面,使其孢子被顺利刮下,将孢子悬浮液置于带玻璃珠的无菌三角瓶中,充分振荡,用无菌滤纸过滤,再以血球计数板计数,确保孢子浓度达106个/mL。
1.3.2 红曲发酵藜麦种子液培养条件的优化
以藜麦添加量为100 g/L、蔗糖(碳源)添加量为30 g/L、蛋白胨(氮源)添加量为30 g/L、硫酸镁(无机盐)添加量为1 g/L配制藜麦种子液,分别以接种量、初始pH值、装液量为因素进行单因素试验。
1.3.2.1 接种量对种子液培养的影响
将配制好的种子液50 mL置于250 mL三角瓶中,种子液的初始pH值为自然值,分别按5%、10%、15%、20%、25%的接种量接入红曲菌孢子悬浮液,温度为30 ℃,于转速为180 r/min的摇床中培养5 d,测定种子液的菌体干重。
1.3.2.2 初始pH值对种子液培养的影响
将配制好的藜麦种子液50 mL置于250 mL三角瓶中,按10%的接种量接入红曲菌孢子悬浮液,分别调节初始pH值为3,4,5,6,7,温度为30 ℃,于转速为180 r/min的摇床中培养5 d,测定种子液的菌体干重。
1.3.2.3 装液量对种子液培养的影响
分别量取配制好的藜麦种子液30,40,50,60,70,80 mL于250 mL三角瓶中,按10%的接种量接入红曲菌孢子悬浮液,种子液初始pH值为自然值,温度为30 ℃,于转速为180 r/min的摇床中培养5 d,测定种子液的菌体干重。
正交试验设计:根据单因素试验结果,设计以接种量、初始pH值和装液量为因素,以菌体干重为评定指标的正交试验,综合分析单因素试验,设计三因素四水平正交试验(见表1),对正交试验进行极差分析及方差分析,筛选出最优种子液培养条件。

表1 种子液正交试验因素水平表Table 1 The factors and levels of orthogonal experiment of seed liquid
1.3.3 藜麦-红曲固态发酵条件的优化
根据1.3.2试验结论培养最优藜麦-红曲种子液,分别以蒸料时间、接种量、料液比、发酵时间、发酵温度为因素进行单因素试验。
1.3.3.1 蒸料时间对藜麦-红曲固态发酵的影响
精确称取20 g藜麦于250 mL三角瓶中,以料液比为1∶1加入蒸馏水,分别于105 ℃蒸煮20,30,40,50,60 min,按10%的接种量接入藜麦-红曲种子液,用无菌玻璃棒搅拌均匀,于31 ℃培养箱中培养7 d,利用酶标仪测定其色价。
1.3.3.2 接种量对藜麦-红曲固态发酵的影响
精确称取20 g藜麦于250 mL三角瓶中,以料液比为1∶1加入蒸馏水,于105 ℃蒸煮30 min,分别按5%、10%、15%、20%、25%的接种量接入藜麦-红曲种子液,用无菌玻璃棒搅拌均匀,于31 ℃培养箱中培养7 d,利用酶标仪测定其色价。
1.3.3.3 料液比对藜麦-红曲固态发酵的影响
精确称取20 g藜麦于250 mL三角瓶中,分别以料液比为1∶0.6、1∶0.8、1∶1、1∶1.2、1∶1.4加入蒸馏水,于105 ℃蒸煮30 min,按10%的接种量接入藜麦-红曲种子液,无菌玻璃棒搅拌均匀,于31 ℃培养箱中培养7 d,利用酶标仪测定其色价。
1.3.3.4 发酵时间对藜麦-红曲固态发酵的影响
精确称取20 g藜麦于250 mL三角瓶中,以料液比为1∶1加入蒸馏水,于105 ℃蒸煮30 min,按10%的接种量接入藜麦-红曲种子液,用无菌玻璃棒搅拌均匀,分别于31 ℃培养箱中培养6,7,8,9,10 d,利用酶标仪测定其色价。
1.3.3.5 发酵温度对藜麦-红曲固态发酵的影响
精确称取20 g藜麦于250 mL三角瓶中,以料液比为1∶1加入蒸馏水,于105 ℃蒸煮30 min,按10%的接种量接入藜麦-红曲种子液,用无菌玻璃棒搅拌均匀,分别于25,28,31,34,37 ℃培养箱中培养7 d,利用酶标仪测定其色价。
正交试验设计:根据单因素试验结果,设计以蒸料时间、接种量、料液比、发酵时间、发酵温度为因素,以色价为评定指标的正交试验,综合分析单因素试验,设计五因素五水平正交试验(见表2),对正交试验进行极差分析及方差分析,筛选出最优藜麦-红曲固态发酵培养条件。
尽管自我表露大部分是建立在亲密关系的基础上[23],但有关研究表明,网络交互以及其他以互联网为基础的沟通都可以促使用户进行较高程度的自我表露。例如,Rheingold (2001) 的研究表明,许多人会通过网络空间的沟通建立新的有意义的联系,相对于传统的面对面聊天而言,借助“媒介”进行沟通会使得人们很自然地向他人呈现出自己更为私密的信息。

表2 固态发酵正交试验因素水平表Table 2 The factors and levels of orthogonal experiment of solid-state fermentation
1.3.4 数据处理
采用SPSS 22.0数据分析软件对正交试验结果进行显著性分析,使用Excel 2010软件对数据进行统计分析并绘制图表。
2 结果与分析
2.1 红曲发酵藜麦种子液培养条件优化
2.1.1 单因素试验结果与分析
由图1可知,不同红曲菌孢子悬浮液的接种量对种子液培养中菌体干重的影响显著,当接种量为5%时,菌体干重为0.023 g/mL,当接种量为10%时,菌体干重提升至0.049 g/mL,但当菌体接种量提升至15%时,菌体干重反而降低至0.042 g/mL,随着菌体接种量继续提升,菌体干重继续略微降低,但当接种量继续提升至25%时,菌体干重大幅度降低至0.034 g/mL。这可能是由于菌体接种量过大,培养体系内养分有限,经过较短时间的生长繁殖后,菌群迅速进入衰亡期,因而导致接种量过高、菌体干重过低的情况发生。

图1 接种量对种子液培养的影响Fig.1 Effect of inoculation amount on seed liquid culture

续 表
由图2可知,不同的初始pH值对种子液培养情况的影响也较为显著,当初始pH值为3时,菌体干重为0.043 g/mL,当初始pH值为4时,菌体干重略微上升至0.045 g/mL,当初始pH值为5时,菌体干重显著上升至0.050 g/mL,而当初始pH值为6和7时,菌体干重则显著下降,因为红曲菌是嗜酸喜醇的好氧菌,通常最适pH值在4~5之间,而在最适范围内,细胞酶活性较高,菌体生长速率也较高,故当pH值酸性降低时,红曲菌的繁殖能力降低。
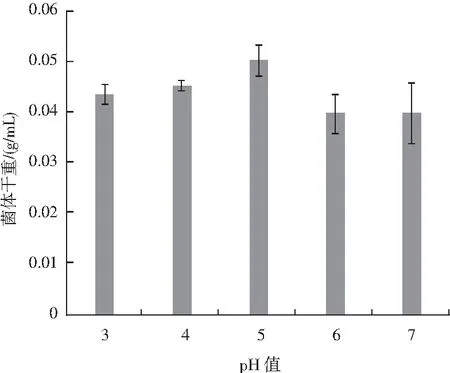
图2 初始pH值对种子液培养的影响Fig.2 Effect of initial pH value on seed liquid culture
由图3可知,装液量对种子液培养的影响也较显著,装液量由30 mL增加至40 mL时,菌体干重由0.045 g/mL降至0.040 g/mL,但当装液量为50 mL时,菌体干重最高,达0.048 g/mL,之后随着装液量的增加,菌体干重降低,因为当装液量较低时,为菌体提供的培养体系养分有限,但当装液量过高时,溶氧量降低,对于好氧红曲菌而言,会影响菌体代谢,导致菌体的繁殖能力降低。
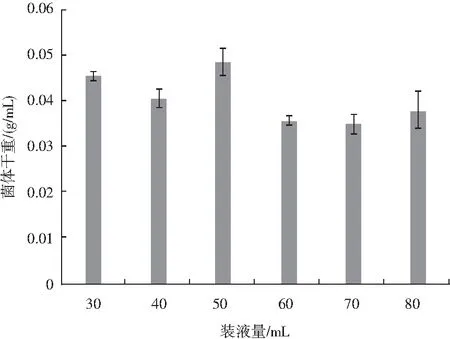
图3 装液量对种子液培养的影响Fig.3 Effect of liquid amount on seed liquid culture
在接种量、初始pH值及装液量等单因素试验的基础上,设定了以菌体干重为评定指标的三因素四水平正交试验,正交试验结果及极差分析见表3。

表3 种子液正交试验表Table 3 The orthogonal test of seed liquid
由表3可知,主次顺序为B>A>C,说明初始pH值对种子液菌体生长的影响最大,其次是接种量,再次是装液量,试验因素的最优组合为A3B3C1,即种子液的最佳培养条件为接种量20%,初始pH值5,装液量30 mL/250 mL。用最优组合方案进行验证试验,测得菌体干重为57.13 g/L,优于各正交试验。
根据表3中正交试验结果,采用SPSS 22.0软件进行方差分析,结果见表4。
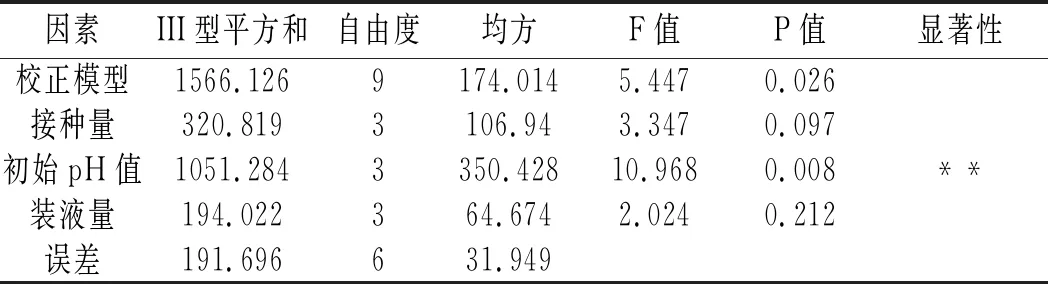
表4 种子液正交试验方差分析表 Table 4 ANOVA of orthogonal test of seed liquid
由表4方差分析可知,初始pH值对种子液扩大培养的影响极显著(P<0.01),接种量和装液量的影响不显著(P>0.05),但3个因素影响程度的大小排序与表3中极差分析结果一致,均是B>A>C。
2.2 藜麦-红曲固态发酵条件优化结果与分析
2.2.1 单因素试验结果与分析
由图4可知,接种量对固态发酵后色价的影响显著,接种量分别为5%和20%时,其色价较高,且在5%~25%之间,色价波动较大,故选择5%、10%、15%、20%、25%为因素水平。

图4 接种量对固态发酵的影响Fig.4 Effect of inoculation amount on solid-state fermentation
由图5可知,料液比对固态发酵色价的影响也较为显著,当料液比为1∶1.2时,色价最低(1.112 U/g),当料液比为1∶0.8时,色价最高,为16.617 U/g,二者之间的差距极大,随着料液比的降低,发酵物的色价波动较大,故选择1∶0.6~1∶1.4为因素水平。

图5 料液比对固态发酵的影响Fig.5 Effect of solid-liquid ratio on solid-state fermentation
由图6可知,随着发酵时间的延长,色价出现不同程度的上升,直到第10天,色价略微降低。

图6 发酵时间对固态发酵的影响Fig.6 Effect of fermentation time on solid-state fermentation
由图7可知,发酵温度在31 ℃时,色价极显著高于其他温度。

图7 发酵温度对固态发酵的影响Fig.7 Effect of fermentation temperature on solid-state fermentation
由图8可知,蒸料时间在40 min时色价最高,蒸料时间在50 min时色价最低,当蒸料时间继续增加至60 min时,色价又出现显著提升的趋势。通过单因素试验,为后续的正交试验方案设计提供了因素及水平。
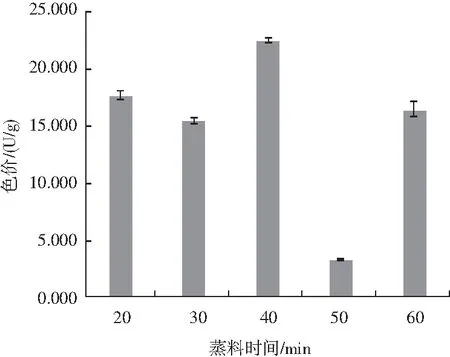
图8 蒸料时间对固态发酵的影响Fig.8 Effect of steaming time on solid-state fermentation
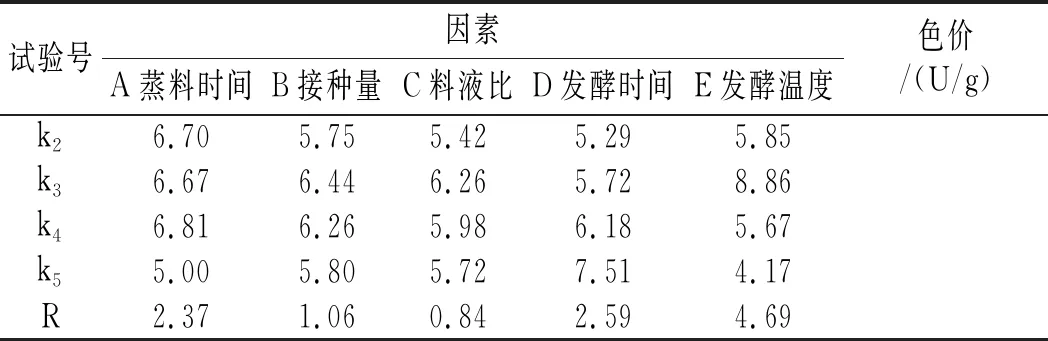
续 表
2.2.2 正交试验结果及分析
在蒸料时间、接种量、料液比、发酵时间、发酵温度等单因素试验的基础上,设定了以色价为评定指标的五因素五水平正交试验(见表2),其正交试验结果及极差分析见表5。
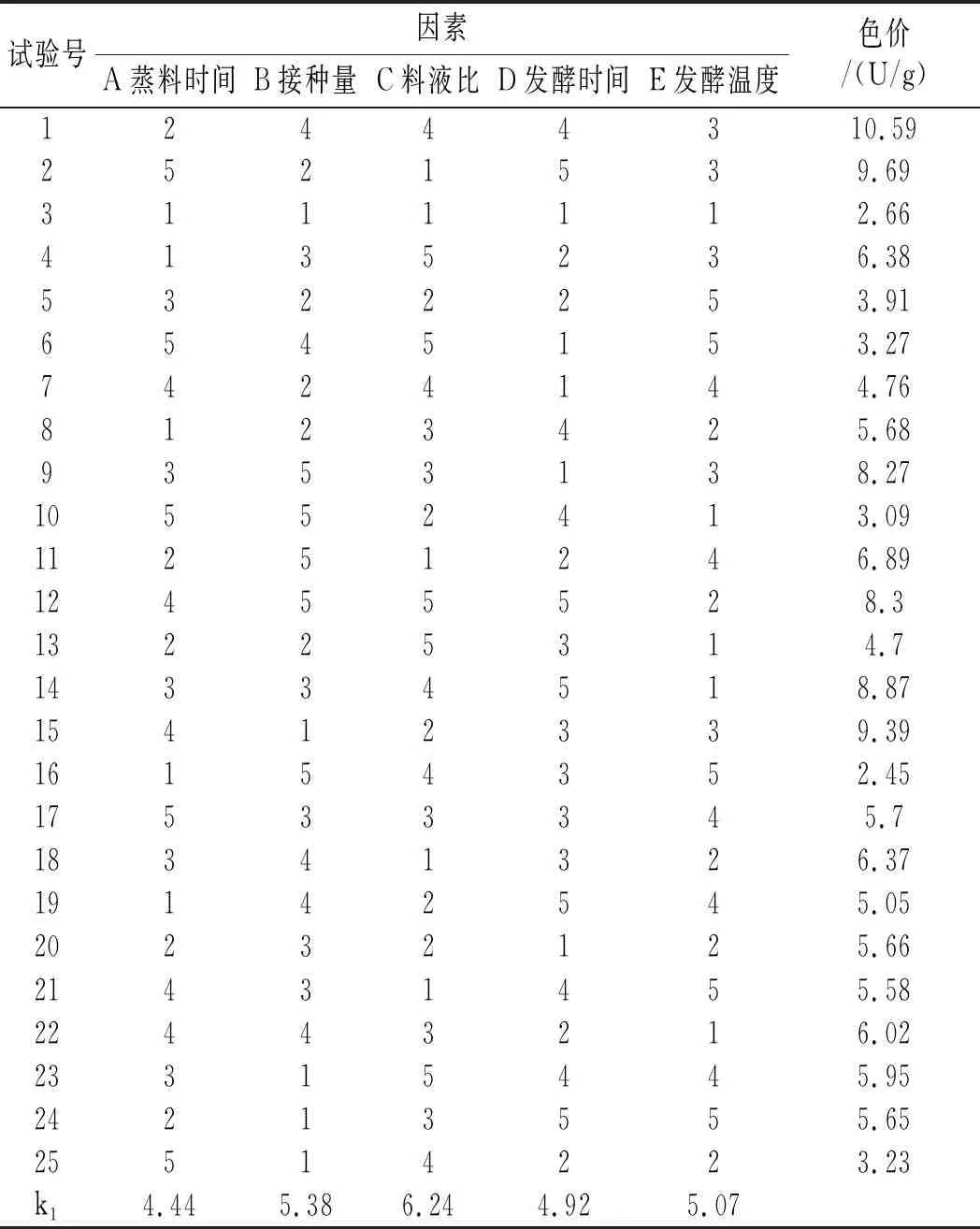
表5 固态发酵正交试验表Table 5 The orthogonal test of solid-state fermentation
由表5中的正交试验结果及极差分析可知,主次顺序为E>D>A>B>C,说明发酵温度对固体发酵中菌体生长的影响最大,随后依次是发酵时间、蒸料时间、接种量和料液比,根据k值和R值可确定试验因素的最优组合为A4B3C3D5E3,即藜麦-红曲固态发酵最佳培养条件为蒸料时间为50 min,接种量为15%,料液比为1∶1,发酵时间为10 d,发酵温度为31 ℃。
根据表5的正交试验结果,采用SPSS 20软件进行方差分析,结果见表6。

表6 固态发酵正交试验方差分析表Table 6 ANOVA of orthogonal test of solid-state fermentation
由表6方差分析可知,发酵温度对固态发酵的影响表现为显著(P<0.05),其余4个因素对固态发酵影响不显著(P>0.05)。5个因素对藜麦-红曲固态发酵影响程度的大小排序为E>A>D>B>C,该排列顺序与极差分析大致一致,但存在不同,在极差分析中发酵时间的影响程度大于蒸料时间,但在方差分析中蒸料时间的影响程度大于发酵时间,但一般认为方差分析结果比极差分析更精准,极差分析主观性较强,极差只指明了测定值的最大离散范围,而未能利用全部测量值的信息,故此试验以方差分析结果为准。
3 结论
藜麦被FAO认定为唯一一种单作物即可满足人类所需的全部营养的粮食[19-20],毋庸置疑,其营养价值极高,但目前藜麦的食用方法极少。红曲菌具有一定的抗“三高”功效,且其次级代谢产物也具有抗氧化活性。本文首次提出将益生菌红曲菌与藜麦相结合,通过生物转化进一步提高藜麦的食用价值及营养价值,探究红曲发酵藜麦种子液的培养条件及固态发酵条件,当接种量为30%,初始pH值为5、装液量为30 mL/250 mL时种子液菌体生长情况最优,菌体重量达57.13 g/L,当蒸料时间为50 min,接种量为15%,料液比为1∶1,发酵时间10 d,发酵温度为31 ℃时,红曲-藜麦固态发酵菌体色价最优,达11.12 U/g。通过该试验方案,可为后期开发藜麦发酵食品提供基础,进一步提高藜麦的可食用性。
