纳米二氧化钛增强五价砷对丰年虾的慢性毒性作用
2021-12-21杨舒萍董四君颜昌宙
杨舒萍, 杨 帆, 董四君, 颜昌宙*
1.中国科学院城市环境研究所, 城市环境与健康重点实验室, 福建 厦门 361021 2.中国科学院大学, 北京 100049 3.河北大学生命科学学院, 河北 保定 071002
砷(arsenic,As)作为一种丰富的自然元素和重要的环境污染物,对水生生物及人类健康均具有严重危害[1-2]. 有关As对水生生物的毒性效应,国内外均有大量报道[3-4]. 在真实的水环境中,As的生物可利用性和毒理效应可能会受到环境中广泛存在的纳米颗粒物的影响. 因此,在研究As对水生生物毒性效应时,有必要考虑人工纳米颗粒的影响及其潜在的复合毒性效应,这对深入了解As的环境行为及生态毒理效应具有重要意义.
纳米二氧化钛(titanium dioxide nanoparticles,nano-TiO2)是目前应用最广泛的纳米材料之一[5-6]. 近年来已有关于nano-TiO2对As载体效应的研究,即As能以As-nano-TiO2复合物的形式进入生物体内,导致其生物利用性和毒性增强[7-8]. 然而,也有研究[9-10]发现,由于nano-TiO2对As的吸附作用导致暴露介质或生物体内As有效浓度降低而引起As毒性减弱. 这些研究结果的差异性可能主要与nano-TiO2晶型、浓度、受试生物以及试验体系不同有关. 另外,nano-TiO2对As的生物利用性及其毒性效应的影响还可以通过生殖及摄食行为进行传递,对下一代及高营养级生物造成难以预估的风险[11-12]. 因此,进一步探究nano-TiO2与As的复合毒性效应十分必要. 相较于淡水环境,研究人员对咸水环境中nano-TiO2与As交互作用及二者复合毒性效应的关注较少. 由于咸水环境具有高盐度、高离子强度的特点,使得nano-TiO2在咸水环境中的行为及归趋不同于淡水环境,因此亟需加强nano-TiO2与As对咸水生物的复合毒性效应研究. 此外,目前有关nano-TiO2与As的复合毒性效应研究均基于急性毒性试验,而实际环境中生物体往往是持续暴露于多种污染物中,因此在生物体整个生命周期内考察污染物的慢性复合毒性效应可能更具有实际意义.
该研究以咸水环境中的浮游动物——丰年虾(Artemiasalina)为模式生物[13],通过观察五价砷〔arsenate,As(Ⅴ)〕和nano-TiO2在单独和联合暴露条件下对丰年虾存活率、生长发育状况、肠道形态和超微结构的影响,并测定丰年虾对As摄入、累积量以及As在丰年虾体内各亚细胞组分分布情况,揭示在nano-TiO2存在条件下As(Ⅴ)对丰年虾的慢性毒性效应,以期为系统认识咸水体系中nano-TiO2和As复合毒性效应与生态风险评估提供基础数据和理论依据.
1 材料与方法
1.1 试验材料
Nano-TiO2(锐钛矿,纯度≥99.7%,平均粒径<25 nm,表面积为45~55 m2/g)购自美国西格玛奥德里奇公司,用于制备浓度为1 g/L nano-TiO2储备液,室温避光保存备用. 为了使nano-TiO2颗粒分散均匀,每次使用前需将nano-TiO2储备液冰浴超声20 min (40 kHz). 十二水砷酸钠(Na3AsO4·12H2O,分析纯)购自国药集团化学试剂有限公司,用于制备As(Ⅴ)(1 g/L)储备液,置于4 ℃冰箱中避光保存备用. 观赏鱼类海水晶(中盐工程技术研究院有限公司)用于配置人工海水(30‰),人工海水需过滤(0.45 μm,Millipore)后使用. Nano-TiO2在人工海水(30‰,pH=8.0±0.1)中形貌特征、水合粒径和zeta电位在笔者课题组先前研究[12]中已进行表征. 该试验涉及的其他化学试剂(分析纯)均购自国药集团化学试剂有限公司.
1.2 丰年虾孵化与培养
丰年虾(A.salina)滞育卵购自当地水族馆,置于-20 ℃冰箱中解除滞育. 使用曝气24 h人工海水(30‰,pH=8.0±0.1)孵化丰年虾,具体孵化步骤参考文献[7]. 新孵化的丰年虾Ⅰ龄无节幼虫转移到新鲜人工海水中无喂食培养24 h,丰年虾Ⅱ龄无节幼虫即可用于毒性试验.
1.3 试验设置
试验设置1个As(Ⅴ)浓度(0.1 mg/L)和2个nano-TiO2浓度(1和10 mg/L),组别设置如表1所示,所有处理均设3个重复,试验重复两次. 用曝气24 h的人工海水(30‰,pH=8.0±0.1)及预先配置好的As(Ⅴ)和nano-TiO2储备液配置暴露溶液,待As(Ⅴ)在nano-TiO2上吸附平衡后(1 h)即可接入丰年虾[7]. 每个培养皿(15 cm)含200 mL暴露溶液及400只丰年虾Ⅱ龄幼虫. 培养条件:温度(25±2)℃;光照/黑暗循环为16 h/8 h,光照强度为 4 000 lx. 试验为期28 d,每天喂食杜氏盐藻(Dunaliellasalina)(4×104cells/mL)2次,每周更换3次暴露溶液.
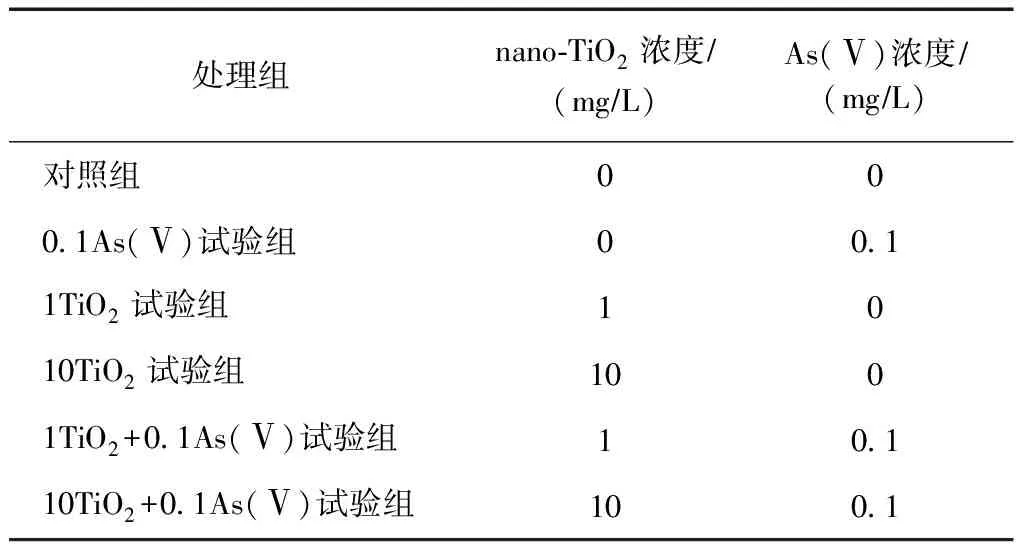
表1 丰年虾28 d长期慢性毒性试验组别设置
1.4 丰年虾存活率及体长测定
暴露期间,每天记录丰年虾死亡个体数,计算存活率. 另外,每周测定丰年虾体长,具体方法:在暴露第7、14、21和28天,随机选取5只丰年虾置于4%甲醛溶液中进行固定,随后置于载玻片上,于倒置电子显微镜(AE31,Motic,德国)下测定体长. 丰年虾头部到尾叉之间的距离即为体长.
1.5 丰年虾肠道形态及超微结构观察
暴露结束后,采用倒置电子显微镜观察丰年虾形态变化,并拍照记录. 另外,参考Bacchetta等[14]方法制作生物样品超薄切片,采用透射电子显微镜(Transmission Electron Microscope,TEM;H-7650,Hitachi,日本)观察丰年虾肠道超微结构变化.
1.6 丰年虾对As的摄入与累积
在暴露第7、14、21和28天收集生物样品(n=50),洗涤后(超纯水冲洗1 min,0.1 mmol/L磷酸盐缓冲液浸泡30 s,超纯水冲洗1 min)均分成两部分. 其中,一部分直接冷冻干燥至恒重,消解后用于测定丰年虾对As的摄入;另一部分转至干净人工海水中,净化10 h[7]后冷冻干燥至恒重,消解后用于测定丰年虾对As的累积,消解过程参考文献[15]的方法. 消解结束后,样品用2% HNO3溶液稀释定容,过滤后用电感耦合等离子体质谱仪(7500Cx型,Agilent,美国)测定样品中的As含量,丰年虾对As的摄入及积累量均用μg/g (以干质量计)表示. 同时测定标准物质紫菜(GBW08521,国家标准物质研究中心)中的As含量,从而对消解过程进行质控. 另外,丰年虾摄入体内的部分As能在净化过程中通过排泄作用排出体外,可根据式(1)计算净化过程中丰年虾对As的平均排泄速率.
νd=(cu-ca)/10
(1)
式中:νd为As平均排泄速率,μg/(g·h);cu、ca分别为丰年虾对As的摄入量及累积量,μg/g.
1.7 As在丰年虾各亚细胞组分中的分布
按1.6节中方法收集、洗涤和净化生物样品(n=25),随后将样品置于组织匀浆器中匀浆(加入1 mL 0.9%预冷生理盐水). 采用差速离心法(见图1)将生物组织匀浆分为5部分,分别为细胞碎屑组分、富金属矿体(metal rich granules,MRG)组分、细胞器组分、热稳定蛋白(heat-stable protein,HSP)组分和热敏感蛋白(heat-denatured protein,HDP)组分[16]. 所有亚细胞组分均按1.6节所述方法冷冻干燥、消解和测定分析. 结果以各组分中As含量占5个亚细胞组分中As总含量的比例表示.
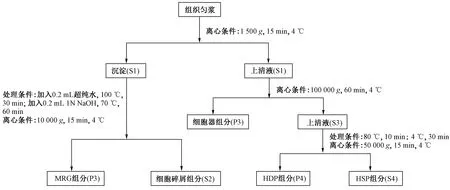
图1 分离各亚细胞组分的差数离心法[16]Fig.1 Differential centrifugation procedure for separating each subcellular fraction[16]
1.8 数据统计分析
采用SPSS 19.0软件对处理组之间差异进行单因素方差分析(one-way ANOVA),P值小于0.05时表示差异显著.
2 结果与讨论
2.1 丰年虾存活率及体长变化
Nano-TiO2与As(Ⅴ)单独或联合暴露28 d过程中丰年虾存活率变化如图2所示. 由图2可见:暴露结束后,对照组存活率大于95%,5个试验组最终存活率在60%~90%之间,其中,1TiO2试验组和10TiO2试验组最终存活率(约为90%)与对照组之间差异不显著,而0.1As(Ⅴ)试验组(约为80%)、1TiO2+0.1As(Ⅴ)试验组(约为70%)和10TiO2+0.1As(Ⅴ)试验组(约为60%)最终存活率均明显低于对照组(P均小于0.05). 与As(Ⅴ)单独暴露组相比,nano-TiO2与As(Ⅴ)联合暴露组丰年虾存活率进一步下降,且0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组之间存在显著差异(P<0.05). 由图3可见:各处理组丰年虾体长均随暴露时间的增长而增加. 暴露第14天时丰年虾体长比暴露第7天时增长近40%;而在暴露第14、21和28天时,丰年虾体长基本维持在同一水平,体长约为 1 000 μm. 整个暴露过程中,5个试验组丰年虾体长均略小于对照组,但与对照组均不存在显著差异(P>0.05).
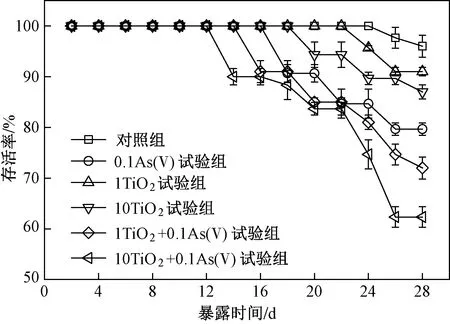
图2 28 d慢性暴露过程中丰年虾存活曲线Fig.2 Survival curves of A. salina under 28 d of chronic exposure
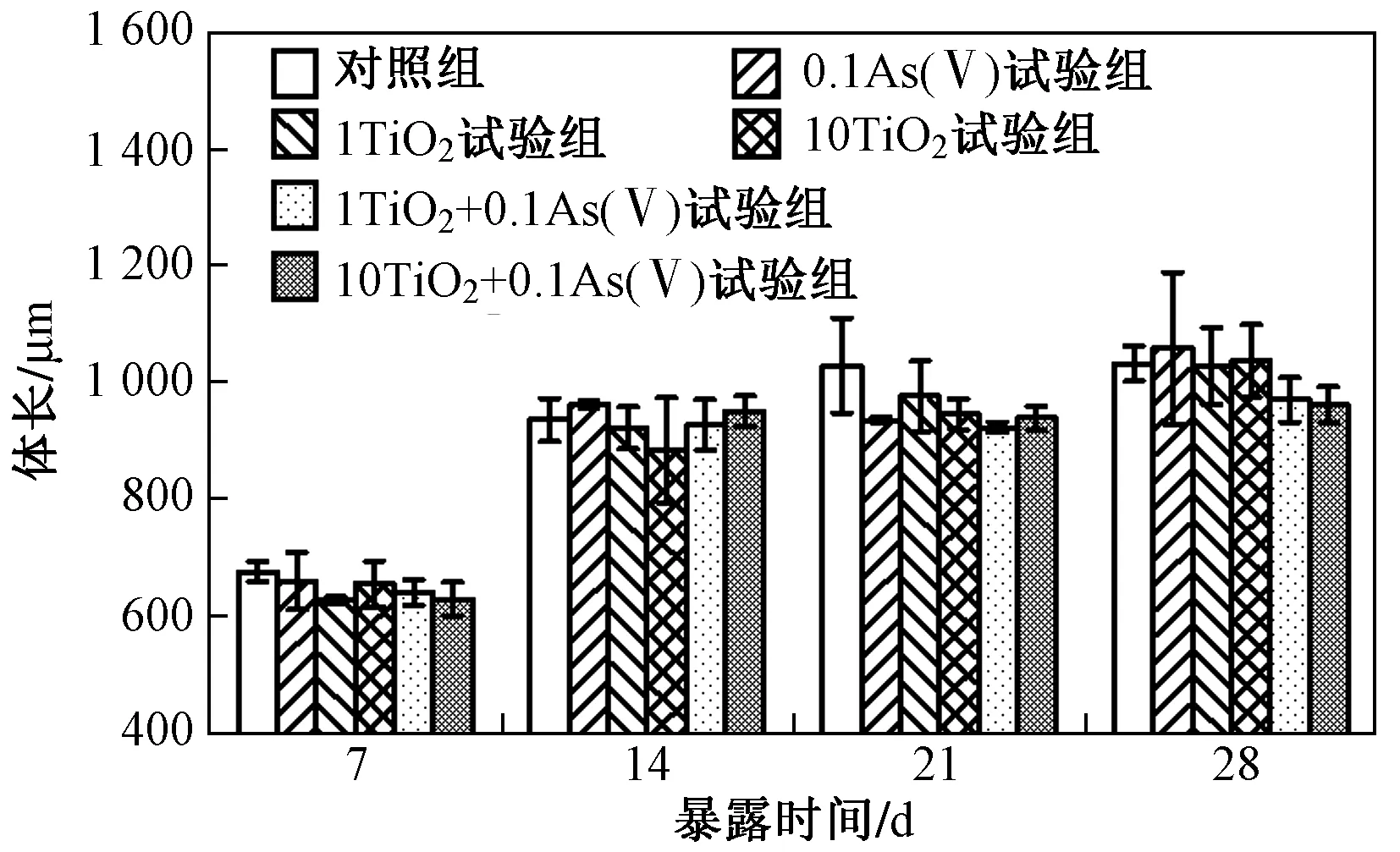
图3 28 d慢性暴露过程中丰年虾体长的变化Fig.3 Change of body length of A. salina under 28 d of chronic exposure
由于在整个暴露过程中nano-TiO2单独暴露组(1TiO2试验组和10TiO2试验组)丰年虾的存活率及生长率与对照组之间差异均不显著,因此在该研究中可以认为nano-TiO2对丰年虾的毒性效应较低,可以忽略其直接的毒理效应,重点关注联合暴露条件下As(Ⅴ)对丰年虾的毒性效应以及nano-TiO2对丰年虾毒性的影响. 已有研究[17]证实,As(Ⅴ)对丰年虾全生命周期存在慢性毒性作用,毒性指标主要集中在存活率、生长率及繁殖率. 笔者研究中nano-TiO2与As(Ⅴ)单独或联合慢性暴露导致丰年虾体长虽略有下降,但与对照组相比并不存在显著差异;相反,0.1As(Ⅴ)试验组、1TiO2+0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组丰年虾存活率显著低于对照组,因此推测与生长率相比,存活率可能是生物体在暴露过程中最敏感的毒性指标. 与笔者研究结果类似,Brix等[17]将丰年虾Ⅰ龄幼虫暴露于不同浓度的As(Ⅴ)溶液28 d,发现不同暴露浓度对丰年虾亲代及子代生长率均没有显著影响,且子代对As(Ⅴ)敏感度降低,而亲代丰年虾存活率比对照组显著下降. 另外,相比As(Ⅴ)单独暴露组,添加nano-TiO2后丰年虾存活率进一步下降,揭示nano-TiO2对As(Ⅴ)毒性有增强作用. 与笔者研究结果类似,Wang等[18]发现,当网纹蚤(Ceriodaphniadubia)同时暴露于As(Ⅴ)和nano-TiO2时,As(Ⅴ)对网纹蚤半致死浓度由As(Ⅴ)单独暴露下的3.68 mg/L降至1.43 mg/L;Fan等[11]发现,As〔As(Ⅴ)和As(Ⅲ)〕与nano-TiO2联合暴露下大型蚤(Daphniamagna)存活率均明显低于As单独暴露条件下.
2.2 丰年虾肠道形态及超微结构变化
暴露结束后,5个试验组丰年虾生长发育进程与对照组相比并没有显著差别,各处理组丰年虾均发育完全,在胸部均可观察到11对附肢. 然而通过观察其内部结构发现,nano-TiO2单独暴露下丰年虾肠道形态未见明显破坏,而As(Ⅴ)暴露组〔0.1As(Ⅴ)试验组、1TiO2+0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组〕丰年虾肠道正常形态被破坏,肠道肿胀变形,且As(Ⅴ)与nano-TiO2联合暴露下破坏作用更明显(见图4). 在0.1As(Ⅴ)试验组、1TiO2+0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组中肠道肿胀的丰年虾占比分别为60%、60%和80%.

注:红色虚线方框内指示丰年虾肠道肿胀变形.图4 暴露28 d后丰年虾肠道形态特征Fig.4 Morphological characteristics of intestine of A. salina after exposed for 28 d
为了进一步探究丰年虾肠道出现肿胀变形的原因,笔者同时观察了丰年虾肠道超微结构. 由图5可见:对照组丰年虾肠道上皮细胞细胞内部结构完好,肠道微绒毛排列整齐,未见明显损伤;而各试验组丰年虾肠道微绒毛排列杂乱,且与对照组相比,肠道微绒毛密度降低(见图5蓝色箭头指示处). 在5个试验组中,每个试验组各观察10个丰年虾肠道电镜图,发现1TiO2试验组和10TiO2试验组中肠道微绒毛密度降低的丰年虾占比较小,分别为10%和30%;而0.1As(Ⅴ)试验组、1TiO2+0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组中肠道微绒毛密度降低的丰年虾占比分别达60%、60%和70%. 另外,0.1As(Ⅴ)试验组丰年虾肠道上皮细胞出现明显细胞质空洞化和细胞质纤维化〔见图5(b)〕. 当添加nano-TiO2后,细胞质空洞化及纤维化程度加深,且与1TiO2+0.1As(Ⅴ)试验组相比,10TiO2+0.1As(Ⅴ)试验组丰年虾肠道超微结构破坏更为严重〔见图5(e)(f)〕. 在10TiO2+0.1As(Ⅴ)试验组还观察到了肠道上皮细胞脱离肠壁的现象〔见图5(f)〕.
功能器官结构变化是生物体在不利环境条件胁迫下受到毒性作用的直接表现,也是分析污染物对其毒性的重要指标[17]. 肠道作为动物重要的消化、吸收和免疫器官,是生物体抵御外源性物质入侵的关键防线[19]. 研究[20-22]表明,不论是重金属暴露、纳米材料暴露或是二者联合暴露,都可能导致生物体肠道受损,直观表现为肠道变形,微观表现为肠道上皮细胞损伤、肠黏膜损伤、炎症和肠道微生物群紊乱. 肠道损伤会影响消化系统正常运行,最终对生物体造成不良影响[23]. 笔者研究中5个试验组丰年虾均存在肠道微绒毛排列杂乱、密度降低的情况,这可能预示着暴露导致肠道炎症的发生[24]. 此外,nano-TiO2单独暴露对丰年虾肠道形态及超微结构并未产生其他显著影响,进一步揭示了nano-TiO2对丰年虾的低毒性. 然而,不论是As(Ⅴ)单独暴露或与nano-TiO2联合暴露均对丰年虾肠道形态及超微结构造成显著破坏. 与笔者研究结果类似,Shi等[25]将鲦鱼(Gobiocyprisrarus)暴露于不同浓度的As(Ⅲ)溶液96 h,TEM结果显示,与对照组相比,暴露组鲦鱼肠道存在大量细胞和组织病变,表现为肠道外观不规则、肠绒毛变性破裂、肠壁皱襞萎缩、肠道上皮细胞增生和肿大. 与存活率结果相似,nano-TiO2参与下As(Ⅴ)对丰年虾肠道破坏作用加剧. Liu等[22]探究Cu2+与两种nano-TiO2(亲水型与疏水型)对大型蚤联合毒性效应时发现:疏水型nano-TiO2存在时Cu的生物积累增加,可能导致更严重的氧化应激损伤;而亲水型nano-TiO2对Cu毒性的促进作用可能与nano-TiO2加剧大型蚤肠黏膜机械损伤有关. 因此,nano-TiO2导致重金属离子毒性效应增强的机制与nano-TiO2种类、受试生物种类以及试验设置紧密相关. 已有研究主要基于短期急性暴露试验,长期慢性暴露下nano-TiO2对As(Ⅴ)毒性的增加效应的研究仍需进一步加强.
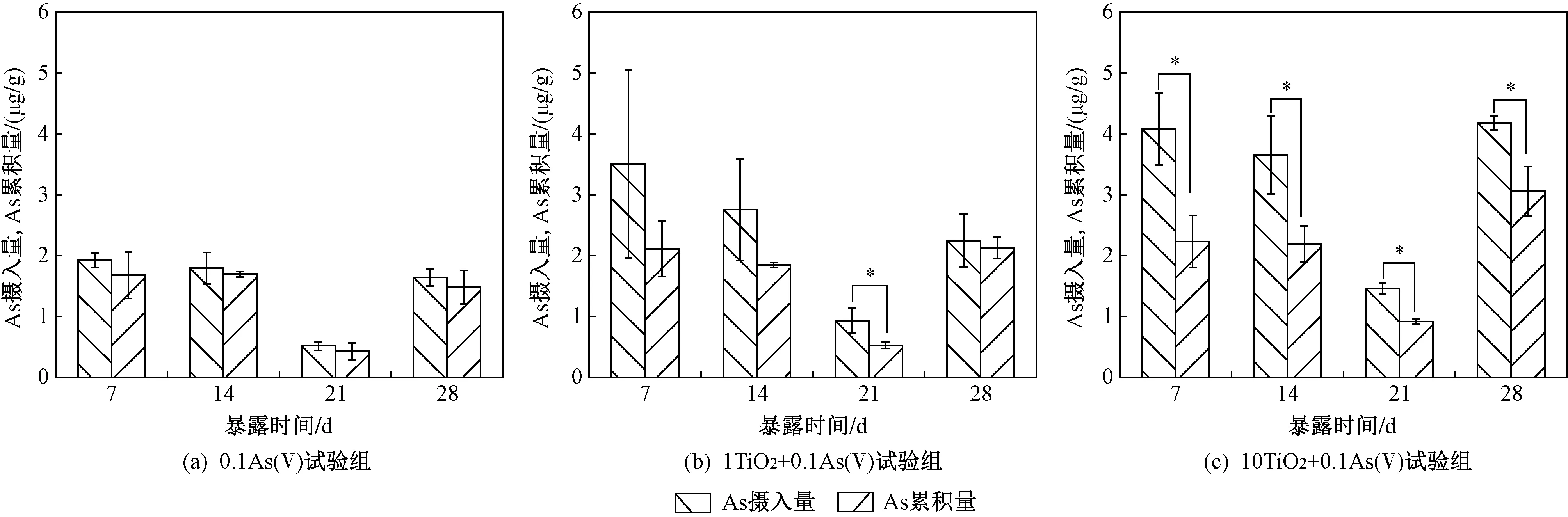
注: *表示摄入量与累积量之间存在显著性差异(P<0.05). As摄入量与积累量以干质量计.图6 28 d慢性暴露下丰年虾对As的摄入与累积Fig.6 The uptake and accumulation of As in A. salina under 28 d of chronic exposure
2.3 丰年虾对As的摄入与累积
由图6可见:各试验组丰年虾在暴露第7、14、28天时对As的摄入和累积并没有显著差异;但在暴露第21天时,丰年虾对As的摄入和累积比第7、14、28天时显著下降. 由于14~21 d是丰年虾主要产卵(子)期,因此丰年虾可能通过子代转移部分As,这与Luo等[8]研究结果一致. 与0.1As(Ⅴ)试验组相比,添加nano-TiO2后丰年虾对As的摄入和累积均增加,且暴露后期(第21和28天),10TiO2+0.1As(Ⅴ)试验组丰年虾对As的摄入与累积均显著增加(P<0.05). 另外,通过对比丰年虾对As的摄入与累积差异发现,0.1As(Ⅴ)试验组丰年虾对As的摄入与累积并无显著差异,1TiO2+0.1As(Ⅴ)试验组丰年虾对As的摄入在暴露第21天时显著高于对As的累积,而10TiO2+0.1As(Ⅴ)试验组丰年虾对As的摄入在整个暴露过程中都明显高于对As的累积.
为了探究As(Ⅴ)单独暴露或与nano-TiO2联合暴露下丰年虾对As的排泄能力,该研究计算了不同处理下丰年虾对As的平均排泄速率(净化10 h). 由图7可见:0.1As(Ⅴ)试验组丰年虾对As的平均排泄速率随暴露时间的延长并未出现明显变化;而1TiO2+0.1As(Ⅴ)试验组和10TiO2+0.1As(Ⅴ)试验组丰年虾对As的平均排泄速率均随暴露时间的延长而下降. 在暴露前期(第7和14天),nano-TiO2能显著提高丰年虾对As的平均排泄速率;然而在暴露后期(第21和28天),添加nano-TiO2对As平均排泄速率没有显著影响.
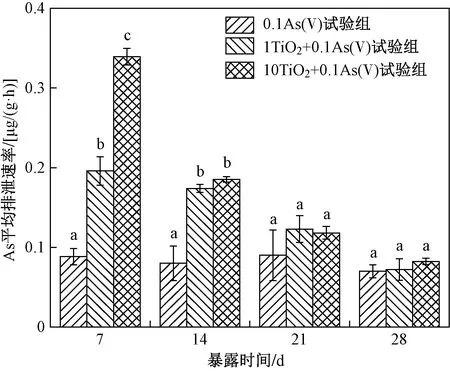
注: 不同小写字母表示试验组之间存在显著性差异(P<0.05).图7 丰年虾在10 h净化过程中对As的 平均排泄速率Fig.7 The average excretion rate of As during 10 h of purification in A. salina
已有研究[7-8,26]发现,海洋微藻(Nannochloropsismaritima)、丰年虾(A.salina)和大型蚤(D.magna)中均可观察到nano-TiO2对As的载体效应. 作为典型非选择性滤食生物,丰年虾能够随机摄取周围环境中1~50 μm颗粒物质[23]. Yan等[7]探究了nano-TiO2在人工海水中的行为及对As(Ⅴ)的吸附,结果表明,nano-TiO2在人工海水中能迅速发生团聚使得nano-TiO2(1和10 mg/L)及As-nano-TiO2复合物的水合粒径在1.0~1.5 μm之间,存在被丰年虾摄取的可能,而摄取As-nano-TiO2复合物增加了丰年虾对As的摄入. 笔者研究中,与0.1As(Ⅴ)试验组相比,nano-TiO2存在下〔10TiO2+0.1As(Ⅴ)试验组〕丰年虾对As的摄入显著增加(P<0.05);同时,添加nano-TiO2会导致丰年虾对As的排泄作用显著增加(第7和14天),最终导致各试验组丰年虾对As的累积无显著差异(P>0.05). 结果表明,生物体对化学物质摄入量并不能真实反映生物体对化学物质的累积及生物利用情况,尤其是在与nano-TiO2等“载体”共存条件下,化学物质毒性机理可能不仅与nano-TiO2载体效应有关,也可能与nano-TiO2无生物可利用性而被生物体快速排泄紧密相关. 然而,随着暴露时间的延长(第21和28天),nano-TiO2对丰年虾As平均排泄速率的影响逐渐消失,而nano-TiO2对As的载体效应依旧显著,导致暴露后期nano-TiO2与As(Ⅴ)联合暴露组中丰年虾对As的累积显著高于As(Ⅴ)单独暴露组,这也可能是暴露后期联合暴露组丰年虾肠道超微结构破坏作用更为严重的原因之一.
2.4 As在丰年虾各亚细胞组分中的分布
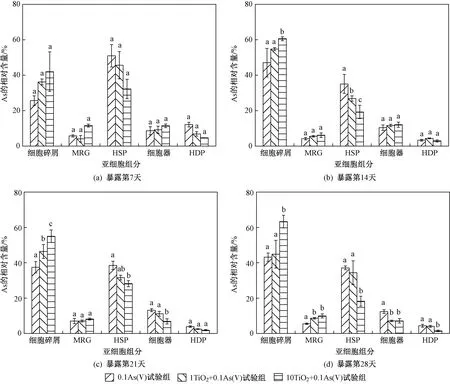
注:不同小写字母表示试验组之间存在显著性差异(P<0.05).图8 As在丰年虾各亚细胞组分中的分布情况Fig.8 Distribution of As in different subcellular fractions of A. salina
单独和联合暴露条件下,As在丰年虾各亚细胞组分(细胞碎屑组分、MRG组分、HSP组分、细胞器组分、HDP组分)中分布情况如图8所示. 由图8可见:在整个暴露阶段,As主要分布在丰年虾细胞碎屑组分(22.98%~66.91%)及HSP组分(15.47%~57.25%). 在暴露前期(第7和14天),As在细胞碎屑组分中的相对含量随暴露时间延长而增加;相反,As在HSP组分中的相对含量随暴露时间延长而降低. 在暴露后期(第21和28天),As在细胞碎屑组分及HSP组分中的相对含量基本相同. 与As(Ⅴ)单独暴露组相比,As在联合暴露组细胞碎屑组分中的相对含量增加,特别是在10TiO2+0.1As(Ⅴ)试验组(第7天,p>0.05;第14、21、28天,p均小于0.05). 在暴露第14、21和28天时,10TiO2+0.1As(Ⅴ)试验组中As在丰年虾细胞碎屑组分中相对含量分别比As(Ⅴ)单独暴露组显著增加了24.55%±6.23%、33.13%±3.52%和46.68%±8.35%. 与此相反,与As(Ⅴ)单独暴露组相比,联合暴露组As在HSP组分中的相对含量下降,特别是在10TiO2+0.1As(Ⅴ)试验组(第7天,p>0.05;第14、21、28天,p均小于0.05). 在暴露第7、14、21和28天时,10TiO2+0.1As(Ⅴ)试验组中As在丰年虾HSP组分中的相对含量分别比0.1As(Ⅴ)试验组降低了20.74%±2.80%、39.83%±9.54%、43.27%±5.29%和50.91%±7.60%.
细胞碎屑组分一般由细胞膜(壁)及组织碎片等组成[27]. 细胞膜(壁)上富含官能基团,可通过静电吸附、化学络合等作用将金属离子隔绝在细胞外[28],从而导致金属离子在细胞碎屑组分中分布比例较高. 研究[7]发现,颗粒结合态金属穿膜能力弱于自由离子态金属. 笔者研究表明,在nano-TiO2存在条件下As在细胞碎屑组分中的相对含量增加,说明由于nano-TiO2对As(Ⅴ)的吸附作用,As-nano-TiO2复合物比离子态As更易被细胞膜阻隔,使得联合暴露组As穿膜能力显著下降,从而导致联合暴露组As在细胞碎屑组分中的相对含量高于As(Ⅴ)单独暴露组,这与Yang等[26,29]研究结果一致;同时,As在细胞碎屑组分中相对含量的增加导致As在细胞器、酶等生物活性组分中的相对含量降低,在一定程度上缓解了As对丰年虾的毒性作用,使丰年虾可以在较长时间暴露下维持正常生长发育. 然而,一部分As仍能够通过细胞膜上的离子通道或胞吞作用进入细胞内,对生物体产生不良影响.
与MRG和HSP组分结合的金属通常被定义为生物解毒金属(biologically detoxified metal,BDM),即金属可以通过与HSP组分结合或通过将金属沉淀成MRG的方式解毒[30]. 笔者研究中As在HSP组分中相对含量较高,说明HSP组分可能参与了丰年虾对As的解毒. Wang等[31]研究证明,As暴露下牡蛎(Crassostreaangulata和Crassostreahongkongensis)通过将体内大部分As分配到HSP组分而解毒. Velez等[32]研究表明,蛤蜊(Venerupiscorrugata)体内累积的As主要分布在HSP组分,表明该组分在As的隔离和稳态中起重要作用. HSP组分一般由富含巯基的金属硫蛋白以及其他巯基化合物和多肽(如谷胱甘肽)组成[33]. 生物体暴露于某些未知生物学功能的金属(如Cd、Cu或As等)能诱导生物体内产生低分子量金属结合蛋白,表明细胞具有识别有毒金属并对其作出反应的独特能力,这对生物体内微量金属代谢和毒理学研究起重要作用[34]. Cd、Cu或As等金属离子对巯基的亲和力较高,研究[35-37]发现,生物体处于Cd、Cu或As等离子暴露下也会出现金属硫蛋白中金属含量增加的现象. 这种金属离子与富含硫基的HSP组分之间的相互作用被认为是生物体对非必需金属离子的一种解毒机制,即二者相互作用限制金属离子在生物体内的移动与转移,金属离子处于隔离状态从而不能与蛋白质、酶和细胞器等生物敏感组分相互作用,从而降低其毒性效应[33]. 然而在笔者研究中,添加nano-TiO2后As在HSP组分中相对含量下降,说明nano-TiO2抑制了丰年虾对As的解毒过程. Fan等[38]研究提出,nano-TiO2存在时一部分Cu2+与nano-TiO2通过形成Cu—O键而被吸附,吸附态Cu不能有效诱导金属硫蛋白形成,从而导致联合暴露组大型蚤体内金属硫蛋白含量显著低于单独暴露组. 由于As(Ⅴ)也能通过与nano-TiO2形成As—O键而被吸附[39],笔者推测这种吸附作用可能也会干扰As(Ⅴ)对丰年虾体内金属硫蛋白形成的诱导作用,使得As在HSP组分中相对含量下降. 因此,nano-TiO2存在时As与金属硫蛋白络合的解毒过程受限,这可能是nano-TiO2增强As毒性效应的重要原因之一.
3 结论
a) Nano-TiO2与As(Ⅴ)联合暴露显著增强As(Ⅴ)对丰年虾的慢性毒性效应,导致丰年虾存活率显著降低及肠道损伤加剧.
b) 在Nano-TiO2与As(Ⅴ)联合暴露后期(第21和28天),nano-TiO2促进丰年虾排泄As的效应减弱,导致联合暴露组丰年虾对As的累积显著增加.
c) 在联合暴露条件下,As在生物解毒组分——HSP组分中占比显著下降,说明nano-TiO2可能会抑制丰年虾体内As解毒过程,从而增强As的毒性效应.
