黄芩素对哮喘小鼠气道平滑肌细胞增殖、迁移及JAK/STAT通路的影响*
2021-12-20卓宋明
余 保,申 严,卓宋明
(深圳市龙岗中心医院呼吸与危重症医学科,深圳 518000)
哮喘是指由常见的气敏性过敏原(如屋尘螨,真菌和空气污染物)引起的气道炎性疾病,是国际医学界公认的主要顽固性疾病之一[1]。气道炎症、气道高反应性和气道重塑是哮喘的重要病理生理特征。一线用于治疗哮喘的药物仍然是β2肾上腺素能受体激动剂和糖皮质激素。然而,这种治疗策略有严重的不良反应,如头痛,震颤,心悸,和心脏衰竭[2],因此有必要开发新型的抗哮喘药,以提高疗效,减少不良反应。气道平滑肌细胞(airway smooth muscle cells,ASMCs)是参与哮喘气道重塑的重要组分,具有增殖、迁移、分泌等功能,能释放促炎、抗炎介质及免疫调节因子,调控气道炎症反应。气道平滑肌细胞的异常增殖是气道重塑的重要病理过程[3]。因此,从调控ASMCs增殖的角度探寻治疗哮喘的新靶点及药物具有重要意义。黄芩素是从黄芩的干燥根中分离得到的一类黄酮类化合物,也是黄芩的主要活性成分。研究表明,黄芩素具有抗炎、抗氧化、抗病毒、修复受损肺组织等作用[4],也可抑制多种肿瘤细胞的增殖、迁移[5],且黄芩中黄酮类提取物对血管平滑肌细胞的增殖和迁移具有抑制作用[6],而黄芩素对哮喘是否有保护作用还未见相关报道。Janus蛋白酪氨酸激酶(Janus protein tyrosine kinase,JAK)/信号转导和转录活化蛋白(signal transducer and activator of transcription,STAT)途径对哮喘中多种细胞因子和黏附分子表达起重要作用[7-8]。黄芩素可通过抑制JAK/STAT抑制膀胱癌细胞的迁移侵袭[5]。因此,本研究以哮喘小鼠ASMCs为对象,探究黄芩素对ASMCs增殖、迁移的影响及可能的作用机制,为哮喘的防治及黄芩素的临床应用提供实验参考。
1 材料与方法
1.1 实验动物
雄性健康SPF 级Balb/c 小鼠,6~8 周龄,体重(18~22)g,购自济南朋悦动物繁育有限公司,合格证号为SCXK(鲁)20140007。所有动物均严格按照动物饲养规则喂养,温度为(24±2)℃,湿度为50%~60%,12 h明暗交替,自由饮水和摄食。
1.2 药品及试剂
黄芩素(纯度>98%,DH0024)购自成都德思特生物技术有限公司;重组小鼠血小板衍生生长因子(platelet-derived growth factor,PDGF,货号:AF-100-14B-100)、重组小鼠白介素6(Interleukin 6,IL-6,货号:AF-216-16)购自派普泰克生物科技(苏州)有限公司;胎牛血清、DMEM 培养基购自美国Gbico 公司;四甲基偶氮唑盐比色法(MTT)、蛋白提取试剂盒、BCA 试剂盒均购自上海碧云天公司;二甲基亚砜(DMSO,美国Sigma公司);小鼠IL-6(MU30044)、IL-8(MU30010)ELISA检测试剂盒购自武汉贝茵莱生物科技有限公司;兔抗JAK2(ab108596)、p-JAK2(ab32101)、STAT3(ab68153)、p-STAT3(ab76315)、β-actin(ab8227)、山羊抗兔IgG H&L(HRP)(ab205718)均购自英国abcam公司;细胞培养箱购自美国Thermo Scientific 公司;iMark680 多功能酶标仪、蛋白转膜装置购自美国Bio-Rad 公司;IX71 型相差显微镜购自日本Olympus公司。
1.3 方法
1.3.1 小鼠原代ASMCs的分离与培养
小鼠颈椎脱臼法处死后,75%乙醇浸泡消毒,取出气管和肺组织,参照文献[9]将取出的组织浸泡在含1%青霉素和链霉素的PBS 中,剔除食管及多余组织,剥离气管平滑肌组织,分离、剪碎后,将其放入含20%胎牛血清的DMEM培养基中,于37℃、5%CO2培养箱中培养,待细胞融合至80%以上时进行传代。差速贴壁法纯化细胞,纯化后继续培养,用4~6代细胞进行实验。
1.3.2 MTT法检测细胞增殖能力
取第4~6 代对数生长期的ASMCs,胰蛋白酶消化后将细胞悬液密度调整为4×104/mL,接种于96孔板(边缘孔用无菌PBS填充),每孔100 μL。待细胞贴壁长至80%密度时,更换不含血清的培养基饥饿处理24 h,加入PDGF(10 ng/mL)[10]干预试剂继续培养24 h,然后分别加入不同浓度的黄芩素(0 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L)药液10 μL。另设对照组(加培养液和细胞,不加干预试剂)、JAK/STAT信号通路激活剂IL-6与黄芩素联用组(加50 ng/mL的IL-6和40 μmol/L的黄芩素)[5],于培养箱中继续培养48 h。在培养结束前4 h,每孔加入10 μL 的MTT 溶液(5 mg/mL),于培养箱中孵育4 h,吸去上层清液后加入150 μL/孔的DMSO,490 nm波长处测定各孔吸光度(OD),实验重复3次。
细胞增殖率=(用药组OD 值-空白孔OD 值)/(对照组OD值-空白孔OD值)×100%。
1.3.3 划痕实验检测细胞迁移能力
取第4~6 代对数生长期的ASMCs,胰蛋白酶消化后调整细胞浓度为1×105个/mL,接种于6 孔板中,待细胞完全贴壁后,用移液器尖端在每个孔内划一道痕,细胞分组及给药同“2.2 项”,分别于加药前和加药培养48 h后在倒置显微镜下拍照,观察划痕愈合情况,计算细胞迁移率,实验重复3次。细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%
1.3.4 ELISA 法检测各组细胞培养上清中相关炎症因子水平
细胞按照“2.2 项”操作步骤进行分组和给药。收集加药后培养48 h的细胞上清液,按照试剂盒说明书的操作,检测细胞上清液中IL-6、IL-8水平。
1.3.5 蛋白免疫印迹(western blotting)检测JAK/STAT通路相关蛋白表达
细胞按照“2.2 项”操作步骤进行分组和给药。收集加药后培养48 h 的细胞,提取细胞中的总蛋白,BCA 法测定蛋白浓度后取等量蛋白质样品上样,SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入一抗(JAK2、p-JAK2、STAT3、p-STAT3,βactin,按1∶1 000的比例稀释;β-actin按1∶2 000的比例稀释),4 ℃下孵育过夜,HRP 标记的羊抗兔IgG二抗(1∶5 000)室温孵育1h,化学发光法(ECL)显色,以β-actin为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计,计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析(One-way ANOVA),组间有差异进一步采用SNK-q检验;以P<0.05为差异有统计学意义。
2 结果
2.1 黄芩素对ASMCs细胞增殖的影响
与对照组相比,PDGF 组细胞增殖率显著升高(P<0.05);与PDGF 组相比,10 μmol/L、20 μmol/L、40 μmol/L 黄芩素组细胞增殖率明显降低(P<0.05);与40 μmol/L 黄芩素组相比,IL-6+40 μmol/L黄芩素组细胞增殖率明显升高(P<0.05),见表1。
表1 黄芩素对ASMCs细胞增殖的影响 ,n=3
与对照组相比,aP<0.05;与PDGF 组相比,bP<0.05;与40 μmol/L黄芩素组相比,cP<0.05。
3.2 黄芩素对ASMCs细胞迁移能力的影响
划痕愈合实验结果显示,与对照组相比,PDGF组细胞迁移率显著增加(P<0.05);与PDGF组相比,10 μmol/L、20 μmol/L、40 μmol/L黄芩素组细胞迁移率明显降低(P<0.05);与40 μmol/L黄芩素组相比,IL-6+40 μmol/L黄芩素组细胞迁移率明显增加(P<0.05),见图1、表2。
表2 黄芩素对ASMCs细胞迁移能力的影响 ,n=3
与对照组相比,aP<0.05;与PDGF 组相比,bP<0.05;与40 μmol/L黄芩素组相比,cP<0.05。
3.3 黄芩素对ASMCs细胞上清液中炎症相关因子水平的影响
与对照组相比,PDGF组细胞上清液中IL-6、IL-8水平显著增加(P<0.05),与PDGF组相比,10 μmol/L、20 μmol/L、40 μmol/L黄芩素组细胞上清液中IL-6、IL-8 水平明显降低(P<0.05);与40 μmol/L 黄芩素组相比,IL-6+40 μmol/L 黄芩素组细胞上清液中IL-6、IL-8水平明显增加(P<0.05),见表3。
表3 黄芩素对ASMCs细胞上清液中炎症相关因子水平的影响 ,pg/mL,n=3

表3 黄芩素对ASMCs细胞上清液中炎症相关因子水平的影响 ,pg/mL,n=3
与对照组相比,aP<0.05;与PDGF 组相比,bP<0.05;与40 μmol/L黄芩素组相比,cP<0.05。
3.4 黄芩素对ASMCs 细胞JAK/STAT 通路相关蛋白表达的影响
Western blotting检测结果显示,与对照组相比,PDGF组细胞p-JAK2/JAK2、p-STAT3/STAT3表达显著增加(P<0.05);与PDGF 组相比,20 μmol/L、40 μmol/L 黄芩素组细胞p-JAK2/JAK2、p-STAT3/STAT3 表达明显降低(P<0.05);与40 μmol/L 黄芩素组相比,IL-6+40 μmol/L 黄芩素组细胞p-JAK2/JAK2、p-STAT3/STAT3 表达明显增加(P<0.05),见图2、表4。

图2 黄芩素对ASMCs 细胞p-JAK2/JAK2、p-STAT3/STAT3表达的影响
表4 黄芩素对ASMCs 细胞p-JAK2/JAK2、p-STAT3/STAT3表达的影响 ,n=3
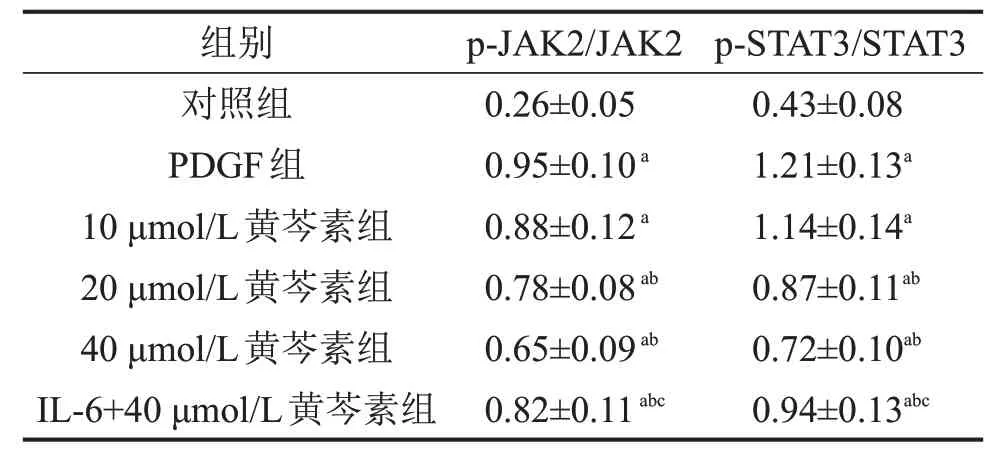
表4 黄芩素对ASMCs 细胞p-JAK2/JAK2、p-STAT3/STAT3表达的影响 ,n=3
与对照组相比,aP<0.05;与PDGF 组相比,bP<0.05;与40 μmol/L黄芩素组相比,cP<0.05。
3 讨论
支气管哮喘患者在接受常规雾化治疗后,相当多的患者仍难以缓解症状,从而发展为难治性支气管哮喘;哮喘发病机理尚不清楚,许多研究认为气道炎症细胞因子在哮喘的发病中表现出异常高的水平,并且是导致气道重塑的关键因素[11]。ASMCs是调节气道阻力和反应过度的主要细胞,其过度收缩会通过缩小气道内腔,限制气体交换而导致哮喘症状的发展[12]。
近年来,中药因其药理作用广泛、毒性小、不良反应少等优点受到越来越多的关注,不少中药及其有效成分可以有效缓解哮喘发作,已经成为哮喘治疗的热点。黄芩素(5,6,7-三羟基-2-苯基-4H-1-苯并吡喃-4-酮)是从黄芩根中提取的主要黄酮之一。在多种疾病中具有药理特性,包括心血管疾病[13]、细菌感染[14]和癌症[15]。有越来越多的研究报道了黄芩素的抗过敏作用。黄芩素可以有效抑制尘螨和卵白蛋白(OVA)诱导的气道过敏小鼠模型中肺部嗜酸性粒细胞浸润[16]。Xu 等[17]研究发现黄芩素可通过灭活NF-κB 途径来有效降低OVA 诱导的嗜酸性气道炎症、黏液过度产生、气道重塑和气道高反应性,表明黄芩素可作为预防或治疗哮喘的药物。Kong等[18]发现在PDGF 诱导的ASMCs 增殖和迁移过程中炎性因子TNF-α,IL-1β,IL-6 和IL-8 的释放增加。在人气道平滑肌细胞中增加IL-6,IL-8 的生物合成,可促进气道狭窄并诱导促炎表型和气道平滑肌收缩,促进哮喘发作[19]。本研究结果发现,在PDGF 诱导的小鼠ASMCs 增殖过程中IL-6,IL-8 水平显著增加,而黄芩素能明显降低IL-6,IL-8 水平,抑制小鼠ASMCs 的增殖和迁移,提示黄芩素可能通过抑制炎症和气道重塑对哮喘具有治疗作用,与以上研究结果一致。
JAK/STAT 信号传导途径是少数多效性级联反应之一,在细胞增殖过程中起着至关重要的作用。有研究发现,黄芩素和哮喘相关靶标(IL-4,IL-5,IL-10,IL-13和IFN-γ)直接参与Th1和Th2细胞分化以及与哮喘相关的信号通路(NF-κB,IL-17,T 细胞受体,TNF,JAK-STAT信号通路等)[20]。Qi等[21]的研究表明,黄芩素可通过抑制JAK2/STAT3 活化来减轻LPS 诱导的巨噬细胞炎症和活性氧(ROS)积累;并且可通过抑制JAK2/STAT3信号通路抑制膀胱癌细胞增殖并促进凋亡[5]。说明黄芩素的抗炎、抗氧化应激和抗肿瘤细胞增殖活性与JAK2/STAT3信号通路的调节有关[22]。研究发现,应用JAK 的抑制剂可以减少变应原诱导的气道炎症,晚期哮喘反应和p-STAT活化,减轻哮喘模型大鼠中的肺部炎症并改善肺功能[23];且STAT3 的活化在气道平滑肌细胞的有丝分裂中发挥重要作用[24]。本研究发现,在PDGF诱导的小鼠气道平滑肌细胞增殖过程中p-JAK2/JAK2、p-STAT3/STAT3 表达显著增加,经黄芩素干预后,p-JAK2/JAK2、p-STAT3/STAT3 表达明显降低,而JAK/STAT 通路激活剂IL-6 与40μmol/L 黄芩素联合干预后细胞增值率、迁移率及p-JAK/JAK、p-STAT6/STAT6表达较40μmol/L黄芩素组明显增加,说明IL-6可逆转黄芩素对ASMCs 增殖和迁移的抑制作用,提示黄芩素对ASMCs 增殖和迁移的抑制作用可能与抑制JAK2/STAT3信号通路有关。
综上所述,黄芩素可抑制哮喘小鼠气道平滑肌细胞的增殖和迁移,其作用机制可能与抑制JAK2/STAT3 信号通路有关。本研究尚存在一定不足,未对JAK/STAT 信号通路中其他STAT 家族蛋白进行深入研究并验证其相关性,这也是我们下一步研究的方向。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- miR-508-3p靶向AFF4/TGFβ1信号通路调控人牙髓细胞分化的机制研究*
- 腹壁剖宫产瘢痕子宫内膜异位症恶变为透明细胞癌1例*
- 急性心肌梗死与2型糖尿病相关差异基因的GEO芯片分析*
- Effect of curcumin on palmitic acid-induced apoptosis and steroid production of ovarian granulosa cells by inhibiting HMGB1-mediated autophagy
- 白藜芦醇对人甲状腺乳头状癌细胞IHH4细胞恶性生物学特征及PI3K/Akt信号通路影响*
- 金丝桃苷对糖尿病肾病大鼠TGF-β1/smad通路及肾上皮间质转化的影响*
