青柿子提取物的抗氧化、抑菌、抑癌活性研究
2021-12-17任维维吴烨婷梁宗瑶李珉梦魏园园段旭昌
任维维,吴烨婷,梁宗瑶,李珉梦,魏园园,段旭昌
(西北农林科技大学食品科学与工程学院 陕西杨凌712100)
柿子(Diospyros kakiThunb.)是柿科(Ebenaceae)柿属(DiospyrosL.)植物,为世界五大重要经济果之一[1]。我国是柿子大国,柿子资源尤为丰富,据不完全统计,目前约有1 058 个柿子品种,栽培面积占世界的91.15%,产量占世界的73.46%[2-4]。柿子果形多样,风味独特,成熟柿果香气馥郁,口感甘甜。柿子作为一种药食同源的果品,素有润肺止咳、化瘀止血、清热败火、健脾化痰等作用,深受大众喜爱[5-7]。研究表明,柿果还含有许多营养物质,包括多酚类、维生素类、类胡萝卜素以及膳食纤维等,这些物质赋予其一定的药用和保健功效[8-9]。
青柿子,即未成熟的柿子,其果实中富含可溶性单宁类成分,是柿子中可以开发利用的重要物质。目前,单宁在食品工业、日用化妆品、制革、医疗保健、化工等领域广为应用,具有多重开发价值,已有关于柿子单宁具有清除自由基、抑制细胞毒性、抗炎、降血脂、降血压、降血糖等的报道[10-14]。柿子在生长过程中会产生大量生理落果,约占总量的百分之十,若不充分利用,则对柿子资源造成不必要的浪费,同时引起一系列生态环境问题[15]。目前,国内外对于青柿子的加工利用研究较少。本文研究青柿子提取分离物的成分及功能性,为青柿子单宁的综合开发提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
青柿子,品种为火柿子,于2017年8月上旬采摘于西北农林科技大学树木园。1,1-二苯基-2-三硝基苯肼(DPPH·)(分析纯级)、2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS·+)(分析纯级),美国Sigma-Aldrich 公司;沙门氏菌ATCC29212、大肠杆菌ATCC25922、志贺氏菌SHIELLA、阪崎杆菌ATCC25944、金黄色葡萄球菌ATCC29213,食品学院微生物实验室提供;人肝癌HepG2 细胞、人胃癌MKN-45 细胞,动物科技学院提供;明胶(分析纯级),天津市天力化学试剂有限公司、丙酮、乙酸乙酯等(分析纯级),天津市科密欧化学试剂有限公司。
1.2 仪器与设备
UV-2550 紫外分光光度计、高效液相色谱仪,日本岛津公司;Vertex70 傅里叶变换红外光谱仪,德国布鲁克公司;Bio-Rad 680 型全波长酶标仪,上海富众生物科学有限公司;Y1-050ST 超声清洗机,河北德科机械科技有限公司;LGJ-100 冷冻干燥机,北京四环仪器公司;DZF6092 生化培养箱,上海一恒科学仪器有限公司;CO2细胞培养箱,美国热电公司。
1.3 方法
1.3.1 青柿子提取物的制备 将青柿子清洗,去蒂、核,破碎成泥。称取350 g 柿泥,按料液质量体积比为1 g∶5 mL 加蒸馏水,于30 ℃超声水提取80 min,抽滤,滤渣以同样方式再提取2 次,合并滤液,浓缩至1/2 体积,分次向浓缩液中加入100 mL 质量浓度为80 g/L 的明胶溶液,充分搅拌产生沉淀,至上清液澄清,抽滤,分别收集上清液和明胶沉淀物。将上清液浓缩成膏体(可溶性固形物含量为55%),用相同体积的乙酸乙酯充分萃取后,合并萃取相,40 ℃回收乙酸乙酯,冻干得分离组分F1。明胶沉淀用质量体积比为1 g∶5 mL 的丙酮溶液于50 ℃超声提取30 min,共提取3 次,收集提取液,在50 ℃条件下回收丙酮,冻干得分离组分F2。用丙酮提取的明胶沉淀再用质量体积比1 g∶5 mL 的酸性丙酮(每升丙酮中加入体积分数为2%的1 mol/L HCl)于50 ℃超声辅助提取30 min,重复提取3 次,收集酸性丙酮提取液,用NaOH 调pH 值至中性,50 ℃回收丙酮,用无乙醇溶解脱盐,冻干得分离组分F3。
1.3.2 成分鉴定
1.3.2.1 紫外光谱分析 将组分F1、F2、F3分别用乙醇配制成一定浓度的溶液,测定波长190~800 nm 范围的紫外光谱,以溶剂作为空白对照,分析各分离组分的成分结构[16]。
1.3.2.2 红外光谱分析 将组分F1、F2、F3冻干粉分别与干燥的KBr 按质量比1∶100 充分混匀,研磨压片,在4 000~400 cm-1范围扫描各分离组分的红外光谱图,分析其分子结构组成[17]。
1.3.2.3 HPLC 分析 以15 种已知物质为对照标准品,采用HPLC 分析成分组成。分析条件:反相C18 柱(4.6 mm×250 mm,粒径5 μm),检测条件:波长280 nm,柱温30 ℃,用0.1%乙酸溶液作流动相A,甲醇作流动相B,流速0.2 mL/min,进样量20 μL,采用0~10 min 5%~14% B,10~25 min 14%~40% B,25~32 min 40%~50% B,32~35 min 50%~80% B,35~55 min 80% B,55~65 min 80%~5% B,65~70 min 5% B 梯度洗脱[18-19]。F1、F3为1 mg/mL 水溶液,F2为2 mg/mL 丙酮溶液,进样前过0.45 μm 滤膜,在上述色谱条件下分析样品。
1.3.3 体外抗氧化活性 将F1、F2、F3及VC 配制成2 mg/mL 乙醇溶液,根据需要稀释成不同质量浓度,备用。根据Lee 等[20]和Chang 等[21]的方法测定组分F1、F2、F3的DPPH·清除能力;参考Kim等[22]的方法测定ABTS·+清除能力;参考Tsai 等[23]和Liu 等[24]的方法测定·OH 清除能力;参考齐岩[25]的方法测定组分的总还原能力。以VC 作阳性对照,分析青柿子分离组分的体外抗氧化活性。
1.3.4 抑菌活性
1.3.4.1 菌悬液制备 将沙门氏菌ATCC29212、大肠杆菌ATCC25922、志贺氏菌SHIELLA、阪崎杆菌ATCC25944、金黄色葡萄球菌ATCC29213 5种供试菌活化后,分别挑取单菌落于LB 液体培养基中,37 ℃摇床培养18 h 后,4 ℃、4 000 r/min 离心10 min,用生理盐水清洗定容至菌悬液菌落总数约为106CFU/mL[26]。
1.3.4.2 最小抑菌浓度(MIC)试验 参考徐云凤等[27]的二倍稀释法,将F1、F2、F3样品及对照苯甲酸钠溶液分别加入LB 培养基中,调整培养基中的样品质量浓度分别为20 000,10 000,5 000,2 500,1 250,625,312,156,78 μg/mL,倒平板,每个平板分为5 个区,每区接种2 μL 不同菌种的菌悬液,于37 ℃恒温培养24 h,以纯培养基的平板为阴性对照,以苯甲酸钠的平板为阳性对照,检测各样品无菌落生长的最低稀释浓度,即最小抑菌浓度。
1.3.5 体外抑制癌细胞增殖活性 参照田程飘等[28]和胡泽成[29]的研究方法。将保存的HepG2、MKN-45 细胞复苏培养,收集对数期传代细胞,用100 μL 含10%胎牛血清培养液重悬细胞,细胞密度调整至2.4×104个/mL。取3 块96 孔板,向每块板的每小孔接种200 μL 细胞悬浮液,于37 ℃、5%CO2、饱和湿度的培养箱中培养24 h,弃每孔培养液,在每块板的对应孔中依次添加200 μL 的F1质量浓度分别为0,50,100,125,150,175,200,250,300,400,500,600 μg/mL 的DMEM 高糖培养液,设置空白对照,3 块板分别培养24,48,72 h,弃小孔培养液,每孔加10 μL 质量浓度为5 mg/mL的MTT 溶液,继续培养4 h,弃上清液,在每孔中添加200 μL DMSO,摇床振荡10 min,于波长490 nm 处测定各孔OD 值,计算细胞增殖抑制率:
细胞增殖抑制率(%)=[1-(OD空白-OD样品)/OD空白]×100
1.4 数据处理
所有试验均重复3 次,结果采用Origin 8.0和SPSS 22.0 软件进行数据处理和分析。
2 结果与分析
2.1 青柿子提取物的分离结果
经试验,从350 g 青柿子中分离得到分离组分F1为63.30 mg,F2为32.50 mg,F3为8.06 mg,合计103.86 mg。
2.2 青柿子分离组分的成分鉴定
2.2.1 紫外光谱分析 青柿子分离组分的紫外吸收光谱分析结果见图1。F1在波长198 nm 和266 nm 处有两个特征吸收峰,F2在波长204 nm 和280 nm 处有两个特征吸收,F3在波长204 nm 和274 nm 有两个特征吸收,均位于波长190~300 nm 范围,且与没食子酸单宁(216 nm 和272 nm)和鞣酸单宁(212 nm 和276 nm)吸收谱图极为相似,说明3 种分离组分可能是间苯三酚类单宁。
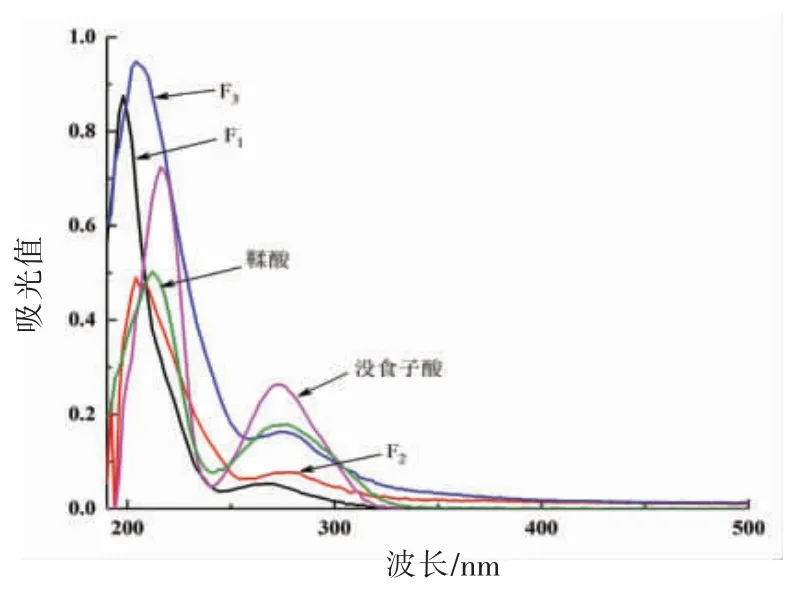
图1 青柿子分离组分的紫外吸收光谱图Fig.1 UV spectrum of immature persimmon extracts
2.2.2 红外光谱分析 青柿子分离组分的红外光谱测定结果见图2 和表1。F1、F2、F3的红外吸收光谱图极其相似,说明其分子的化学结构高度相似。三者在波数3 400 cm-1附近有强宽吸收峰,为-OH收缩振动吸收,在1 600~1 400 cm-1处为芳香族环特征吸收,1 709~1 545 cm-1处为C=C 伸缩振动,1 404~1 339 cm-1处为C-H 弯曲振动,这说明它们的分子中都含有-OH、芳环骨架、C=C、C-H 结构,具有明显的多酚特征。
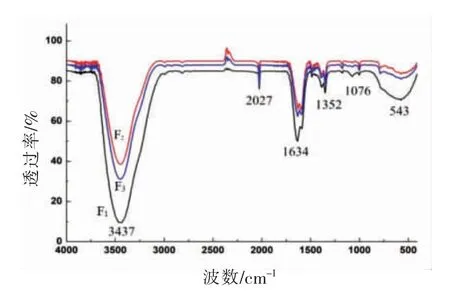
图2 青柿子分离组分的红外吸收光谱图Fig.2 IR spectrum of immature persimmon extracts

表1 青柿子分离组分红外光谱振动峰波数Table 1 Absorption peak wave numbers of infrared spectrum of immature persimmon extracts
2.2.3 HPLC 分析 15 种标准品及F1、F2、F3的HPLC 分析结果分别见表2、图3、图4。由图4a 可知,F1分别在18.204,19.876,27.597,39.869,46.345 min 出现较明显的5 个分离峰,说明F1中至少含有5 种物质。经与标准品保留时间比对,F1的19.876 min 峰与没食子酸出峰时间最接近,含量为240.9 mg/g,其它4 个小峰是未知成分,从峰型和各峰面积分析可知,F1的主要成分为没食子酸,同时含有少量4 种未知成分。由图4b 可知,F2在18.659,30.102,45.407 min 出现3 个分离峰,30.102 min 的峰既高又大,其它两个峰均较小。经与标准品比对,发现F2的保留时间30.102 min 与原儿茶酸的保留时间30.050 min 最接近,说明F2的主要成分为原儿茶酸,含量为270 mg/g,同时还含有少量的两种未知成分。由图4c 可知,F3在18.883 和44.741 min 出现两个较大的分离峰,在24.816,29.389,32.990 min 均出现较小的分离峰,表明F3至少含有5 种成分,其中有两种成分含量较高,经与标准品保留时间比对,44.741 min 与阿魏酸保留时间一致,含量达37.8 mg/g,表明F3的主要成分为阿魏酸,同时含有少量的4 种未知成分。
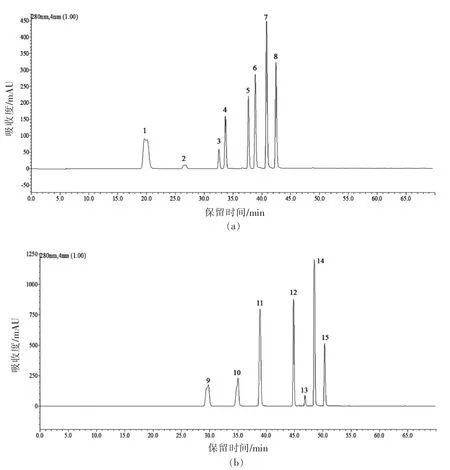
图3 15 种单宁标准品的HPLC 色谱图Fig.3 HPLC profiles of 15 kinds of tannin standard solutions
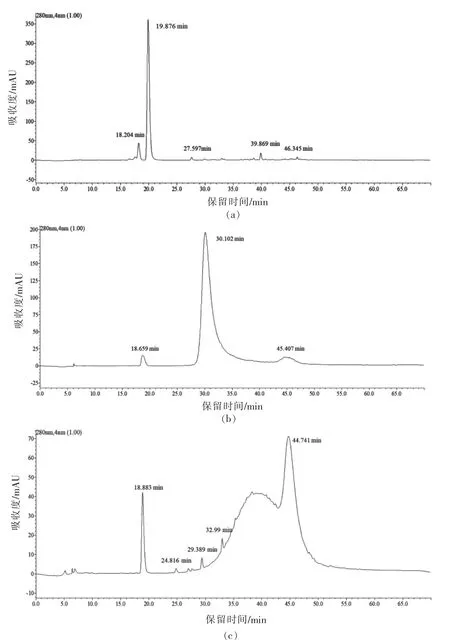
图4 F1(a)、F2(b)、F3(c)的HPLC 色谱图Fig.4 HPLC profiles of F1(a),F2(b)and F3(c)
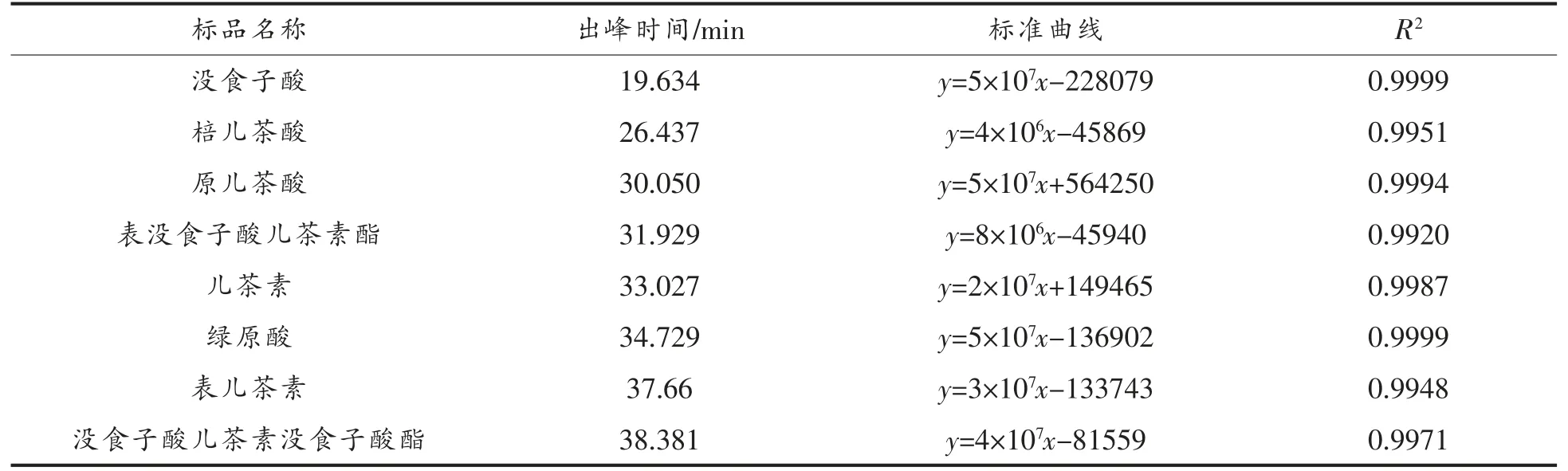
表2 15 种单宁标准品溶液测定结果Table 2 Results of 15 kinds of tannin standard solutions
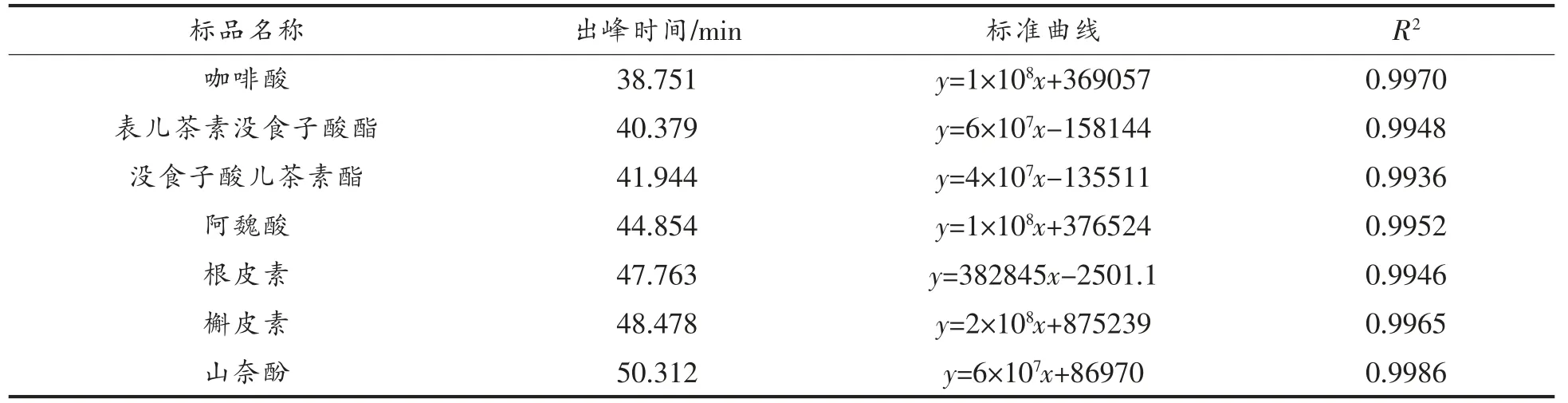
(续表2)
2.3 抗氧化活性分析
青柿子提取分离物的抗氧化试验测定结果见表3。由表3 可知,F1、F3清除DPPH·能力强于VC,F2弱于VC,仅有VC 的一半清除效果;F1清除ABTS·+能力强于VC,F2、F3弱于VC,F2的清除能力约是VC 的1/4,F3的清除能力约为VC 的一半;F1、F2、F3清除·OH 自由基能力均不如VC;F1、F2、F3对Fe3+的总还原能力也均弱于VC,说明青柿子分离组分F1、F2、F3对不同的自由基有不同的清除能力,具有一定抗氧化活性。
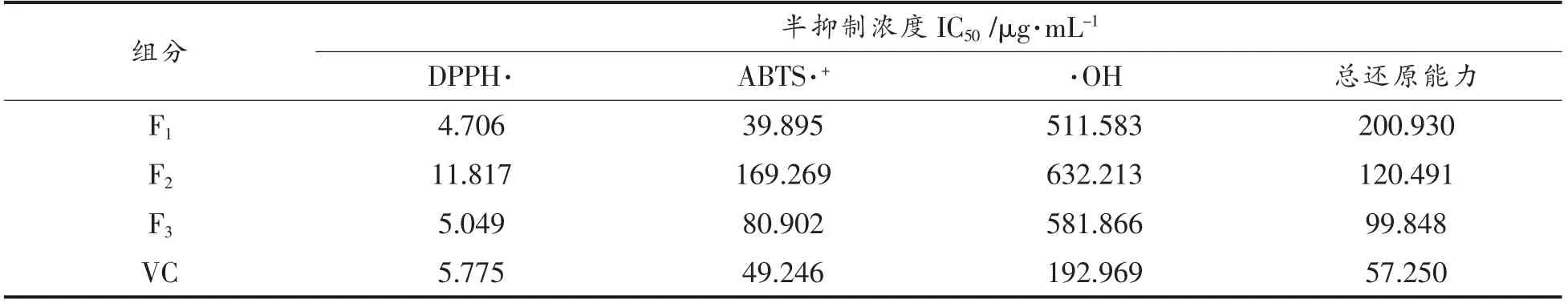
表3 F1、F2、F3 抗氧化活性的IC50 值Table 3 IC50 values of antioxidative activities of F1,F2 and F3
2.4 抑菌活性分析
组分F1、F2、F3及对照苯甲酸钠最小抑菌浓度试验结果见表4。F1对大肠杆菌、志贺氏菌、金黄色葡萄球菌、沙门氏菌、阪崎杆菌的最小抑菌浓度分别为1.250,0.156,0.156,0.625,1.250 mg/mL,其抑菌活性依次为志贺氏菌和金黄色葡萄球菌>沙门氏菌>阪崎杆菌和大肠杆菌,F2对5 种菌的最小抑菌浓度分别为5.000,0.312,0.312,2.500,5.000 mg/mL,其抑菌活性依次为志贺氏菌和金黄色葡萄球菌>沙门氏菌>阪崎杆菌和大肠杆菌,F3对5 种菌的最小抑菌浓度分别为5.000,1.250,0.625,2.500,5.000 mg/mL,其抑菌活性依次为金黄色葡萄球菌>志贺氏菌>沙门氏菌>阪崎杆菌和大肠杆菌。与阳性对照相比,青柿子分离组分F1、F2、F3对5 种供试菌株均具有较强的抑菌活性,抑菌能力为F1>苯甲酸钠>F3>F2。

(续表4)
2.5 体外抑制癌细胞增殖活性分析
预试验表明F2、F3组分对人肝癌HepG2 细胞和人胃癌MKN-45 细胞的体外生长无明显抑制效果。F1对HepG2 和MKN-45 细胞体外增殖抑制试验结果见图5。随着F1质量浓度的增加,对HepG2、MKN-45 细胞增殖抑制率明显增强,当F1质量浓度分别大于200 μg/mL 和300 μg/mL 时,明显抑制HepG2、MKN-45 细胞的体外增殖,在质量浓度0~200,0~300 μg/mL 范围,F1对HepG2、MKN-45 细胞的体外增殖抑制率呈明显的剂量依赖性。当F1质量浓度为200 μg/mL 时,处理HepG2 细胞24,48,72 h 后的抑制率分别达到64.83%,77.96%,82.09%;当F1质量浓度大于300 μg/mL 时,抑制率不再呈剂量依赖性,培养24,48,72 h 后的抑制率分别为77.96%,88.24%,92.93%。同样,质量浓度为300 μg/mL 的F1处理MKN-45细胞24,48,72 h 后的抑制率分别达80.51%,80.64%,84.37%,抑制率随培养时间的延长而增强。由此可知,F1具有明显的体外抑制HepG2、MKN-45 细胞增殖作用,且能促进HepG2、MKN-45 细胞凋亡,说明青柿子中分离的F1组分具有良好的抗癌活性。从上述分析可知,F1主要含没食子酸和4 种未知成分,没食子酸被证明具有抑制癌细胞生长的特性[30],可能是抑制癌细胞的主要物质,其它4 种未知成分也可能具有抑制癌细胞生长功能,尚需研究证实。
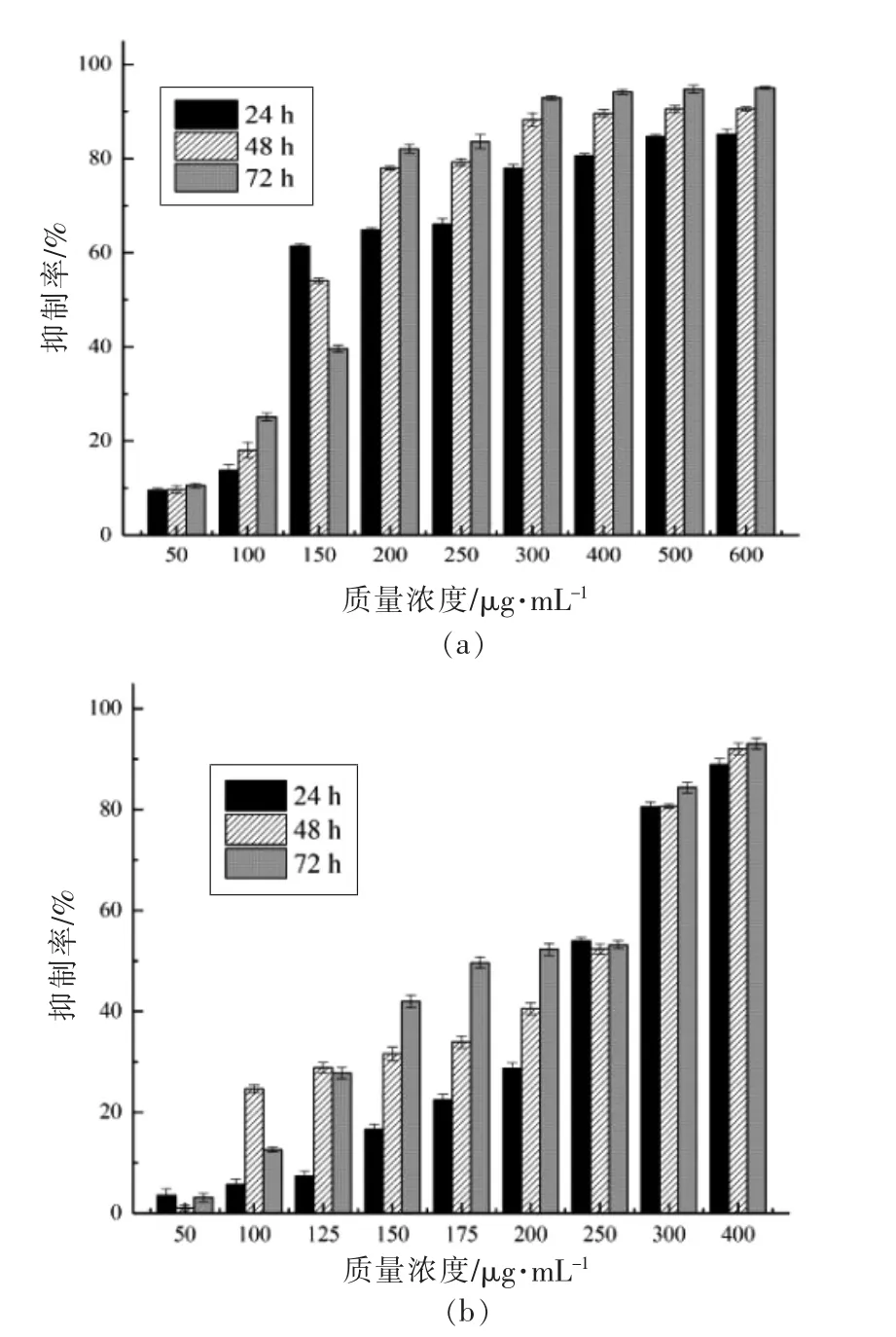
图5 F1 对人肝癌HepG2 细胞(a)、人胃癌MKN-45细胞(b)增殖抑制试验Fig.5 Inhibitory effects of F1 on the proliferation of lung cancer HepG2 cells(a)and gastric cancer MKN-45 cells(b)
2.6 讨论
研究发现,柿子中含有丰富的多酚类物质,其中最常见的成分包括没食子酸、阿魏酸、咖啡酸、香草酸、对香豆酸、表儿茶素、原儿茶酸、原花青素等[31],其中也包括本文对青柿子分离组分的HPLC鉴定结果。Sentandreu 等[32]通过HPLC-MS 法分析得出没食子酸及其衍生物是柿子中主要的酚类物质。柿子中的生物活性物质,尤其是类胡萝卜素和单宁酸类成分,能预防癌症,清除自由基,降低糖尿病和心脑血管疾病的发病风险,此外,柿子中的酚酸,如没食子酸等,还表现出较强的抗氧化活性和潜在的抗菌、抗炎及抗癌能力[33-34]。研究青柿子的分离组分对于开发青柿子功能性成分及其应用具有十分重要的参考价值。
3 结论
1)青柿子分离组分F1、F2、F3的主要成分可能为间苯三酚类单宁,均含有-OH、芳环骨架、C=C、C-H 结构,其中F1的主要成分为没食子酸,含量240.9 mg/g 和少量4 种未知成分;F2主要成分是原儿茶素,含量270 mg/g 和少量两种未知成分;F3主要成分为阿魏酸,含量37.8 mg/g 和少量4 种未知成分。
2)青柿子分离组分F1、F2、F3均对DPPH、ABTS 和OH 自由基表现出良好的清除能力及较强的还原能力,具有一定的抗氧化活性。
3)青柿子分离组分F1、F2、F3均有一定广谱抑菌性,抑菌能力为F1>苯甲酸钠>F3>F2。
4)青柿子分离组分F2、F3无明显的抑癌特性,而组分F1能明显抑制人肝癌HepG2 细胞和胃癌MKN-45 细胞的体外增殖,在一定质量浓度范围呈剂量依赖性。
