基于标记法的福白菊精油抗真菌机理研究
2021-12-16吴美婵王书珍邵秀丽
付 俊,吴美婵,王书珍,邵秀丽,何 峰,
(1.黄冈师范学院经济林木种质改良与资源综合利用湖北省重点实验室,黄冈438000;2.大别山特色资源开发湖北省协同创新中心,黄冈438000;3.山东中医药大学药学院,济南250355)
真菌感染给人类健康带来重大危害,科学家们一直致力于寻找安全、高效的抗真菌药物[1~3].其中精油由于其广谱抗真菌活性引起了研究人员的极大关注.例如,He等[4]发现来源于阿舒假囊酵母的精油具有广谱抗真菌活性;Hu等[5]研究了紫苏精油抗黄曲霉的作用机制;Diao等[6]通过测定茴香籽精油处理后酵母细胞内容物的外泄研究了茴香籽精油对酵母细胞膜破坏作用;Tang等[7]发现用精油的主要组分香叶醇和柠檬醛处理黄曲霉后,黄曲霉细胞内会产生过量的ROS,导致其细胞膜被破坏.这些研究启发人们将来源丰富的精油作为天然的抗真菌候选药物.
菊花中含有多种生物活性物质,因此受到了研究人员的广泛关注[8].Yang等[9]发现菊花中的木犀草素可抑制肿瘤细胞生长;He等[10]发现菊花总黄酮可保护动脉内皮细胞免受氧化应激作用;Wu等[11]从菊花中提取的多酚化合物显示出有效的自由基清除活性;Han等[12]研究了5个菊花品种中的11常见种化合物,结果表明这些化合物具有潜在的抗炎作用;Zhang等[13]发现菊花对SARS的治疗和预防具有抗补体活性.但目前利用菊花精油进行抗真菌研究的报道还较少,特别是专门利用标记法研究精油抗真菌机理的报道更少.
福白菊(Chrysanthemum morifoliumcv.Fubaiju)是湖北省麻城市特产菊花品种,是国家地理标志产品,2020年7月麻城福白菊入选中欧地理标志首批保护清单.本文采用福白菊作为研究对象,通过有机溶剂萃取和水蒸气蒸馏相结合制备了福白菊精油.分别采用健那绿、细胞膜荧光探针1,1'-双十八烷基-3,3,3',3'-四甲基吲哚菁高氯酸盐(DiI)、碘化丙啶(PI)、罗丹明123和溴化乙锭(EB)等染料标记酵母细胞、酵母细胞膜、核酸线粒体膜以及质粒DNA,研究了福白菊精油的抗真菌机理,以便为将植物精油开发成为天然抗真菌药物提供理论依据.
1 实验部分
1.1 试剂与仪器
福白菊(Chrysanthemum morifoliumcv.Fubaiju)采收于湖北省凤凰山药业有限公司福白菊种植基地,标本保藏于黄冈师范学院标本馆(保藏编号为HGNU202000366);抗真菌实验所用的指示菌为酿酒酵母(Saccharomyce scerevisiaeATCC 9080,S.cerevisiae),购于上海鲁微科技有限公司;染料健那绿(纯度≥98%)、细胞膜红色荧光探针DiI(纯度≥98%)、碘化丙啶(纯度98%)和溴化乙锭(纯度≥95%)购于上海碧云天生物技术有限公司;荧光染料罗丹明123(纯度≥95%)购于福州飞净生物科技有限公司;其它化学试剂均为分析纯,购于上海麦克林生化科技有限公司.
CX 41型荧光显微镜和CX41型高清显微镜,日本Olympus公司;A1 MP STORM型多光子-共聚焦显微镜,日本Nikon公司.
1.2 福白菊精油的制备
采集含苞待放的菊花花蕾进行冷冻干燥,再用粉碎机将干燥后的花蕾粉碎.以正己烷为溶剂,将菊花花蕾与正己烷按质量比1∶4进行萃取,萃取时间3 h,期间适当振荡.抽滤得到萃取液,原料部分再利用正己烷进行第二次和第三次萃取,合并所有萃取液进行减压蒸馏,浓缩后得到粗制毛油.利用水蒸汽对粗制毛油进行蒸馏,得到油-水混合物.将油-水混合物在低温条件下离心后,收集油层,然后用无水亚硫酸钠进行脱水,得到福白菊精油,置于棕色瓶中于4℃下避光保存.
1.3 抗真菌机理研究
酿酒酵母具有真核细胞生命活动最基本的特征,常作为研究真核生物的模式生物.本文选用酿酒酵母为对象,使用健那绿、DiI、PI、罗丹明123和EB等染料来研究福白菊精油对酿酒酵母的抗真菌机理.
将指示菌酿酒酵母接种于灭菌的液体培养基中,于28℃培养10 h,离心收集培养的指示菌液,用磷酸盐缓冲液(PBS缓冲液,pH=7.2)洗涤3次并制备成悬浮液,最终获得细胞密度为106CFU/mL的酵母菌悬液.
取3份1 mL酵母菌悬液于Eppendorf管中,分别加入0,10和20 μL福白菊精油,于30℃黑暗条件下孵育1 h.各管中均加入10 μL健那绿染料,于30℃黑暗条件下孵育过夜.培养后,洗去染料和精油,将10 μL酵母菌悬液均匀涂覆于载玻片上,采用高清显微镜观察样品中酿酒酵母细胞的颜色变化来确定福白菊精油对酵母是否具有杀灭作用[14].
利用DiI直接标记酵母细胞膜,研究福白菊精油对细胞膜的破坏作用.取3份1 mL酵母菌液于Eppendorf管中,分别加入10 μL DiI染料,于30℃黑暗条件下孵育过夜.分别加入0,10和20 μL福白菊精油,于30℃黑暗条件下孵育1 h.洗去染料和精油,将10 μL酵母菌悬液均匀涂覆于载玻片上,利用多光子-共聚焦显微镜观察酿酒酵母溶液荧光强度变化,激发波长和发射波长分别为549和565 nm[15].
利用PI标记酵母细胞膜被破坏后泄露的核酸,参照文献[16]方法进一步研究福白菊精油对酵母细胞膜的破坏作用.利用多光子-共聚焦显微镜观察时的激发和发射波长分别为535和615 nm[16].
参照文献[17]方法,利用罗丹明123标记研究福白菊精油对酵母线粒体膜的作用,利用多光子-共聚焦显微镜观察时的激发和发射波长分别为488和528 nm[17].
向4个Eppendorf管中分别加入5 μL质粒(PCAMBIA1303)和15 μL TE缓冲液[20 mmol/L Tris和2 mmol/L乙二胺四乙酸(EDTA,pH=8.0)],然后向每个管中加入2 μL福白菊精油和1 μL EB溶液,混合均匀后于28℃下孵育3 h.将每个管中的样品点样在1.2%琼脂糖凝胶上,电泳30 min(28℃,10 V),观察各泳道中不同条带的位置,以确定精油对质粒DNA的破坏作用[18].以DNA marker、未处理的环形质粒样品和环形质粒用内切酶(Bam HI,0.1 mg/mL)处理后的样品分别作为对照.
2 结果与讨论
2.1 精油的制备
以福白菊为原料提取出的淡黄色福白菊精油具有浓郁的、独特的菊花香味,产率为(0.64±0.2)%,高于神龙架产的野菊花精油(产率0.43%)[19],也高于西班牙产的菊花精油(产率0.1%)[20].
2.2 抗真菌机理
2.2.1 基于健那绿标记的福白菊精油对酵母的杀灭作用利用健那绿标记时精油对酵母的杀灭作用如图1所示.健那绿能够标记正常的酵母细胞[图1(B)],随着对酵母处理的精油量增加,健那绿标记颜色变浅[图1(C)],甚至完全消失[图1(D)],与未标记的酵母之间没有明显差异[图1(A)].健那绿是专一性的活细胞线粒体染料,与线粒体中有活性的细胞色素C氧化酶(COX)结合后,可保持氧化状态,呈现蓝绿色;而死亡细胞中COX失活,健那绿则被还原,呈现无色.在本文中,随着处理酵母的精油量增加,健那绿标记颜色变浅,甚至完全消失,说明精油对酵母的杀灭作用随着浓度的增加而增强,最终导致细胞死亡[14].
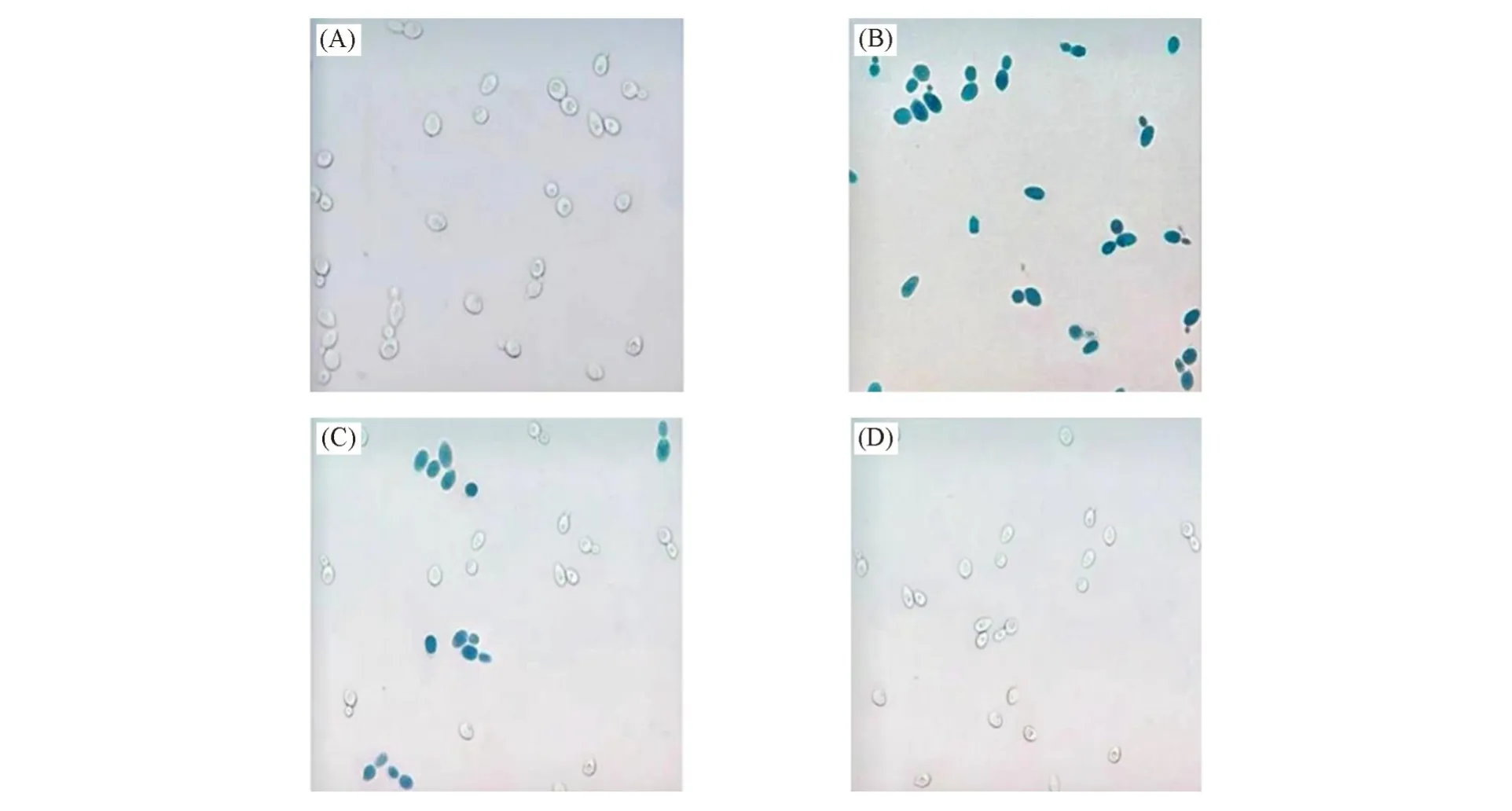
Fig.1 Effect of Fubaiju essential oil on S.cerevisiae according to Jana green labeling
2.2.2 基于DiI标记的福白菊精油对酵母细胞膜的破坏作用利用DiI标记时精油对酵母细胞膜的破坏作用如图2所示,其中图2(A)~(C)为明视场条件下观察的酵母细胞,图2(D)~(F)为荧光条件下观察的酵母细胞,图2(A)和(D),(B)和(E),(C)和(F)中酵母位置分别一一对应.DiI是一种亲脂性的细胞膜探针,与细胞膜的亲和力高,进入细胞膜之前荧光非常弱.进入细胞后DiI与完整细胞磷酯双层膜结合后,可逐渐扩散至整个细胞膜,发出强烈的橙红色荧光.当细胞膜被破坏后,DiI从磷酯双层膜上脱落,进入水中,荧光变弱.因此,DiI的荧光强弱可反映细胞膜破坏程度[21].从图2可以看出,经DiI标记但未经福白菊精油处理的正常酵母细胞几乎每个细胞都散发出荧光[图2(D)],表明DiI能正常标记细胞膜完整的酵母.利用10 μL/mL福白菊精油处理经DiI标记的酵母细胞后,部分细胞的荧光消失[图2(E)],表明当酵母被精油处理后,一部分细胞膜被破坏,DiI从细胞膜上脱落,荧光减弱.利用20 μL/mL福白菊精油处理经DiI标记的细胞后,几乎所有细胞的荧光消失[图2(F)],表明当精油作用增强时,细胞膜几乎全部被破坏,DiI从细胞膜上完全脱落,酵母的荧光几乎完全消失.实验结果表明,酵母的细胞膜是福白菊精油抗菌作用的靶点之一.

Fig.2 Effects of Fubaiju essential oil on cell membrane of S.cerevisiae according to DiI labeling
2.2.3 基于PI标记法的福白菊精油对酵母细胞膜的破坏作用利用PI标记时精油对酿酒酵母细胞膜的破坏作用如图3所示,其中图3(A)~(C)为明视场条件下观察的酵母细胞,图3(D)~(F)为荧光条件下观察的酵母细胞,图3(A)和(D),(B)和(E),(C)和(F)中酵母位置分别一一对应.PI是一种红色荧光染料,常用于核酸标记.PI不能通过完整的细胞膜,但能穿过破损的细胞膜并与核酸结合后发出荧光,可利用PI的荧光强弱判断细胞膜被破坏后核酸泄露的程度[22].从图3可以看出,未经精油处理的酵母细胞无荧光[图3(D)],说明细胞完整,PI未能穿过细胞膜与核酸结合.当酵母被10 μL/mL精油处理后,发出少量荧光[图3(E)],说明部分细胞的细胞膜被精油破坏,PI与细胞中泄露的核酸结合,发出荧光.当精油浓度增加到20 μL/mL时,几乎每个细胞都发出荧光[图3(F)],说明此时几乎所有酵母的细胞膜都被破坏,PI与细胞中泄露的核酸结合,精油对酵母细胞膜的破坏作用随着福白菊精油浓度增加而加强.实验结果进一步表明酵母的细胞膜是福白菊精油抗真菌作用的靶点之一.

Fig.3 Effects of Fubaiju essential oil on cell membrane of S.cerevisiae according to PI labeling
2.2.4基于罗丹明123标记的福白菊精油对酵母线粒体膜的破坏作用精油对酿酒酵母线粒体膜的破坏作用如图4所示,其中图4(A)~(C)为明视场条件下观察的酵母细胞,图4(D)~(F)为荧光条件下观察的酵母细胞,图4(A)和(D),(B)和(E),(C)和(F)中酵母位置分别一一对应.罗丹明123是一种检测线粒体膜电位的荧光探针,进入正常细胞线粒体基质后荧光强度降低或消失,但线粒体膜被破坏后,罗丹明123从线粒体基质中释放,发出黄绿色荧光[18].从图4可以看出,经罗丹明123标记但未经福白菊精油处理的正常酵母细胞无荧光,说明罗丹明123进入细胞的线粒体基质后荧光消失[图4(D)].当酵母被10 μL/mL精油处理后,发射出较弱的黄绿色荧光[图4(E)],说明部分细胞的线粒体膜被破坏,罗丹明123从线粒体基质中释放.当精油浓度增加到20 μL/mL时,发射出强的黄绿色荧光[图4(F)],说明几乎所有酵母的线粒体膜均被破坏,罗丹明123从线粒体基质中释放出来.实验结果表明酵母的线粒体是福白菊精油抗真菌作用的靶点之一.Guimarães等[23]和Xu等[24]认为精油中亲脂性萜类和萜烯类化合物快速插入细胞膜、线粒体膜的膜系统后,由于其疏水性引起膜渗透性增加,破坏膜结构,使膜内容物泄漏,导致菌体死亡.福白菊精油中含有大量的萜类和萜烯类化合物,这可能是其破坏真菌细胞膜、线粒体的原因.

Fig.4 Effect of Fubaiju essential oil on mitochondrial membrane of S.cerevisiae according to rhodamine 123 labeling

Fig.5 DNA destruction assay by Fubaiju essential oil according to EB labeling
2.2.5 基于EB标记法的福白菊精油对酵母DNA的破坏利用EB标记时,福白菊精油对酵母DNA的破坏作用如图5所示.泳道1和泳道2分别表示DNA marker和环形质粒pCAMBIA1303,泳道3是环形质粒pCAMBIA1303被Bam-HI内切酶酶切后的线形质粒,泳道4~7为环形质粒pCAMBIA1303被福白菊精油处理过的电泳结果,泳道4~7是平行样.经福白菊精油处理后,环形pCAMBIA1303形成大小不一的片段.有的片段在泳道中移动得快,说明环形pCAMBIA130可能被精油破坏成线性片段;有的片段在泳道中移动得慢,说明环形pCAMBIA130可能被精油改变了结构,使其在电泳作用下移动得慢.这些结果表明,DNA可能是福白菊精油作用靶点之一.Chung等[16]发现韩茵陈(Artemisia iwayomogi)精油的主要成分Vulgarone B与PBR322质粒结合后会改变其结构,使其比原PBR322质粒更大,电泳作用下移动得慢.福白菊精油中含有类似于Vulgarone B的物质[25],但精油与DNA分子之间如何相互作用还有待于进一步研究.
3 结 论
福白菊精油的抗真菌机理是通过多途径、多靶点实现的.它不仅能破坏细胞膜,使细胞内含物外泄;还能够穿过细胞膜后破坏线粒体膜,破坏DNA,最终导致细胞死亡.不同于抗生素的抗菌作用位点单一而容易产生耐药性,福白菊精油的多重作用机制可能使真菌不易对其产生耐药性,这为植物精油作为天然抗真菌药物的开发提供了新的思路.
