聚丙烯酸树脂蒙脱石镶嵌盐酸倍他洛尔纳米粒滴眼液的眼表代谢及体外刺激性评价
2021-12-14许慧慧韩鑫玥刘朔赵雅文李华梅刘晗雨杨帆陈燕忠潘育方侯冬枝
许慧慧,韩鑫玥,刘朔,赵雅文,李华梅,刘晗雨,杨帆,陈燕忠,潘育方,侯冬枝
(广东药科大学药学院/广东省局部精准递药制剂工程技术研究中心/广东省药物新剂型重点实验室,广东广州 510006)
《医宗金鉴·眼科心法要诀》和《证治准绳·杂病·七窍门》中记载:青光眼属“五风内障”中的青风内障,其症状为“痰湿所致,火郁、忧思、忿怒之过”[1]。现代医学认为青光眼是一组涉及视神经及其相关组织的疾病,其特征是视野逐渐丧失、视神经头典型改变[2-4]。眼压是青光眼诊断的重要参数,也是表征青光眼病程发展的主要危险因素,降低眼压是唯一被证实可有效减缓病程的重要手段。目前,市面上有大量的抗青光眼药物,主要包括降眼压药物(前列腺素衍生物、碳酸酐酶抑制剂、受体拮抗剂、肾上腺素能激动剂、副交感神经药物和高渗剂)和视神经保护药物(钙离子通道阻滞剂、中药制剂、神经干细胞及神经营养因子等)[5-8]。
盐酸倍他洛尔(BH)不仅有降压作用,还具有视神经保护功能。本课题组前期试验研究表明,将药物BH 与黏土矿物蒙脱石(Mt)通过酸化嵌合形成复合物,可以调控药物的释放速率[9]。聚丙烯酸树脂RS(ED RS)和RL(ED RL)因季铵盐基团含量不同导致其溶胀性和亲水性发生改变,通常可在液体的渗入作用下“滤出”亲水孔道,从而减缓药物释放。本研究采用溶剂挥发法制备聚丙烯酸树脂载药蒙脱石纳米粒(ED-Mt-BH NPs),并制备成滴眼液,进一步考察其制剂学性质、释药性能,初步研究其生物相容性及刺激性,为治疗青光眼纳米递药系统提供新的研究思路和实验基础。
1 仪器与材料
1.1 仪器与试药
BSA124S-CW 万分之一电子天平(赛多利斯科学仪器(北京)有限公司);9SK8200LHC 超声波清洗器(上海科导超声仪器有限公司);RCT Basic 基础型数显磁力搅拌器(德国艾卡公司);JY 92-II 超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);THZ-82气浴恒温振荡器(上海宵汉实业发展有限公司);UV-1800PC 紫外可见分光光度计(上海美谱达仪器有限公司);OSMOMAT 3000 basic 冰点渗透压仪(德国Gonotec GmbH 公司);Delsa Nano C激光衍射粒度分析仪(美国贝克曼库尔特科技仪器有限公司);FEI Talos F200S 透射电子显微镜(赛默飞世尔科技公司)。
聚丙烯酸树脂RS(ED RS)和聚丙烯酸树脂(ED RL),纯度≥97%,上海昌为医药辅料技术有限公司;盐酸倍他洛尔(BH,纯度99.5%,武汉远成共创科技有限公司);DMEM/F12 培养基(美国赛默飞世尔公司);噻唑蓝(MTT,美国Amresco公司)。
1.2 动物及细胞
普通级的新西兰兔,体质量2.0~2.5 kg,雌雄不限。动物合格证号:SCⅩK(粤)2016-0041。HCE-T细胞由北京北纳创联生物技术研究院商城分院提供(校内赠送)。
2 方法与结果
2.1 ED-Mt-BH NPs混悬滴眼液的制备
采用改良O/W型乳化溶剂挥发法制备ED-Mt-BH NPs 滴眼液[10]:用泊洛沙姆188 的去离子水溶液20 mL 为外水相,将ED RL 425.6 mg、ED RS 22.4 mg、BH 56 mg 和Mt-BH 10 mg 于5 mL 无水乙醇中超声溶解分散为油相;将油相快速液下注入外水相中,迅速置于冰水浴中超声,随后置于室温中以800 r/min 继续搅拌2~3 h,得到规格为2.8 mg/mL的ED-Mt-BH NPs 混悬滴眼液。将ED-Mt-BH NPs滴眼液(甘露醇为冻干保护剂,-60 ℃下恒压预冻8 h,升华干燥)进行冻干后保存备用。
2.2 ED-Mt-BH NPs混悬滴眼液的制剂学性质考察
2.2.1 形态学 取适量稀释适当倍数后的ED-Mt-BH NPs 混悬滴眼液,滴加到铜网上,自然晾干后,继续滴加质量分数2%的磷钨酸溶液进行负染,自然晾干后采用透射电子显微镜(200 kV 加速电压、低真空度)观察ED-Mt-BH NPs的形态并摄影记录,结果见图1。可见,ED-Mt-BH NPs 混悬滴眼液呈淡蓝色,经激光光束垂直照射后出现胶粒分散系统的丁达尔现象(图1C),TEM 镜下的粒子大小较均匀(图1A),形态圆整(图1B)。

图1 ED-Mt-BH NPs(A)、单个ED-Mt-BH NPs(B)的TEM形貌图与ED-Mt-BH NPs混悬液(C)外观图Figure 1 TEM images of ED-Mt-BH NPs(A)and single ED-Mt-BH NPs(B),diagram of ED-Mt-BH NPs suspension(C)
2.2.2 pH 值和渗透压 沙氏磷酸缓冲液的配制:0.943 8%无水Na2HPO4(碱性溶液)和0.8%无水NaH2PO4(酸性溶液),不同比例混合后可得到pH 范围为5.19~8.04 的溶液。取2 mL 沙氏磷酸缓冲液(按1∶1比例混合碱性溶液和酸性溶液)复溶纳米粒冻干粉末,充分摇匀后备用。将ED-Mt-BH NPs混悬滴眼液用pH计测定pH值。另外取50 μL ED-Mt-BH NPs 滴眼液于渗透压仪下测量渗透压。重复试验3次,结果见表1。
2.2.3 包封率和载药量 精密移取0.5 mL ED-Mt-BH NPs 混悬滴眼液于10 mL 容量瓶中并用甲醇定容,涡旋4 min 后超声2 h 破乳,经0.22 μm 微孔滤膜滤过,紫外可见分光光度计273 nm 下测定吸光度值代入标准曲线(Y=4.141X-0.006,R2=0.998 6)中计算BH 的全药量c0。精密移取4 mL ED-Mt-BH NPs 混悬滴眼液于透析袋中,扎紧透析袋两端后放置于提前预热的100 mL 人工泪液介质中,空气浴恒温(34 ℃)振荡(转速为120 r/min)0.5 h 后取出,经0.22 μm微孔滤膜滤过,紫外可见分光光度计273 nm下测定吸光度值代入标准曲线(Y=3.876X+0.003,R2=0.999 8)中计算游离BH 的质量浓度c。根据以下公式分别算出包封率和载药量:
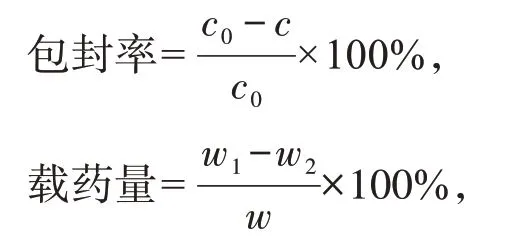
式中:c0为纳米粒的全药量(mg/mL),c为纳米粒混悬液中游离药物质量浓度(mg/mL),w1为加入药物的质量(mg),w2为纳米粒中游离药物质量(mg);w为纳米粒总质量(mg)。结果见表1。
表1 ED-Mt-BH NPs的理化性质Table 1 Physicochemical properties of ED-Mt-BH NPs(,n=3)

表1 ED-Mt-BH NPs的理化性质Table 1 Physicochemical properties of ED-Mt-BH NPs(,n=3)
可见,ED-Mt-BH NPs混悬液的pH值、渗透压均符合2020年版《中国药典》眼用制剂通则的相关要求。所制纳米粒滴眼液Zeta电位为(22.24±1.53)mV,这可能是由于含季铵盐的聚丙烯酸树脂聚合物载体和阳离子型药物BH均提供了正电荷。
2.2.4 体外释放试验 采用动态透析法进行体外释放度测试,按处方配制好人工泪液后,将透析袋(截留相对分子质量:8 000~14 000)浸泡于人工泪液中放置过夜处理。分别精密量取BH 溶液、ED-Mt-BH NPs 混悬滴眼液液4 mL 于透析袋中并扎紧两端避免漏液,浸泡于100 mL 人工泪液。整体置于34 ℃恒温的空气浴恒温振荡仪中,转速设为120 r/min。于特定的时间间隔内精密移取5 mL介质,同时补给同样体积新配制的介质。经0.22 μm 微孔滤膜滤过,弃去初滤液,紫外可见分光光度法273 nm 下测定续滤液的吸光度值。按以下公式计算累积释放率:

式中:W是累积释放率;Cn为第n个取样时间点介质中药物浓度;V是释放介质的总体积;Ci是第i个取样时间点时介质中药物浓度;Vi是第i个取样时间点的取样体积,m为4 mL 纳米粒中所含的总的药量。结果见图2。

图2 ED-Mt-BH NPs混悬滴眼液和BH溶液的体外累积释放曲线Fiugre 2 In vitro cumulative release curves of ED-Mt-BH NPs suspension and BH solution
可见,ED-Mt-BH NPs 混悬液前2 h 累积释放率较快,达到65.2%,呈现出快速释放现象;随着时间的推移,释放率逐渐变小,呈现缓慢释放现象,10 h时累积释放率达到87.7%。药物从颗粒中释放主要有3种途径:(1)从颗粒表面释放;(2)经载体基体溶胀释放;(3)由于聚合物被侵蚀释放。本研究采用的载体材料聚丙烯酸树脂在水中可溶胀形成孔道,药物通过亲水孔道扩散释放,同时在本课题组前期研究中证明层状结构的载盐酸倍他洛尔蒙脱石可与透析介质中阳离子发生阳离子交换作用从而使药物缓慢释放,进而调节药物的释放速度[11-12],推测聚丙烯酸树脂和蒙脱石的联合应用可以双重控制药物释放。将ED-Mt-BH NPs混悬液的累积释放率(Q)对时间(t)分别进行零级方程、一级方程、Higuchi方程、Ritger-Pepppas方程和Weibull方程拟合,结果见表2。可见,ED-Mt-BH NPs 混悬滴眼液在人工泪液介质中的释放机制与Weibull释药模型较接近。

表2 ED-Mt-BH NPs混悬滴眼液体外释放拟合结果Table 2 Fitting results of in vitro release of ED-Mt-BH NPs suspension eye drops
2.3 ED-Mt-BH NPs混悬滴眼液的眼表代谢动力学
2.3.1 色谱条件 色谱柱:Inertsil ODS C18色谱柱(4.6 mm×150 mm,5 μm);检测波长:273 nm;流动相:乙腈-0.2%三乙胺(体积比3∶7,pH=3);流速:1.0mL/min;进样量:20 μL。
2.3.2 样品处理 将3 cm×8 cm的滤纸条置于1.5 mL离心管内,取样前精密称其总质量G0。取样后立即称定润湿有泪液的滤纸条与离心管的总质量G1。氮气流下吹干含有泪液的滤纸条后加入10 μg/mL的内标物尼泊金乙酯(Ethyl paraben,EP)70 μL,吹干后加入70 μL 甲醇复溶,涡旋5 min,超声萃取处理20 min,15 000 r/min离心20 min,进样20 μL。
2.3.3 线性关系 将系列浓度的BH 标准溶液20 μL加入到含空白泪液滤纸条的离心管中,吹干后加入20 μL EP(35 μg/mL),吹干后再加入70 μL 甲醇复溶,使得处理后样品中的药物终质量浓度为1、10、40、120、300 μg/mL,涡旋5 min,超声20 min,15 000 r/min低温离心20 min,小心吸取上清液20 μL进样。记录待测药物BH 的峰面积和内标物EP 的峰面积。以质量浓度为横坐标、峰面积比为纵坐标得线性方程:Y=0.006 87X+0.006 8,R2=0.999 0。
2.3.4 泪液消除试验 选取健康无眼疾的新西兰兔,左眼给生理盐水做空白对照,右眼给各受试制剂。左右眼各给药50 μL。在特定时间点,拉开兔眼上眼睑,轻轻放入滤纸条并轻压鼻泪管处,1 min 后取出立即精密称量,通过增重量确定取样量的多少。所有样品于-20 ℃下保存备用,按“2.3.2”项方法处理,按“2.3.1”项测定。结果见图3。
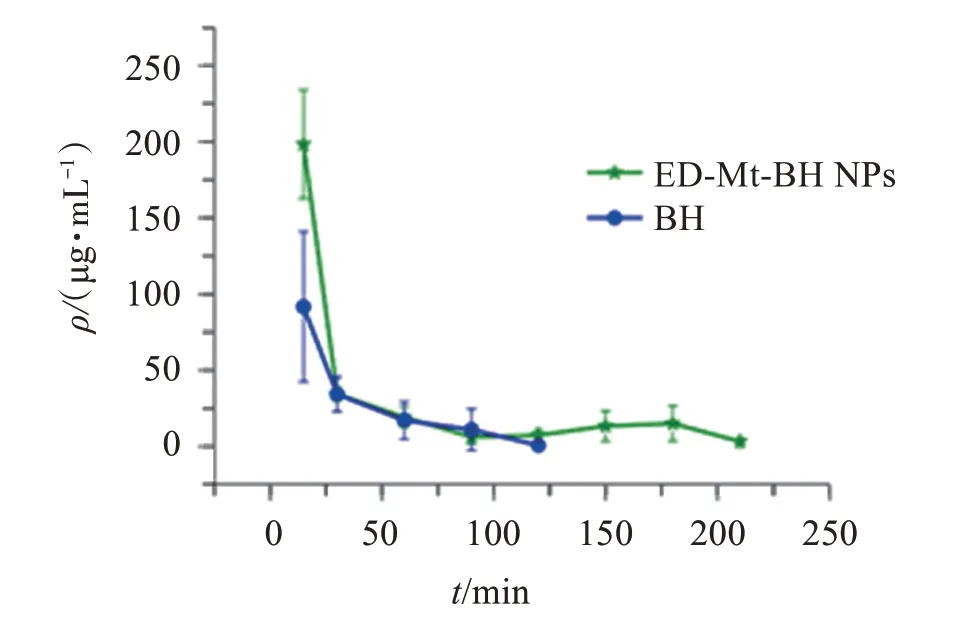
图3 BH 溶液和ED-Mt-BH NPs 混悬滴眼液兔眼局部给药50 μL后兔泪液中的药-时曲线Figure 3 The concentration-time curves of the drug in tears after topical administration of 50 μL of BH solution and ED-Mt-BH NPs suspension to the rabbit eyes(n=3)
表3列出了由DAS 3.1.1(北京邦茨公司)的非房室分析得出的平均药动学参数。可见,ED-Mt-BH NPs混悬滴眼液的相对生物利用度和平均滞留时间分别是BH 溶液的1.88倍和1.54倍,表明ED-Mt-BH NPs滴眼液可明显延长药物在眼表的滞留。
表3 BH溶液和ED-Mt-BH NPs滴眼液的主要药动学参数Table 3 The pharmacokinetic parameters of BH solution and ED-Mt-BH NPs suspension(,n=3)
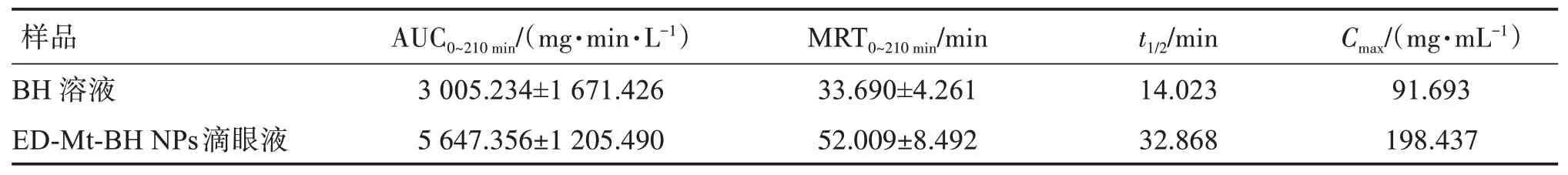
表3 BH溶液和ED-Mt-BH NPs滴眼液的主要药动学参数Table 3 The pharmacokinetic parameters of BH solution and ED-Mt-BH NPs suspension(,n=3)
2.4 ED-Mt-BH NPs混悬滴眼液的刺激性试验
2.4.1 溶血试验 取健康家兔耳缘静脉血液样品2 mL,轻轻搅拌取出纤维蛋白,加入PBS溶液2 mL后离心5 min,弃去上清液,继续加入PBS 溶液10 mL 离心5 min,弃去上清液并重复上述操作4~5 次直至上清液基本无明显红色。将所得的红细胞用PBS 溶液稀释成体积分数为2%的红细胞混悬液备用。
分别向0.2 mL 红细胞溶液加入PBS 溶液(阴性对照组)、去离子水(阳性对照组)、ED-Mt-BH NPs(待测样品组),于37 ℃下孵育4 h 后离心5 min,观察上清液颜色。分别取各组的上清液100 μL 于96孔板中,利用酶标仪(λ=570 nm)测定其吸光度并计算溶血率,结果显示ED-Mt-BH NPs∶PBS 稀释比为1∶7、4∶4、8∶0 时,溶血率分别为1.47%、2.35%和3.82%。溶血率与药物浓度存在一定的线性关系,溶血率小于5%,表明所制备的ED-Mt-BH NPs 对兔红细胞几乎无溶血作用。
过敏性、溶血性是指药物制剂经皮肤、黏膜、血管等非口服途径给药,对用药局部产生的毒性或对全身产生的毒性,是临床前安全性评价的重要组成部分[13]。如图4 所示:阴性对照组红细胞下沉且上清液无色透明,未发生溶血现象;阳性对照组呈现出红色澄明状,管底仅有少量红细胞残留,明显发生溶血;ED-Mt-BH NPs 样品组各管均红细胞下沉,上清液无色透明,未出现溶血或凝聚现象。
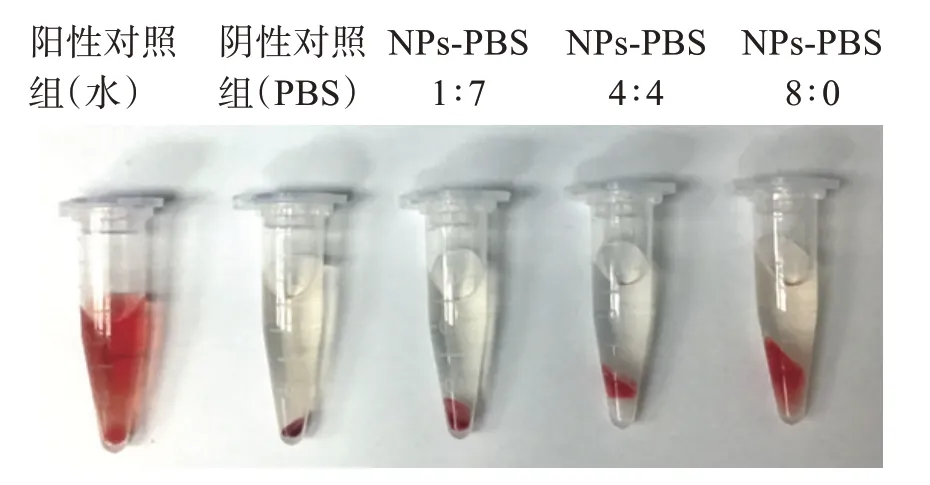
图4 各受试组溶血情况Figure 4 The hemolysis of each test group
2.4.2 细胞毒性试验[14-15]将生长良好的HCE-T 细胞以1×104/孔接种于含有DMEM/F12 培养基96 孔板,将96孔板放在37 ℃、5%CO2的培养箱培养24 h,更换培养基。加入不同梯度浓度的BH溶液、ED-Mt-BH NPs 滴眼液和Blank-NPs 滴眼液,同时用相同体积的培养基做阴性对照。在原培养箱中继续培养0.5 h 和2 h 后每孔加入100 μL MTT(5 mg/mL)孵育4 h,最后向每个孔滴加100 μL 二甲基亚砜,置于恒温振荡仪往复振荡直至所有蓝紫色晶体甲瓒溶解。用酶标仪(λ=570 nm)检测样本孔的吸光度值(A)并计算生长抑制率(%),结果见图5。可见,暴露时间为0.5 h和2 h时,各制剂的细胞毒性均随着给药剂量的增加而增大;但Blank-NPs溶液的细胞毒性始终低于BH 溶液和包裹药物后的ED-Mt-BH NPs,且差异具有统计学意义(P<0.05),表明ED-Mt-BH NPs滴眼液可减轻BH 药物固有的细胞毒性,侧面说明纳米粒可将药物BH有效包裹于颗粒中。

图5 BH溶液、Blank-NPs溶液和ED-Mt-BH NPs滴眼液分别暴露0.5 h(A)和2 h(B)时的细胞毒性Figure 5 Cytotoxicity of BH solution,Blank-NPs solution and ED-Mt-BH NPs suspension exposed to 0.5 h(A)and 2 h(B)
3 讨论
基于青光眼是世界上第二大致盲性眼部疾病与传统眼用制剂普遍具有较低生物利用度的现状,一种新兴眼部给药系统即眼部纳米粒制剂被设计开发,该系统具有改善颗粒与黏液相互作用,增加药物渗透角膜能力,增加药物在眼内组织聚集,延长药物滞留时间并减少临床用药频率,提高患者依从性等优势。
本研究制备了聚丙烯酸树脂载药蒙脱石纳米粒(ED-Mt-BH NPs),并对其理化性质、载药量和包封率、释药能力进行了研究,结果表明ED-Mt-BH NPs 的理化性质符合眼用制剂的要求标准,可用于眼部治疗,且具有较高的包封率和载药量。通过体外释放试验结果可知,将BH 制备成ED-Mt-BH NPs 可降低药物释放速率,延长药物释放时间。
目前,国内外常用的体外眼部刺激性试验分别有牛眼角膜渗透性试验和鸡胚尿囊膜试验[16]。由于每个方法均有局限性和优势,因此本研究采用组合策略,可较全面评价眼用辅料的安全性。红细胞溶血试验已经被纳入欧洲委员会英国内务府开展的替代家兔眼刺激性试验之一[17]。本研究通过红细胞溶血试验考察ED-Mt-BH NPs 的毒性,结果表明相比于去离子水,ED-Mt-BH NPs 几乎无溶血作用,且随着ED-Mt-BH NPs 与PBS 的稀释比增加,溶血率增加,这可能是由于纳米粒中游离药物分子引起的刺激性;不同稀释比的ED-Mt-BH NPs-PBS稀释液的溶血度均小于去离子水的溶血度,表明ED-Mt-BH NPs 具有较小的毒性。对于青光眼这一类慢性疾病,眼用制剂应长期给药,有研究表明纳米制剂因呈正电性、比表面积大和表面反应活性强等特点可能存在潜在毒性[18],但是对局部眼用制剂存在复杂性,如纳米粒与眼组织的相互作用、药物在眼部分布情况及其代谢等相关机制研究仍不完善,后续将进一步考察ED-Mt-BH NPs的长期安全性。
通过试验手段诱导动物高眼压是研究青光眼药理药效的重要手段,目前研究中的动物造模使用最多的是兔子和大鼠[19]。根据青光眼发病机制,造模方法常分为3 大类:破坏小梁结构(如高渗盐水法[20]、透明质酸法[21]、激光诱导法[22])、增加上巩膜静脉窦压力(如烧灼上巩膜静脉法)和阻塞房角流出通道(如α-糜蛋白酶法、甲基纤维素法、皮质类固醇法、复方卡波姆法和血细胞法)。后续本课题组将继续研究构建合适的青光眼动物模型以观察ED-Mt-BH NPs 的降眼压疗效。
