基于网络药理学和分子对接莪术醇抗肝纤维化作用机制的分析
2021-12-13郑洋钟芳菲王佳曦易莹辉李佳径朱思艺何佳禧赵颖杰王佳慧赵铁建
郑洋,钟芳菲,王佳曦,易莹辉,李佳径,朱思艺,何佳禧,赵颖杰,王佳慧,赵铁建
(1.广西中医药大学 赛恩斯新医药学院, 广西 南宁 530222;2.广西中医药大学 基础医学院, 广西 南宁 530222)
0 引言
肝纤维化是慢性或反复性肝损伤的最终共同结局,以细胞外基质(extracellular matrix, ECM)合成和分解失衡,大量沉积为主要特征[1]。炎症、慢性病毒性肝炎和肝损伤被认为是肝纤维化形成的主要病因,晚期慢性纤维化会发展成为肝硬化,常伴有结构异常和功能衰竭的并发症的发生[2-3]。活化的肝星状细胞(HSC)是ECM的主要来源,治疗肝纤维化的药物有可能被活化的HSC所吸收,从而降低治疗效果和引发一系列的并发症[4],尽管肝纤维化是常见的和严重的疾病,但目前临床上治疗肝纤维化的药物,大都作用机制没有完全被验证,所以也没有被临床广泛使用[5]。
近年来,中国传统中药对肝纤维化的治疗取得了长足的发展。因此,越来越多的研究聚焦中草药抗肝纤维化的作用[6]。莪术最早记载于《药性论》,是莪术植物干燥的根茎部分,具有破血行气、消积止痛等作用[7]。现代药理表明,莪术具有抗癌、抗血栓、抗肝纤维化、降血脂等作用[8]。莪术醇作为莪术的主要活性成分,课题组前期研究[9]表明,莪术醇有抗肝纤维的作用,但其抗肝纤维化的分子机制未被揭示。
网络药理学是整合了系统生物学、多向药理学、网络分析等学科的一门新兴学科。随着分子生物学的发展,中药的研究已经进入细胞和基因转录水平,但整体研究仍然处于较浅的水平。网络药理学在整体水平上研究药物和疾病之间的关系,从药物、靶点与疾病之间的相互作用的整体性和系统性出发,揭示中药多成分-多靶点的作用关系,其研究的整体性与中药的多成分、多靶点、多途径的特点高度吻合,已被广泛用于中药活性成分的预测以及中药作用机制的研究方法[10]。使用网络药理学的分析方法和实验验证阐明莪术醇抗肝纤维化的分子作用机制。
1 材料和方法
1.1 莪术醇化学成分靶点预测
使用中药系统药理学分析平台(TCMSP)(http:ibts.hkbu.edu.hk/LSP/tcmsp.php)收集莪术醇药效成分信息, 保存为mol2格式文件,然后将其上传PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)。基于反向药效团匹配法, 选择药物的药效团模效团模型, 设置最终产生300个蛋白构象,得到与化合物相关的靶点名称、基因名称、Uniprot ID等结果。借助Uniprot(https://www.uniprot.org/),对化合物预测产生的靶点进行筛检与检查, 只保留物种为“Homo sapiens”的靶点。
1.2 肝纤维化疾病靶点数据库的构建
肝纤维化相关的靶点是从OMIM( https://omim.org/)、CTD (http://ctd.mdibl.org/) 、GeneCards (https://www.genecards.org/)数据库检索肝纤维化相关靶点, 筛选并删除重复靶点基因, 构建肝纤维化靶点数据库。
1.3 网络构建和关键靶点的生物信息学分析
使用Cytoscape3.6.0和蛋白互作数据库对莪术醇作用靶点相互作用关系进行可视化处理,采用Venny2.1对莪术醇作用靶点与肝纤维化治疗靶点进行交互处理,得到莪术醇治疗肝纤维化的重要靶点,然后使用基因本体论(GO)注释数据库网站(http://www.geneontology.org),京都基因与基因组百科全书(KEGG)路径富集分析(http://www.genome.jp/kegg/)对这些靶点进行可视化和生物信息学分析。
1.4 分子对接验证
使用 DiscoverStudio 3.0和Autodock Vina进行分子对接操作,将莪术醇与其抗肝纤维化靶点互作关系中度值排名前三的关键靶蛋白进行分子对接。从ZINC数据库(http://zinc15.docking.org)中下载化合物结构,使用AutoDock软件进行加氢、加电子等操作。从PDB数据(https://www.rcsb.org/)下载相关蛋白的3D结构,运用DiscoverStudio 3.0软件对蛋白质进行去水、加氢等操作后,利用AutoDock vina进行分子对接。
2 结果
2.1 莪术醇作用靶点和肝纤维化靶点的确认
使用Pubchem数据库确认莪术醇的结构,通过PharmMapper数据库获得了莪术醇的作用靶点300个,借助Uniprot数据库,对化合物预测产生的靶点进行筛检与检查,剔除重复、非人源与不规范的靶点,最终只得到了152个靶点。借助OMIM、Genecards、CTD数据库,以“liver fibrosis”为关键词,根据相关度以及去除重复靶点,共获得肝纤维化疾病相关靶点617个。
2.2 关键靶点的网络构建与分析
莪术醇作用靶点与肝纤维化相关靶点韦恩图如图1所示。从图1可见,对莪术醇作用靶点和肝纤维化靶点进行交互处理,得到27个共同靶点;利用STRING数据库,进一步构建了莪术醇作用靶点与交互靶点的网络图如图2所示。从图2可见,27个交互靶点包括PTGS1、PTGS2、MAPK8、NOS3、CCNA2等。PTGS(prostaglandin-endoperoxide synthase)是调节免疫、炎症和细胞增殖的关键酶;MAPK8(mitogen-activated protein kinase8)是细胞增殖、凋亡的关键酶;NOS3(nitric oxide synthase)是调控NO生成的关键酶;CCNA2(Cyclin-A2)是调控细胞周期的关键酶。并对这27个靶点进行网络拓扑学分析,得出莪术醇抗肝纤维化作用靶点的相互关系如图3所示。拓扑学分析结果见表1(仅列度值前10靶点)。这些分析结果表明,莪术醇抗肝纤维化的作用是多方面的。

图1 莪术醇作用靶点与肝纤维化相关靶点韦恩图

三角形是莪术醇抗肝纤维相关靶点

图3 莪术醇抗肝纤维化作用靶点的相互关系

表1 莪术醇抗肝纤维化作用靶点的拓扑学分析结果(度值排名前10)
2.3 关键靶点途径和功能的富集分析
从莪术醇152个作用靶点中收集了27个抗肝纤维化的作用靶点。为了确定相关的途径和功能,对这些可能的靶点进行了通路富集和GO功能分析,莪术醇抗肝纤维化靶点的KEGG分析气泡图如图4所示。从图4可见,除神经营养素信号通路和AMPK信号通路以及代谢通路外,RAS、TNF、精氨酸合成和胰岛素抵抗信号通路均明显富集。此外,功能分析数据显示,这些预测的靶点调节细胞增殖,炎症反应和血管生长,具体富集结果见表2。因此,这些数据提供了莪术醇抗肝纤维化的证据。

图4 莪术醇抗肝纤维化靶点的KEGG分析气泡图
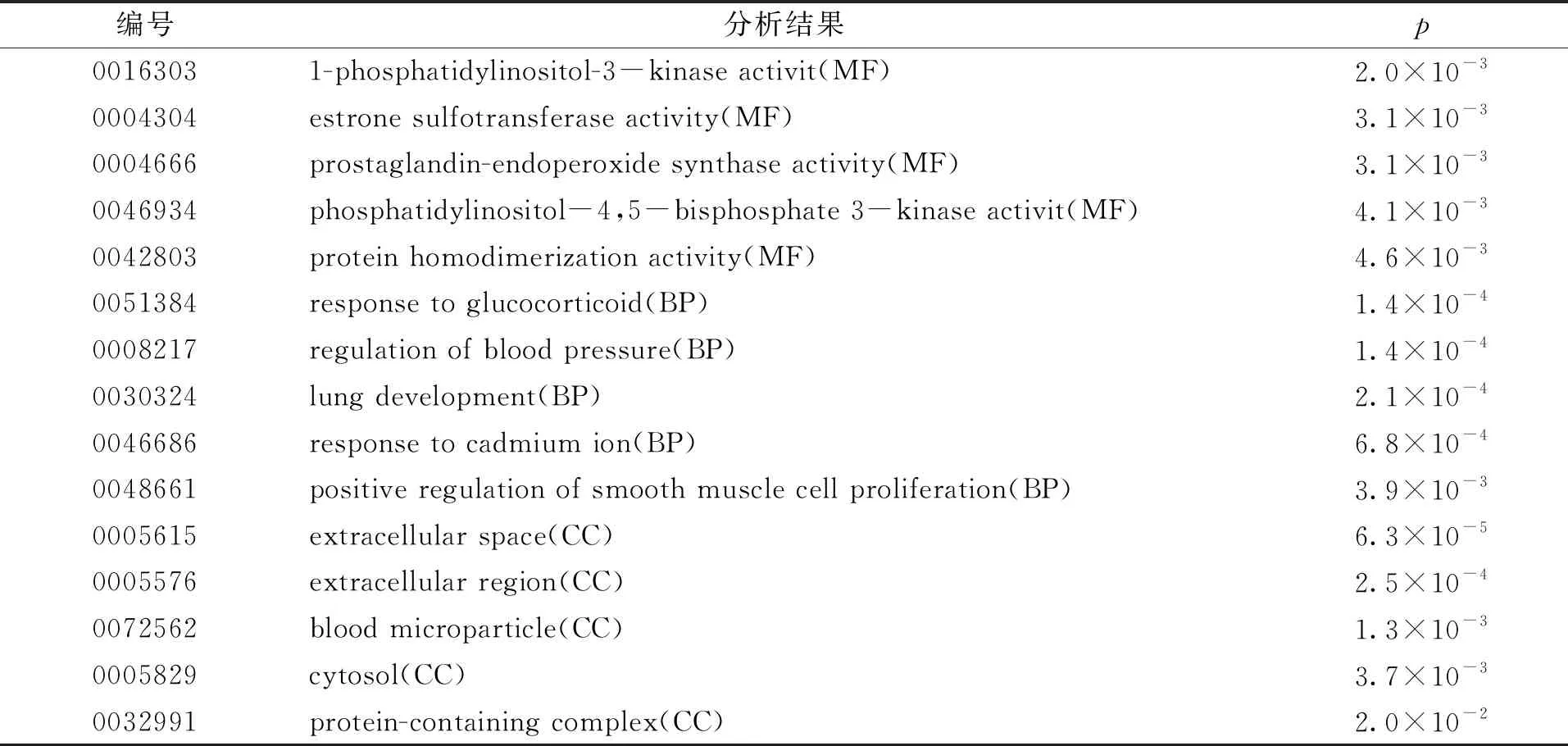
表2 莪术醇对肝纤维化作用靶点的GO分析
2.4 分子对接结果
ALB、NOS3以及MAPK8三个度值排名靠前的靶点与莪术醇均有较好的相互作用力。ALB与莪术醇亲和性为-6.5 kcal/moL,莪术醇通过ASN64残基与ALB发生氢键相互作用,通过LEU67和TYR65以及VAL272发生范德华力相互作用;NOS3与莪术醇亲和性为-7.6 kcal/moL,莪术醇通过CYS184残基与NOS3发生氢键相互作用,通过SER354、SER226、TRP356、GLY186以及GLY355发生范德华力相互作用;MAPK8与莪术醇亲和性为-6.6 kcal/moL,莪术醇通过GLY171残基与MAPK8发生氢键相互作用,通过LYS55、GLN37、ARG72、GLU73、ASP169和LEU172发生范德华力相互作用,分子对接2D和3D结果如图5至图7所示。

图5 ALB与莪术醇结合模式与相互作用力

图6 NOS3与莪术醇结合模式与相互作用力

图7 MAPK8与莪术醇结合模式与相互作用力
3 讨论
肝纤维化是一种慢性进展性疾病,使得肝脏结构破坏和细胞外基质的沉积,这是大多数慢性肝病的共同病理过程[11]。目前,对肝纤维化的治疗方法主要有:①减少对肝脏的慢性刺激因素;②阻断肌成纤维细胞的激活;③促进活化星状细胞的凋亡或逆转;④使得沉积的细胞外基质讲解[12]。然而,这些治疗方法的靶点,往往比较单一,没有考虑到肝纤维化疾病的复杂性,所以其治疗效果达不到预期,因此需要从整体或者多途径的角度去寻找肝纤维化的治疗方法。本研究网络药理学的方法对莪术醇的作用靶点进行了分析,发现了152作用的靶点。主要包括PTGS、MAPK8、NOS3、CCNA2、ALB等,其通过调控细胞增殖、炎症、血管功能等方面参与肝纤维化的过程[13-17]。此外,对推测靶点的通路和功能富集分析表明,莪术醇主要调控TNF、RAS信号通路,这些信号通路都参与了纤维化的发生[18-19]。TNF信号通路关键分子TNF-α 可以通过介导脂类产生促进炎症发展,并可使血管内皮细胞收缩,引起缺血性肝坏死,也可以诱导自由基的产生导致脂质过氧化的发生,可以促进细胞增殖分化,引起细胞外基质的沉积,从而形成肝纤化[20]。Ras蛋白是一类小分子的三磷酸鸟苷 (GTP) 酶蛋白,GTP与GDP两者结合Ras蛋白时分别代表了Ras蛋白的激活和非激活状态,Ras蛋白参与了细胞增殖与分化的过程,是MAPK信号通路的主要调节分子,其被激活后调控细胞核内信号转导,激活转录因子促进基因表达,从而调节肝纤维化的发生发展[21]。为了说明本次网络药理学预测分子机制的可靠性,使用分子对接技术对莪术醇抗肝纤维化相关靶点中度值排名靠前的MAPK8、NOS3、ALB靶点进行了对接测试,发现其与莪术醇有较好的结合活力, 验证了网络药理学预测靶点的可靠性。
MAPK在细胞炎症反应、细胞凋亡和免疫调节等过程中起重要作用[22]。转化生长因子-β(transforming growth factor beta, TGF-β)是肝纤维化形成中最主要的促纤维化细胞因子, 其可通过TGF-β/Smad通路促进HF的形成[23]。研究[24]显示,它既可促进细胞外基质的合成, 又可抑制其降解, 在HSC活化过程中起着重要作用。研究[25]发现, TGF-β也可以诱导MAPK信号传导通路的活化。研究[26]发现, 用阻断剂 SB203580阻断MAPK可以降低静息HSC的α-SMA蛋白表达, 改变肝纤维化的进程。研究[27]显示, 炎症刺激可激活MAPK,而 P38 MAPK也可以调节TNF、IL-1和IL-6等致炎因子以及IL-12等抗炎因子的生成, 影响生物体内致炎与抗炎因素的平衡, 从而决定炎症反应的进程。MAPK8是MAPK信号转导的关键信号分子,其参与细胞增殖、细胞分化和细胞凋亡等多个生理过程,其可以通过调控肝星状细胞的增殖活化与肝细胞的凋亡参与肝纤维化的发生发展[28]。肝脏血管新生与肝纤维化相伴而行,是肝纤维化重要的病理形态特征,NOS3是合成NO的关键酶,NO可以调节肝内血管舒张,对肝窦血流的调节起重要作用,当肝脏受到某些毒物或药物的损伤时,NOS3合成受阻,导致NO的合成减少,可以导致肝内微循环障碍[29]。NO可以激活平滑肌细胞上的鸟苷酸环化酶(guanylate cyclase,GC),催化产生环磷酸鸟苷(cyclic guanosine monophosphate,cGMP),介导平滑肌舒张,从而导致血管舒张[30]。研究[31-32]表明,eNOS-NO-cGMP通路在肝窦内皮细胞窗口的形成过程中发挥十分重要的作用,肝窦内皮细胞的窗孔结构又是肝脏微循环正常的重要保障,说明NOS3通过介导NO的生成参与了肝内血管新生调控过程。ALB是只在肝脏合成的蛋白,参与了抗炎等多个生理过程,其含量的高低反映了肝脏的功能状态,其含量维持在正常水平有助于抑制肝纤维化的发展[33]。
网络分析数据表明,莪术醇通过对特定靶点和信号通路的作用,呈现抗肝纤维化的作用,本研究根据“多组分、多靶点、多路径”的模式为肝纤维化患者提供了新的治疗方案,但莪术醇作用的确切靶点有待进一步研究。
