基于胎儿有核红细胞建立遗传性耳聋无创产前诊断的新方法
2021-12-10张娜蒋刈宋立强鲍文琪高搏袁永一高志英游艳琴侯伟张弢杨贵和王明明
张娜蒋刈宋立强鲍文琪高搏袁永一高志英游艳琴侯伟张弢杨贵和王明明*
1 北京贝康医学检验所有限公司(北京 101111)
2 上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海交通大学医学院耳科学研究所,上海市耳鼻疾病转化医学重点实验室(上海 200011)
3 解放军总医院耳鼻咽喉头颈外科解放军总医院耳聋病分子诊断中心(北京 100853)
4 解放军总医院妇产科(北京 100853)
5 南京大学现代工程与应用科学学院(南京 210093)
产前诊断能够对胚胎或胎儿是否患有某些遗传病或先天畸形在出生前做出准确诊断,是预防和控制出生缺陷的重要手段。耳聋是常见的出生缺陷,超过60%的先天性耳聋是遗传因素导致的,分子诊断技术是目前检测遗传性耳聋的主要方法[1]。目前,临床上获取胎儿细胞的金标准是羊膜腔穿刺和宫腔绒毛取样。这些方法的诊断结果虽然准确可靠,但对孕妇和胎儿有宫内感染和流产发生的风险[2]。孕妇外周血中的胎儿有核红细胞(Fetal Nu‐cleated Red Blood Cells,FNRBCs)含有胎儿全部的基因组,被认为是最理想的胎儿遗传物质来源细胞[3]。但是,20ml孕妇外周血中约含有0~20个胎儿细胞[4],因此要获得足够数量的FNRBCs用于分子诊断必须进行富集分离,而体外进行FNRBCs富集分离需要大量孕妇外周血液。目前还没有能够适用于临床的FNRBCs富集分离方法。
本文设计了一种在体捕获FNRBCs方法,即将一种可以安全进入人体血管的结构和功能化医疗导丝(functional and structured medical guidewire,FSMW)[5]固定于医用注射器活塞上,再在FSMW上包被FNRBCs抗体,制成FNRBCs采集器。采集时,将注射器通过留置针将FSMW置于孕妇前臂静脉血管中适当时间,以捕获孕妇外周血中的FN‐RBCs。整个采集过程操作简单,不需要昂贵的仪器,对孕妇伤害性小。本文利用血液循环模拟装置进行了原位捕获FNRBCs可行性研究和遗传性耳聋无创产前诊断新方法的探索。
1 材料与方法
1.1 研究对象
选择2018年1月在中国人民解放军总医院妇产科足月分娩的健康男性新生儿3例,取每例新生儿脐带血10ml,EDTA抗凝。
选择2019年3月-5月在中国人民解放军总医院耳聋病分子诊断中心就诊的孕妇5例,分别编号为C001、C002、C003、C004、C005;取每例孕妇外周血10ml,EDTA抗凝。
本项目通过中国人民解放军总医院伦理委员会批准,伦理编号S2016-120-02,在检测前孕妇及家属均被告知并签署知情同意书。
1.2 实验方法
1.2.1 制备采集器
分别称取 0.06g EDC[1-ethyl-3-(3-dimethyl‐aminopropyl)carbodiimide hydrochlorid, Thermo Fisher]和 NHS (N-hydroxysuccinimide,Thermo Fisher)溶于2ml ddH2O,加入28ml二氧六环(1,4-Dioxane,阿拉丁),放入FSMW,活化1小时后加入10μg/ml CD71抗体(sc-32272,SANTA CRUZ BIO‐TECHNOLOGY),4℃孵育24h。
1.2.2 体外捕获
在体捕获FNRBCs之前,需要进行FNRBCs原位捕获效率及可行性研究。本文将输液管和恒流泵组成血液循环模拟装置来体外捕获FNRBCs(见图1)。根据手臂静脉血管直径(3~5mm)和血流速度(<90ml/min),确定输液管直径为4mm和流速20ml/min。将FNRBCs采集器穿入输液管中,注入孕妇外周血或新生儿脐血10ml,以流速20ml/min室温下循环30min,使FNRBCs被采集器上的抗体捕获。

图1 循环血液模拟装置Fig.1 The circulating blood simulation device
1.2.3 洗脱
加入0.25%胰酶溶液浸没导丝,置于37℃水浴消化10min,取出导丝,离心、洗涤后留5μl细胞悬液。
1.2.4 FISH杂交
3例男性新生儿脐血经体外捕获后,采用An‐euVysion®Multicolor DNA Probe Kit(05J38-050)对洗脱下来的细胞进行FISH杂交,具体步骤参考试剂盒说明书。
1.2.5 全基因组扩增
参考《胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)》说明书进行捕获细胞的全基因组扩增。
1.2.6 STR分型
用 MicroreaderTM 21 ID System(V4.1,Code:10403421)对捕获细胞扩增产物和孕妇外周血DNA进行复合扩增,在3100型遗传分析仪上对STR基因座进行检测。
1.2.7 Sanger测序及捕获细胞来源鉴定
以5例孕妇的捕获细胞扩增产物和外周血DNA为遗传材料,分别对孕妇本人携带的耳聋基因致病性变异位点进行片段扩增,然后对扩增片段进行Sanger测序。捕获细胞Sanger结果与孕妇外周血DNA Sanger结果及已知的胎儿羊水穿刺结果进行比较,从而判断捕获细胞的来源。
2 实验结果
2.1 FISH杂交结果
FISH杂交探针的目标染色体为18常染色体(橘色)、X染色体(绿色)和Y染色体(红色)。在3例男性新生儿脐血捕获细胞的FISH杂交结果中,共观察到3个有明确信号的有核细胞,核型为46,XY(见图2)。此实验证明体外捕获体系是可行的。

图2 FISH结果(100×)Fig.2 The results of FISH(100×)
2.2 全基因组扩增产物
5例孕妇外周血捕获细胞全基因组扩增产物达1.7-2.5µg。
2.3 STR分型结果
STR分型结果显示同一孕妇的捕获细胞扩增产物与外周血DNA存在1或多个明显差异位点(见表1)。如C004的D8S1179基因座,STR分型显示其捕获细胞为三峰,而其外周血DNA为双峰(见表1,图3)。STR分型结果说明捕获细胞中存在一定数量的FNRBCs。
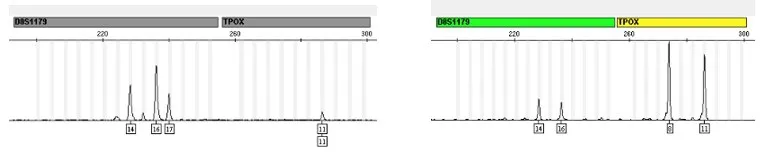
图3 C004的部分STR基因座扩增峰图Fig.3 The amplification peaks of some STR loci of C004
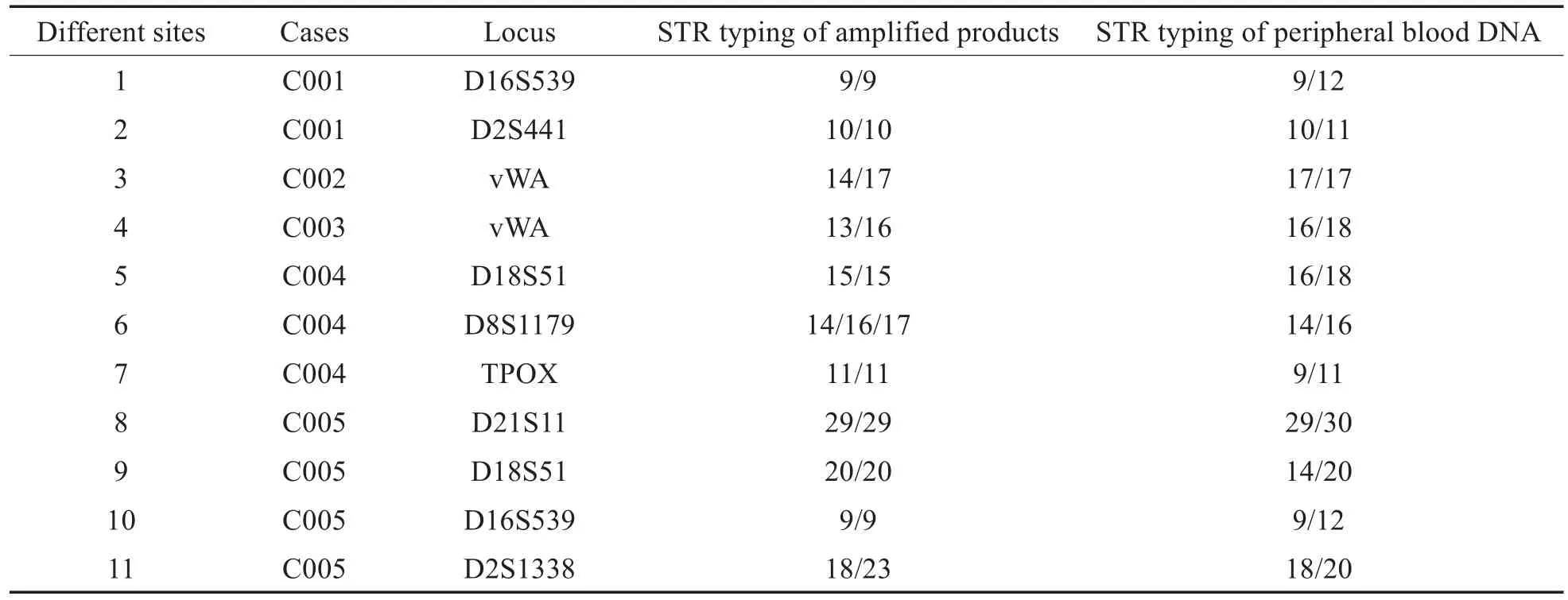
表1 捕获细胞扩增产物与外周血DNA的STR分型差异位点Table 1 The different sites of STR typing between the amplified products of captured cells and the peripheral blood DNA
2.4 Sanger测序结果及捕获细胞来源鉴定
如表2所示,C004的捕获细胞为FNRBCs,而其余4例均为母体细胞。C004孕妇本人致病性位点为SLC26A4:NM_000441:c.2168A>G杂合突变,而C004捕获细胞Sanger测序结果显示该位点为正常基因型,与胎儿羊水穿刺结果一致(见表2)。Sanger测序峰图显示捕获细胞中有低比例的SLC26A4:NM_000441:c.2168A>G杂合突变(见图4)。此结果说明C004捕获细胞中含有较高比例的FNRBCs,也含有少量母体细胞;同时表明FNRBCs的阳性率为1/5。
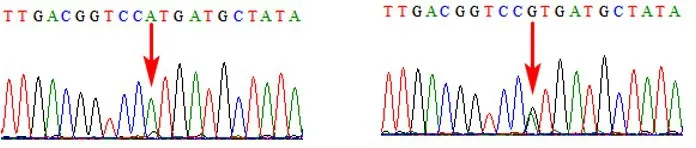
图4 C004的Sanger峰图Fig.4 The Sanger peaks of C004

表2 Sanger结果及捕获细胞来源鉴定Table 2 The Sanger results and the source identification of captured cells
3 讨论
1969年,Walknowska等[6]发现母血中含有46,XY男性细胞,证实了孕妇外周血中确实存在胎儿细胞。这为利用孕妇外周血中胎儿细胞进行非侵入性产前诊断提供了理论依据。迄今为止已分离出4种胎儿细胞:滋养层细胞、胎儿淋巴细胞、胎儿粒细胞和FNRBCs。而FNRBCs具有其他细胞不可比拟的优点:①正常人的外周血中不存在有核红细胞,若出现则属于病理现象;②含有胎儿完整基因组,便于遗传学和分子生物学分析;③具有较多且相对特异的抗原成分如CD71、CD36、GPA、珠蛋白(包括Hbγ、Hbε和Hbζ)和半乳糖残基等;④妊娠早期大量出现,整个妊娠期持续存在,产后约90天在母体外周血中消失,用于诊断时不受前次妊娠影响等[7-10]。已有报道利用FNRBCs对非整倍体[11]、胎儿性别[12]、单基因病如血红蛋白病[13]和地中海贫血[14]等进行检测。如Kolialexi等[14]通过磁激活细胞分选法和单细胞显微操作法对22例孕妇进行了FN‐RBCs分离,并用于β地中海贫血的产前诊断。该方法的FNRBCs阳性率为9.8%。虽然这些技术还处于初期研究阶段,但是这些研究结果为FNRBCs应用于临床疾病的检测提供了可能。
胎儿细胞用于产前诊断所面临的主要的问题是母血中胎儿细胞含量稀少和母体细胞污染,所以需要严格将母血细胞与胎儿细胞分离。目前常用的富集分离方法有微流控技术、流式细胞仪分选法、磁激活细胞分选法、密度梯度离心法、亲和素分离法和单细胞显微操作法等。2002年发表了以开发非侵入性产前诊断为目的的前瞻性、多中心研究结果[15]。该研究以FNRBCs为中心,主要采用两种策略进行FNRBCs富集,分别为磁激活细胞分选法富集CD71抗体标记的细胞和流式细胞仪分选法分离血红蛋白F(HbF)抗体标记的细胞。但研究结果并不令人满意,染色体异常样本中成功捕获一个以上胎儿细胞的比例为74.4%,假阳性率为0.6%~4.1%,该结果还无法运用到临床检测中。与这些方法相比,本文方法操作简单,不需要昂贵仪器,更不需要抽取大量的孕妇外周血。但目前最大问题是捕获的FNRBCs数量和纯度较低,这主要受限于母血量和抗体的特异性。由于目前还没有完成安全性评价,采集器还不能进行孕妇在体捕获试验,体外捕获血量无法满足。抗体方面,目前应用较多的是CD71抗体,但CD71也存在于早期红细胞、单核细胞等细胞膜上,所以用CD71抗体分离FNRBCs会存在母体细胞污染[16]。另外,目前最常用的细胞来源鉴定方法是用Y染色体特异序列探针进行FISH杂交,但该方法受到胎儿性别的限制。本文采用了STR分型法,STR广泛存在于原核生物和真核生物基因组中,符合孟德尔遗传规律,胎儿STR分型一半与母亲相同,另一半与父亲相同。这对判断细胞是否为胎儿细胞具有重要价值。该方法对男女性胎儿均适用,弥补了FISH杂交鉴定细胞来源受胎儿性别限制的不足。
目前,临床上获取胎儿细胞进行产前诊断的金标准是羊膜腔穿刺和宫腔绒毛取样,但对孕妇和胎儿有宫内感染和流产发生的风险。基于母血中游离DNA的无创产前检测(non-invasive prenatal testing,NIPT),由于技术本身的局限性,仅能作为筛查手段,即NIPT结果为阳性孕妇,仍需进行有创性诊断。随着单克隆抗体技术、单细胞基因诊断技术的成熟,胎儿细胞的分离方法较以往得到了明显改善,可有望从母血中分离出少量胎儿细胞用于无创产前基因诊断。下一步我们将在孕猴上进行在体原位捕获实验,以期克服体外捕获的不利条件,提高捕获效率和稳定性,为孕妇在体捕获FNRBCs并应用于耳聋等遗传病的产前无创诊断提供更有利的可靠证据。
