双酚B对斑马鱼性别分化的影响及作用机制
2021-12-07杨倩刘建梅丁洁陈丽红
杨倩,刘建梅,丁洁,陈丽红
1. 南京财经大学食品科学与工程学院,南京 210023 2. 江苏雅信昆成检测科技有限公司,南京 210034 3. 南京中医药大学药学院,南京 210023
双酚A(bisphenol A, BPA)是生产量最大的化工原料之一,广泛用于食品包装材料、奶瓶、水杯以及其他数百种日用品的制造过程[1]。作为一种典型的内分泌干扰物,全球许多国家和地区都出台了法律法规限制BPA的使用。为了应对管控措施和市场需求,一些结构与BPA类似、可耐受较高温度的化合物被开发用来替代BPA,如双酚F(bisphenol F, BPF)、双酚S(bisphenol S, BPS)和双酚B(bisphenol B, BPB)等。其中,BPB常用于制造酚醛树脂,并在多种环境介质[2-3]、食品[4-6]、日常消费品[7]、人体尿液[8]和血液[9]中被检测到,表明人类可能通过多种途径暴露于BPB。虽然BPB的检出频率和浓度略低于BPF和BPS,但是BPB具有更高的生物蓄积性和难生物降解性[10-11],因此仍具有潜在的环境和健康危害。

图1 双酚A(BPA)和双酚B(BPB)的分子结构图Fig. 1 Chemical structures for bisphenol A (BPA) and bisphenol B (BPB)
由于BPB的结构与BPA类似,预计可能对生物系统产生同样的毒性效应。一些体内外实验及模型计算结果表明,BPB甚至具有比BPA更强的雌激素效应及抗雄激素效应。在体外测试中,Kitamura等[12]发现BPB的雌激素和雄激素活性均比BPA更强。Yang等[13]构建了用于双酚A类似物抗雄激素效应的QRSA预测模型,发现BPB的抗雄激素活性与BPA具有相同的数量级。目前为止,针对BPB的体内实验研究还比较有限,Ullah等[14]研究发现,BPB对成年大鼠暴露28 d,能够抑制垂体促性腺激素的分泌,表现出雌激素和抗雄激素的作用,诱导睾丸组织的氧化应激,并引起精巢结构的改变。我们之前的研究表明,斑马鱼成鱼暴露于BPB 21 d能够对斑马鱼的性腺发育造成损伤,扰乱性激素的平衡[15]。环境中污染物的暴露是长期慢性暴露过程,目前针对BPB慢性暴露的研究还比较缺乏,尤其是针对鱼类性别分化这一关键时期的暴露。
鱼类的性别决定和性别分化,受到多种因素的影响,包括遗传基因、环境因素(如温度、pH值)和类固醇激素等。类固醇激素在性分化过程中起到重要的作用,任何外源性激素对类固醇激素造成的改变都会导致斑马鱼出现部分甚至完全的性别偏离[16]。例如,BPA和BPS在对斑马鱼从胚胎期开始暴露后,均造成发育异常、胚子形成中断以及性别比例失衡等现象[17-19],而20 mg·L-117β-雌二醇(17β-estradiol, E2)暴露直接造成了斑马鱼的完全雌性化[20]。但是,影响斑马鱼性别分化的具体的作用机制尚不清晰,此外,污染物对斑马鱼性分化期间不同阶段的影响研究也比较缺乏。
本研究将斑马鱼从胚胎时期开始暴露于BPB中,研究BPB在性分化启动前、性分化期以及性分化结束后,对芳香化酶及性分化相关关键转录因子的影响,并结合性别比例、性腺组织病理学和激素水平的变化情况,探讨BPB对斑马鱼性分化影响的作用机制,为BPB潜在的风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 材料与试剂
双酚B,CAS号77-40-7,纯度>98%,美国J&K公司;焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)处理过并经高温高压灭菌的超纯水(DEPC水),B.R.级,上海杰瑞生物工程有限公司;雌二醇酶联免疫试剂盒、睾酮酶联免疫试剂盒,96T,武汉艾博伊科技有限公司;RNA Later,C.P.级,美国赛默飞世尔科技公司;Trizol试剂,美国英杰生命技术有限公司;ReverTra Ace®qPCR RT Master Mix with gDNA Remover试剂盒(200次),东洋纺(上海)生物科技有限公司;Sso fast EvaGreen Supermix,美国伯乐公司;甲醇、乙醇和乙腈均为色谱纯,德国Merck公司;水为Milli-Q超纯水。
1.2 仪器与设备
显微镜(DM2500,德国Leica公司),冷冻离心机(2-16PK,美国Sigma公司),生态培养箱(CLIMACELL型,德国MMM公司),高效液相色谱串联质谱仪(LC-Agilent Technologies 1290 Infinity,MS-AB SCIEX QTRAP 4500),荧光定量PCR仪(CFX96TMOptics型,美国Bio-Rad公司),酶标仪(Infinite M200型,瑞士TECAN公司),核酸蛋白分析仪(DU800SERIES,美国Sigma公司),多功能水质参数测定仪(HQ40d,美国HACH公司),电热恒温培养箱(INNOVA®43,郑州南北仪器设备有限公司)、旋转蒸发仪(R-210,B-491,V-850,瑞士BUCHI公司)。
1.3 实验方法
1.3.1 斑马鱼驯化和胚胎收集
四月龄野生成年斑马鱼(AB型)购于中国科学院武汉水生生物研究所,并在实验室斑马鱼养殖系统中养殖并繁殖了3代以上。系统运行期间,光照/黑暗周期设定为16 h∶8 h(光照∶黑暗),维持温度在26 ℃±1 ℃,每天定时投喂丰年虾2次。雌鱼和雄鱼在光照刺激下交配产卵,收集质量高的胚胎,置于26 ℃恒温光照培养箱中待用。
1.3.2 暴露实验
使用前将BPB用二甲基亚砜(DMSO)配制成10 000 mg·L-1的贮备液,储存于4 ℃,实验中所用相应浓度的暴露液用斑马鱼养殖水稀释,保证暴露液中的DMSO含量不超过溶液体积的0.01%(V/V)。
BPB对斑马鱼性分化阶段的毒性实验的浓度设置分别为1、10、100和1 000 μg·L-1,同时设置空白对照组。每个浓度设置3个平行,每个平行随机放置500粒发育正常的受精卵于500 mL暴露液中,暴露周期为60 d,在暴露期间,设置温度为26 ℃,光照周期为16 h∶8 h(光照∶黑暗),光照强度50 lux。试验期间,每48 h更换75%的暴露溶液,并清洗容器。从第10天开始,将幼鱼转移至20 L的玻璃缸内,并置于恒温流水式水浴槽内以保持稳定的温度(26 ℃±1 ℃),设置光照周期为16 h∶8 h(光照∶黑暗)。在第20天,将缸内鱼的数量调整为每缸100条;第30天,调整为每缸40条。暴露期间,定期对鱼进行取样以分析性分化及性别决定基因,具体取样阶段及每个平行的采集数量如下:10 dpf(n=20尾),20 dpf(n=20尾),30 dpf(n=10尾),42 dpf(n=5尾)。所取幼鱼置于RNAlater中,保存于-20 ℃冰箱,用于接下来的RNA提取实验。在60 d暴露结束后,在每个平行中随机挑选雌雄鱼各6条,置于-80 ℃保存,用于激素水平的测定。另外,每个浓度中随机挑选出50条鱼解剖取性腺,进行性腺组织学分析,并计算性别比例。
1.3.3 暴露溶液中BPB的化学分析
为了确定暴露溶液中BPB的实际浓度,在暴露第1天溶液配制好加入鱼缸后(0 h)和换水前(48 h)这2个时间点收集暴露溶液,采用液相色谱串联质谱仪进行分析,以表征暴露溶液在试验期间的变化情况。水样的处理和净化方法、液相色谱条件和质谱条件见陈玫宏等[21]的研究。
1.3.4 性腺组织学分析和性别比例
暴露60 d后,随机收集50条鱼,置于冰上,冻僵后解剖取性腺制备石蜡切片,用电子显微镜拍照进行性腺组织学分析及性别比例鉴定。
1.3.5 激素水平分析
暴露结束后每个平行各取6条雌鱼和雄鱼用于性激素水平的测定,分别将每条鱼的头和尾部切下后,每个平行中雌鱼的头尾合并作为雌性组,雄鱼的头尾合并作为雄鱼组,加入预冷的匀浆缓冲液和蛋白酶抑制。用匀浆器充分匀浆后收集上清液并分装,置于-80 ℃保存直至采用酶联免疫吸附法进行E2和睾酮(testosterone, T) 2种性激素水平的测定。使用鱼类E2和T试剂盒(武汉艾博伊科技有限公司)进行分析。
1.3.6 基因转录水平分析
对暴露不用阶段所采集的鱼样进行性分化相关基因水平的测定。采用Trizol试剂,严格按照说明书的要求提取总RNA,获得的RNA溶液分装后置于-80 ℃冰箱待用。采用ReverTra Ace®qPCR RT Master Mix with gDNA Remover试剂盒对所提取的RNA进行反转录,合成cDNA。所合成的cDNA样品保存于-20 ℃,进行荧光定量PCR时,作为模板直接或稀释后添加。
实时荧光定量PCR反应在BIO-RAD公司的CFX96TMOptics仪器上进行,根据SYBR Green PCR kit说明书操作。实验中所采用的目标基因和管家基因相关引物信息如表1所示。引物信息根据引物设计标准,用Primer Premier 5.0软件设计。
1.3.7 数据处理
实时荧光定量PCR的调控倍数是以管家基因β-actin作为内参基因,以空白对照组进行标准化,采用2-ΔΔCT方法计算所得[22]。采用IBM SPSS 9进行统计学分析。基因转录水平在暴露组和空白对照组之间的差异性采用单因素方差分析。当P<0.05表示暴露组与对照组之间具有显著性差异。
2 结果(Results)
2.1 暴露溶液中BPB的实际浓度分析
在暴露期间,空白对照中的BPB浓度低于检出限;BPB在试验开始时(0 h)和换水前(48 h)的实测浓度均无较大差异,除了1 μg·L-1浓度组外,所有实测浓度都非常接近所设置的名义浓度(表2),说明这BPB在胚胎暴露实验中浓度保持相对稳定。为了方便叙述,所有暴露浓度均以所设置的名义浓度来叙述。
2.2 性腺组织学分析和性别比例
暴露60 d后,随机从各个浓度组中挑选出50条鱼进行性腺组织学检查,以研究化合物暴露对性腺发育的损伤以及对性别比例的影响。BPB处理后,斑马鱼的精巢和卵巢的组织变化情况如图2和图3所示。由图2可知,发育正常的精巢中,均含有各个发育时期的精细胞,包括精原细胞(S)、早期精母细胞(ES)、晚期精母细胞(LS)、精子(SZ)和精细胞(SPs)5个阶段,不同发育阶段的精母细胞排列整齐。但是,在100 μg·L-1和1 000 μg·L-1的BPB处理后,出现了精小囊排列不规则,非细胞区域增大的现象,同时出现了发育异常的精巢-卵精巢,即在一些精巢中出现了不同发育时期的卵母细胞,直径为30~50 μm(图2(a)、(c)、(e)、(f)),在100 μg·L-1和1 000 μg·L-1浓度组,卵精巢出现的比例分别为12%和18%。
发育正常的雌鱼的卵巢中,同时存在4个阶段的卵母细胞,包括卵黄发生前期卵母细胞(Ⅰ和Ⅱ)、卵黄发生期卵母细胞(Ⅲ)、卵黄发生后期卵母细胞(Ⅳ)(图3)。与对照组相比,经100 μg·L-1和1 000 μg·L-1BPB暴露时,卵巢中卵黄发生前期卵母细胞(Ⅰ)出现的比例远远高于其余3个阶段的卵母细胞(图3),而在1 000 μg·L-1浓度组,观察到一些卵巢中只有卵原细胞和卵黄发生前期卵母细胞(图3(c)),说明卵母细胞的发育受到了抑制。
BPB对斑马鱼性别比例的影响如表3所示,BPB暴露导致斑马鱼呈现雌性化的趋势,并出现雌雄间体的现象。10 μg·L-1及以上浓度BPB暴露后,斑马鱼雌鱼数量开始增多,在100 μg·L-1和1 000 μg·L-1浓度中呈现出较为显著的雌性化趋势,并且能够观察到雌雄间体的现象(出现的频次分别为12%和18%)。
2.3 BPB暴露对激素水平的影响
BPB对斑马鱼暴露60 d后,雌鱼和雄鱼的性激素水平出现了不同程度的改变(图4)。对于雄鱼,在10、100和1 000 μg·L-1的BPB暴露组,T水平分别降低了31.86%、49.54%和60.28%,而雌鱼的T水平分别降低了36.13%、47.81%和56.24%,雄鱼和雌鱼体内的E2水平分别升高了50.55%、89.57%、103.44%和40.74%、51.64%、63.84%,并最终导致了T与E2的比值的显著性降低,并呈现出明显的剂量-效应关系,说明BPB对斑马鱼的性激素平衡具有扰乱作用。

表1 性分化相关基因的引物序列信息Table 1 Sequences of primers for the genes of sex differentiation

表2 暴露过程中BPB的名义浓度和实测浓度Table 2 The nominal and measured concentrations of BPB

图2 BPB暴露至60 dpf的雄性斑马鱼精巢组织切片图(HE染色)注:(a)空白对照组精巢(10×);(b)100 μg·L-1 BPB暴露组精巢(10×);(c)1 000 μg·L-1 BPB暴露组精巢(10×); (d)空白对照组精巢(20×);(e)100 μg·L-1 BPB暴露组精巢(20×);(f)1 000 μg·L-1 BPB暴露组精巢(20×); a.精原细胞,b.早期精母细胞,c.晚期精母细胞,d.精子,e.精细胞,f.卵黄发生前期卵母细胞,g.卵黄发生后期卵母细胞。Fig. 2 Histology of testis from male zebrafish after BPB exposure until 60 dpf (hematoxylin and eosin (HE) stain)Note: (a) testis from a control male (10×); (b) 100 μg·L-1 BPB exposed zebrafish (10×); (c) 1 000 μg·L-1 BPB exposed zebrafish (10×); (d) testis from a control male (20×); (e) 100 μg·L-1 BPB exposed zebrafish (20×); (f) 1 000 μg·L-1 BPB exposed zebrafish (20×); a. spermatogonia; b. early spermatocyte; c. late spermatocyte; d. spermatids; e. spermatozoa; f. pre-vitellogenic stage oocyte; g. late-vitellogenic stage oocyte.
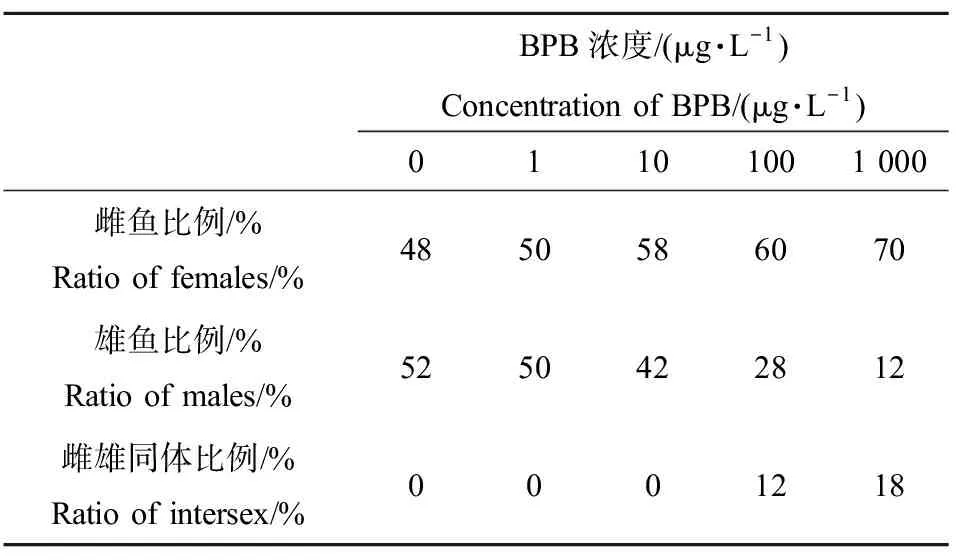
表3 BPB暴露对60 dpf斑马鱼性别比例的影响Table 3 Sex ratios of 60 dpf zebrafish exposed to BPB
2.4 BPB暴露对斑马鱼性分化相关基因转录水平的影响
BPB暴露后,性分化相关基因转录水平的变化情况如图5所示,由图5可知,在暴露第10天,1 000 μg·L-1的BPB使cyp19a1a的水平上调至对照组的1.89倍(图5(a)),但是导致dmrt1和sox9a的转录水平分别降低至对照组的0.8倍和0.48倍(图5(e))。暴露第20天,1、10、 100 和1 000 μg·L-1的BPB暴露组均使foxl2的转录水平显著提高(分别上调至对照组的2.24倍、2.02倍、1.63倍和2.98倍)(图5(f));10 μg·L-1以上浓度的BPB暴露导致cyp19a1a的水平显著性提高,并呈现出明显的剂量-效应关系,其中1 000 μg·L-1浓度组使cyp19a1a的水平提高至对照组的3.56倍(图5(a)),而1 000 μg·L-1浓度组显著降低了dmrt1、amh和sox9a的表达水平(分别降低至对照组的0.54倍、0.48倍和0.43倍)(图5(b)~5(e))。暴露第30天,4个浓度组均显著提高了foxl2的转录水平(图5(f)),而10 μg·L-1以上浓度的BPB导致cyp19a1a转录水平显著性升高(图5(a)),这2个基因的表达水平均呈现良好的剂量-效应关系;在100 μg·L-1和1 000 μg·L-1BPB暴露下,dmrt1、amh和sox9a的表达水平均显著性降低至对照组的0.5倍以下。暴露第42天,cyp19a1a和foxl2在4个浓度组的处理下,转录水平均显著升高(图5(a)和5(f)),而在10 μg·L-1以上浓度时,amh的转录水平显著降低,最低达到对照组的0.38倍;1 000 μg·L-1BPB使dmrt1和sox9a的表达水平分别显著性降低至对照组的0.38倍和0.3倍。

图3 BPB暴露至60 dpf的雌性斑马鱼卵巢组织切片图(HE染色)注:(a)空白对照组卵巢(10×);(b)100 μg·L-1 BPB暴露组卵巢(10×);(c)1 000 μg·L-1 BPB暴露组卵巢(10×); a.卵原细胞;b.卵黄发生前期卵母细胞;c.卵黄发生期卵母细胞;d.卵黄发生后期卵母细胞。Fig. 3 Histology of ovary from female zebrafish after BPB exposure until 60 dpf (HE stain)Note: (a) ovary from a control female (10×); (b) 100 μg·L-1 BPB exposed zebrafish (10×); (c) 1 000 μg·L-1 BPB exposed zebrafish (10×); a. oogonia; b. pre-vitellogenic stage oocyte; c. vitellogenic stage oocyte; d. late-vitellogenic stage oocyte.

图4 BPB暴露至60 dpf对斑马鱼性激素水平的影响注:T表示睾酮,E2表示雌二醇;结果以3次重复的平均值±SD 表示;*表示暴露组与对照组之间具有显著性差异(P<0.05)。Fig. 4 Effects of BPB exposure until 60 dpf on steroid hormone concentrations of zebrafishNote: T stands for testosterone; E2 stands for 17β-estradiol; the results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
3 讨论(Discussion)
本研究将斑马鱼胚胎暴露于BPB溶液中至60 dpf,暴露期结束后,从性腺切片图中可以看出,从10 μg·L-1开始,随着BPB暴露浓度的增加,斑马鱼的性腺发育受到抑制,且雌鱼的比例不断上升,呈现了雌性化的趋势,说明BPB在性分化的关键期暴露发挥了雌激素效应,并呈现出剂量依赖效应。同样的性腺发育异常现象在BPA及其类似物的暴露中也被观察到,10 μg·L-1BPA暴露导致日本青鳉的雌鱼比例高于雄鱼,并且在此浓度出现雌雄间体的现象[18],而BPS和BPF也在10 μg·L-1时引起斑马鱼雌性比例的升高[19,23],与本研究中出现性别比例失衡的起始浓度相同。而BPB对斑马鱼成鱼的暴露也导致了精巢和卵巢发育的异常[15],进一步说明BPB暴露会对繁殖系统造成损伤。目前为止,污染物对斑马鱼的性别分化影响的具体机制尚不清晰,但是研究表明,性激素对鱼类性腺发育起至关重要的作用,是性腺发育和成熟的重要调控因子[24],而芳香化酶是性激素合成过程中的关键酶,在维持鱼体性激素的平衡以及调控性别分化起到至关重要的作用[25]。内源性类固醇激素的合成受到外源性激素的干扰时,会对性腺分化产生影响或损伤,可能会引起雌雄间体现象或其他性腺发育异常状况,从而改变鱼类的性别比例,导致性别失衡现象,例如,鱼类在早期性分化阶段暴露于雌激素类物质会导致雌性化趋势,而雄激素类物质会引起性别比例偏向于雄鱼[26]。对斑马鱼性激素水平的检测进一步证实,BPB暴露导致了斑马鱼雌激素水平升高以及雄激素水平下降,并影响了斑马鱼性激素的平衡。通过对芳香化酶基因的测定发现,从在性分化期之前(10dpf),1 000 μg·L-1BPB即升高了cyp19a1a的基因表达,而性分化期启动(20 dpf)开始后,10 μg·L-1BPB即能够显著提高cyp19a1a基因在整个性分化期的表达。由此我们推测,BPB暴露后,上调了cyp19a1a的转录水平,促进了雌激素的合成,而性激素水平的改变抑制了雄鱼非功能性卵巢的退化以及精巢分化的启动与维持,导致出现雌雄间体甚至完全的性别逆转为雌性的现象,进一步造成了性别比例偏向于雌性。

图5 BPB暴露对斑马鱼性分化相关基因转录水平的影响注:结果以3次重复的平均值±SD表示,*表示暴露组与对照组之间具有显著性差异(P<0.05)。Fig. 5 Effects of BPB on expression of genes involved in the sex differentiation and determination of zebrafishNote: The results are shown as mean±SD of three replicates; asterisk indicates significant difference from control (P<0.05).
虽然对于斑马鱼而言,目前尚未发现能够直接决定性别的基因,但是在性分化过程中,有多个转录因子在性分化和芳香化酶调节中发挥重要作用,包括dmrt1、amh、ff1b、sox9a和foxl2等,因此,通过对这些基因转录水平的评估,可以进一步研究BPB使斑马鱼产生雌性化的分子机制。
dmrt1、amh、ff1d和sox9a都在睾丸中高度表达,而在雌鱼和卵巢中表达量很少,在鱼类精巢分化和发育中发挥重要作用[27-29]。本研究发现,BPB暴露后,从第10天开始即检测到dmrt1和sox9a基因表达水平的显著性下调(1 000 μg·L-1),从第20天开始,amh的表达量也出现降低的趋势,我们推测在20 d之前,虽然斑马鱼表观的性别分化还没开始,但是在分子机制上已经启动,并且dmrt1和sox9a对类雌激素的暴露非常敏感。在其他内分泌干扰物的暴露中也观察到了类似的现象,比如性分化期的斑马鱼幼鱼暴露于E2后,其dmrt1的基因表达水平下调,幼鱼的精巢分化受到抑制或延迟,但是dmrt1水平的改变是在第28天被检测到[30]。此外,dmrt1、amh、ff1d和sox9a跟cyp19a1a具有负调控的关系[31-33],在本文中,dmrt1和sox9a的表达水平从10 d开始下降,与cyp19a1a升高的变化趋势一致,进一步证实了dmrt1、sox9a与cyp19a1a之间的负调控关系。
foxl2在斑马鱼卵巢的正常分化中起非常重要的作用,是卵巢分化的标志性启动因子。FOXL2蛋白可以上调cyp19a1a的转录水平,从而调控雌激素的生成[34];而雌激素又可诱导foxl2在早期生活中的表达,并进一步触发鱼类从雄性到雌性的性别逆转[34-35]。在本研究中,BPB表现出的类雌激素效应诱导了foxl2基因表达量的上升,而上调的foxl2一方面直接导致了斑马鱼从基因型雄性向表型雌性的逆转,另一方面促进了芳香化酶的表达,进一步证明了斑马鱼体内雌激素与foxl2的表达之间的直接联系。此外,从结果来看,在性分化过程中,1 μg·L-1BPB即可引起foxl2表达水平的改变,效应剂量比cyp19a1a更低,因此我们推测,foxl2是比cyp19a1a对BPB更敏感的标志物。
综上所述,BPB对斑马鱼从受精开始暴露至性分化期结束后,抑制了精巢发育相关基因sox9a、amh和dmrt1的表达水平,上调了卵巢发育相关基因foxl2的转录水平,导致了cyp19a1a水平的高度表达,促进了雄激素向雌激素的转化,从而提高了斑马鱼体内雌激素水平,降低了雄激素水平,继而导致斑马鱼在性别分化时发生异常,出现了部分甚至完全的性别逆转,以及性别比例偏向于雌性化的现象。
