基于表面等离子体共振技术筛选STAT3 小分子抑制剂的研究
2021-12-04苏晓薇张华林许维恒张俊平福建中医药大学药学院福建福州5008陆军第八十一集团军医院河北张家口07500海军军医大学药学院上海004
苏晓薇,张华林,张 宁,杨 犇,许维恒,张俊平 (. 福建中医药大学药学院 福建 福州 5008;. 陆军第八十一集团军医院 河北 张家口 07500;. 海军军医大学药学院 上海 004)
STAT3 是一种重要的转录因子,参与众多细胞因子和生长因子受体的信号转导,在细胞生长和细胞凋亡等多种细胞过程中发挥着关键作用[1-2]。STAT3 的活化可以通过刺激白介素-6 受体(IL-6R)、Janus 酪氨酸激酶、BCR-ABL 和SRC 家族激酶等来启动[3]。STAT3 经磷酸化活化后形成同源和异源二聚体,并易位至细胞核,发挥转录激活因子的作用[4-6]。目前,越来越多的证据显示,多种恶性肿瘤存在STAT3 的过度激活,包括前列腺癌、肺癌、乳腺癌、皮肤癌和宫颈癌等,抑制STAT3 的磷酸化成为一种很有前景的治疗策略。此外,STAT3还与肝损伤、纤维化、风湿性关节炎、心肌缺血等疾病有关[7]。尽管一些STAT3 抑制剂正在进行临床试验,但迄今为止尚未批准STAT3 抑制剂用于癌症的治疗。因此,仍然迫切需要发现潜在的STAT3 抑制剂[8]。
SPR 是一种光学生物传感技术,该技术利用光学测量的折射率变化,分析样品与固定在SPR 传感器上的分子的结合情况。因其无需标记样品,具有高灵敏度,能实时检测生物分子间的相互作用而被广泛运用于医疗检测、药物筛选、环境监测和食品检测等领域[9]。
本课题采用SPR 技术从中药单体中筛选能与STAT3 特异性结合的小分子化合物,通过蛋白免疫印迹技术和双荧光素酶报告基因考察小分子对STAT3 的抑制作用,采用分子对接技术拟合化合物与STAT3 的结合模式,明确其可能的作用位点,从而为STAT3 抑制剂的发现提供理论指导和实践经验。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
DMSO(美国Sigma 公司);EDC/NHS(GE 公司);胰酶(美国Gibco 公司);DMEM 培养基(美国Corning 公司);胎牛血清(美国Gibco 公司);细胞裂解液、PMSF、30%丙烯酰胺溶液、1.5 mol/L Tris(pH=8.8)、1.0 mol/L Tris(pH=6.8)、10%SDS、TEMED、BCA 试剂盒、双荧光素酶报告基因检测试剂盒(上海碧云天生物技术有限公司);硝酸纤维素膜(德国Sartorius Stedim 公司);转染试剂(美国Life Technology 公司)
1.1.2 实验仪器
Biacore T2000(GE 医疗生命科学公司);电子天平(上海天平仪器厂);电泳仪(美国Bio-Rad 公司);制冰机(德国Eppendorf 公司);-80℃低温冰箱(美国Thermo 公司);CO2细胞培养箱(美国Thermo 公司);离心管(美国Corning 公司);低温高速台式离心机(美国Thermo 公司);移液枪(德国Eppendorf 公司);超纯水仪(美国Millipore 公司);多功能酶标仪(美国Thermo 公司)。
1.1.3 实验细胞
HeLa 细胞(购自上海碧云天生物科技有限公司,由本实验室冻存、培养);HeLa-STAT3-Luc 细胞(由本实验室构建、培养、冻存)。
1.2 实验方法
1.2.1 Biacore 鉴定STAT3 特异性结合小分子(1)STAT3 预富集
将STAT3 纯化蛋白用去离子水溶解并配成1 g/L的蛋白母液,用4 种不同pH 的醋酸盐缓冲液(pH4.0、pH4.5、pH5.0、pH5.5)稀释蛋白母液至50 mg/L,进样,于Biacore 预富集系统检测不同pH 条件下蛋白STAT3 的响应值,确定最佳蛋白偶联条件。
(2) STAT3 偶联
在预富集实验中所得最佳pH 条件下,将STAT3稀释至50 mg/L,通过EDC/NHS 活化CM5 芯片表面羧基,然后通过羧基氨基缩合反应将STAT3 键合到CM5 芯片上,乙醇胺封闭未结合的羧基,从而实现STAT3 偶联到CM5 芯片上的目的。
(3)亲和力分子
将中药小分子单体化合物用DMSO 溶解,然后用PBS 稀释成32 μmol/L (DMSO 终浓度为5%)的样品后进样,流动相为5%DMSO 的PBS 溶液,通过Biacore 系统分析其流过STAT3 蛋白表面的响应值,筛选出对STAT3 响应值较高(高于阳性对照或与其相当)的单体化合物作为候选化合物。
(4)动力学分析
将候选化合物浓度以二倍比进行梯度稀释,浓度范围为0.062 5~64 μmol/L(DMSO 终浓度均为5%),通过Biacore 系统分析获得结合响应值,根据响应值与候选化合物浓度之间的量效关系绘制动力学曲线,根据曲线拟合情况判断候选化合物与STAT3 的结合特异性,从而找到能与STAT3 蛋白特异性结合的小分子单体。
1.2.2 蛋白免疫印迹(Western-blot)检测化合物对STAT3 磷酸化的抑制情况
HeLa 细胞以5×105个/孔接种于6 孔板,于37 ℃、5%CO2细胞培养箱中培养过夜。次日,加入不同浓度的化合物,作用24 h 后,加入100 μl Western及IP 细胞裂解液(含1 mmol/L PMSF),冰上裂解25 min,收集蛋白于1.5 ml 离心管,12 000 r/min,4 ℃离心10 min,吸取上清液,使用BCA 蛋白定量试剂盒进行总蛋白定量。蛋白样品中加入5×蛋白上样缓冲液,煮沸5 min,进行SDS-PAGE 凝胶电泳。电泳结束后,在250 mA 恒流电下将蛋白从凝胶转移到NC 膜上,5%脱脂牛奶封闭,进行一抗(p-STAT3/STAT3)、二抗孵育,结束后在红外双色激光成像系统(Odyssey)上扫膜检测700 和800 通道激发的荧光信号,观察各泳道中蛋白表达情况。
1.3 双荧光素酶报告基因鉴定化合物抑制STAT3磷酸化的作用
HeLa-STAT3-Luc 细胞计数后按1×105个/孔接种于24 孔板,置于37 ℃、5%CO2细胞培养箱中培养24 h,加入不同浓度化合物孵育4 h,然后加入IL-6(100 ng/ml)和IL-6R(100 ng/ml)共同刺激24 h,弃上清液,每孔加入120 μl 细胞裂解液,离心后取5 μl 上清液转移至新的384 孔板,每孔加入25 μl 荧光素酶1 液,使用多功能酶标仪检测荧光值,然后加入25 μl 荧光素酶2 液,再次测荧光值,定内参。
1.4 分子对接技术
分子对接以Protein Preparation Wizard 模块处理蛋白,选择STAT3 蛋白与小分子抑制剂的晶体复合物6NUQ,依次去水、加氢,以LigPrep 模块处理配体,力场优化均采用OPLS2005 模式,其余参数均使用默认;以Grid 模块建立蛋白对接坐标,范德华力半径设置为1.0;采用精确对接模式(XP)的方法进行对接,对接结果用PyMol 软件作图。
1.5 统计学分析
2 实验结果
2.1 Biacore 系统预富集STAT3 蛋白
为了研究STAT3 蛋白的最佳偶联条件,采用不同pH 的醋酸盐缓冲液稀释蛋白,进行预富集分析,结果显示STAT3 在pH4.0 的条件下响应值最高(图1)。因此,后续实验选择pH4.0 的缓冲液进行偶联。

图1 不同pH 条件下STAT3 芯片富集情况
2.2 Biacore 系统偶联STAT3 蛋白
取市售的STAT3 蛋白用pH4.0 醋酸盐缓冲液稀释至50 mg/L,通过Biacore 系统的内置程序偶联到CM5 芯片上,结果显示STAT3 偶联量为8 000 RU,达到预计偶联水平(图2)。
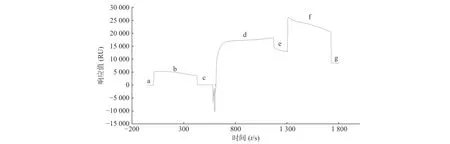
图2 Biacore 系统STAT3 蛋白偶联情况
2.3 筛选中药单体小分子化合物
为了筛选能够结合STAT3 蛋白的小分子化合物,我们将50 种中药单体统一稀释到32 μmol/L,利用Biacore 系统检测结合情况,通过响应值观察小分子与STAT3 蛋白的结合强度。结果发现,不同小分子化合物与STAT3 蛋白的结合存在差异(图3),我们以阳性对照(C188-9)为标准,筛选响应值不低于阳性对照响应值的化合物,得到了梓醇(catalpol)、黄芩素(baicalein)、芹黄素(apigenin)、槲皮素(quercitrin)、人参皂苷(ginsenoside)、京尼平苷酸(geniposidic acid)、桑辛素(morusin)等10 多种小分子作为候选化合物,接着进行动力学分析以确定它们与STAT3 蛋白的结合特异性。

图3 50 种中药单体在Biacore 系统中与STAT3 蛋白结合响应的情况
2.4 候选化合物的动力学分析
为了验证候选化合物与STAT3 蛋白的结合是否为特异性结合,我们将候选化合物进行梯度稀释,通过Biacore 系统分析获得结合响应值,绘制动力学结合曲线。对10 多种化合物均进行动力学分析,发现只有芹黄素与STAT3 的结合具有特异性。芹黄素与STAT3 的结合响应值随着药物浓度的增大而升高,当浓度增大到一定值时响应值呈水平趋势不再变化,说明高浓度芹黄素同STAT3 的结合存在饱和现象,即芹黄素与STAT3的结合为特异性结合(图4)。因此,选择芹黄素作为可能的STAT3 抑制剂进行生物学验证。

图4 特异性结合动力学曲线
2.5 Western-blot 检测结果
动力学分析结果证实芹黄素可以特异性结合STAT3,为了确证芹黄素对STAT3 磷酸化的抑制作用,我们利用IL-6 诱导活化STAT3,通过Western-blot 检测芹黄素对STAT3 磷酸化的抑制作用。结果发现,IL-6 可以显著刺激HeLa 细胞STAT3 的活化,而芹黄素能剂量依赖地抑制IL-6 诱导的STAT3 磷酸化,表明芹黄素可能是STAT3的抑制剂(图5)。

图5 Western-blot 检测芹黄素抑制STAT3 磷酸化效果
2.6 双荧光素酶报告基因检测结果
为了进一步确证芹黄素对STAT3 的抑制作用,我们采用双荧光素酶报告基因系统研究芹黄素对STAT3 转录活性的影响。结果显示,IL-6 刺激可以显著促进STAT3 的转录活性,10μmol/L、20 μmol/L芹黄素能够抑制IL-6 诱导的STAT3 转录活性的增加(图6)。以上结果表明芹黄素能够抑制STAT3的转录活性,进一步证实芹黄素是STAT3 的小分子抑制剂。

图6 双荧光素酶报告基因检测芹黄素抑制STAT3 活化的能力
2.7 分子对接结果
为了明确STAT3 与芹黄素的相互作用情况,我们采用分子对接技术分析STAT3 与芹黄素的结合位点。结果显示,芹黄素结合于STAT3 蛋白的SH2 结构域,占据了STAT3 磷酸络氨酸的结合口袋。与关键残基Glu638、Gln644、Gly656、Lys658形成氢键相互作用,与Tyr657 残基形成π-π 相互作用(图7)。

图7 芹菜素与STAT3 蛋白(PDB: 6NUQ)的结合模式拟合图
3 讨论
STAT3 在肿瘤中的持续激活和过度表达与肿瘤细胞的多种恶性生物学特征密切相关。STAT3的活化受多种细胞因子、生长因子,生长因子受体,非受体蛋白酪氨酸激酶等多重信号分子的调控,目前已成为肿瘤治疗领域的研究热点之一[10]。 STAT3存在6 个结构域,包括氨基末端结构域(NTD)、卷曲螺旋结构域(CCD)、DNA 结合结构域(DBD)、接头结构域、Src 同源结构域(SH2)和羧基末端反式激活(TAD)结构域。目前,对STAT3 的直接抑制作用可以通过破坏SH2、DBD 或NTD 结构域来阻止功能性STAT3 二聚体的形成。STAT3 的直接抑制剂主要分为三类:肽,小分子抑制剂和寡核苷酸。间接抑制剂则通过靶向STAT3 信号通路阻断上游信号通路(如IL-6 和JAK 通路)间接抑制STAT3[11-12]。目前,STAT3 抑制剂的研发已成为肿瘤治疗领域的研究热点之一。
芹黄素是一种天然黄酮类化合物,具有抗炎、抗氧化和抗癌作用[13],其在多种癌症中(如乳腺癌、肺癌、肝癌、前列腺癌等)表现出对细胞的生长抑制与促凋亡作用。芹黄素不仅能够通过内源性与外源性凋亡途径促进细胞凋亡,也能通过降低基质金属蛋白酶-2,-9 的表达抑制肿瘤细胞侵袭[14]。但是,芹黄素与STAT3 的关系尚未研究,其对STAT3的抑制作用也没有报道。
本研究利用表面等离子体共振技术,从50 个中药单体中筛选出能与STAT3 特异性结合的小分子化合物芹黄素,然后运用Western-blot、双荧光素酶报告基因实验证实了芹黄素对STAT3 的抑制作用。采用分子对接技术分析STAT3 与芹黄素的结合位点,结果揭示芹黄素主要通过结合STAT3 的SH2 结构域抑制其磷酸化。本研究为芹黄素抗癌作用提供了理论基础,同时,也为发现STAT3 及其他药物靶点的小分子抑制剂提供了研究经验。
