单核细胞增生李斯特菌进化家系的研究进展
2021-12-02周继福赵晓美
周继福,王 娉,郭 佳,3,赵晓美,陈 颖,*
(1.南京财经大学食品科学与工程学院,江苏 南京 210023;2.中国检验检疫科学研究院,北京 100176;3.天津科技大学食品科学与工程学院,天津 300000)
单核细胞增生李斯特菌(Listeria monocytogenes)(简称单增李斯特菌)是一种胞内兼性厌氧的可对人类健康造成严重危害的食源性致病菌[1]。其分布广泛,食品(乳及乳制品、生熟肉类、蛋类、即食食品、水果蔬菜等)[2-3],食品加工、储存设备(设备表面、管道、生产环境和冰箱)[4-5],自然环境(土壤、污水)[6]和动物宿主(哺乳动物、非哺乳动物)细胞[7]中均有分离获得该菌的报道。单增李斯特菌可在低pH值(3.3~4.2)、低温、高盐浓度(0.5%~1.2%)和高压下存活[8],易感人群为幼童(young)、老年人(old)、孕妇(pregnant)和免疫功能缺陷人群(immune-compromised people),也被简称为“YOPI”[8]。感染后,住院率(92%)和死亡率(20%~30%)较高[9]。
根据菌体抗原(O)和鞭毛抗原(H)的血清凝集实验可以将单增李斯特菌分成13 种血清型(1/2a、1/2b、1/2c、4b、3a、3b、3c、4a、4c、4e、4ab、4d和7)[10-11]。不同血清型菌株的致病性存在差异,从临床病例和受污染的食品中分离得到的菌株至少95%以上属于血清型1/2a、1/2b、1/2c、4b[12-13],其中1/2a和1/2b血清型菌株通常为食品分离株[11,14-15]。血清型4b菌株在临床患者样本中常见[16],李斯特菌病中约有50%的病例是由4b血清型菌株感染所致。研究认为血清型1/2和4b菌株致病性的差异与菌株细胞的壁磷壁酸(wall teichoic-acid,WTA)组成及其聚合物结构不同有关[17]。依据表型特征和基因分型方法,可以将单增李斯特菌分成4 种进化家系,家系I和家系II菌株的来源种类和数量最多,而家系III较少,家系IV则较为罕见[18]。家系I菌株包含6 种血清型(1/2b、4b、3b、4e、4d和7),家系II菌株包含4 种血清型(1/2a、1/2c、3a和3c),家系III和IV包含的血清型为4b、4a和4c[14],4b血清型菌株在家系I、III和IV中均有发现[19]。菌株进化家系研究通常会结合菌株的血清型(serotypes)、血清组(serogroups)、流行克隆(epidemic clones,ECs)、毒力类型(virulence types,VTs)、克隆复合体(clonal complexes,CCs)和序列类型(sequence types,STs)[20],以比较菌株在系统发育、遗传多样性、生态位和致病性方面的异同点。不同家系的菌株致病性和宿主特异性不同,对人类健康的威胁程度也不同,在一些流行病学研究中,需要对单增李斯特菌进化家系进行鉴别,为食品安全的评估、可能的感染暴发提供科技支撑。本文对单增李斯特菌进化家系的划分依据、不同家系的特点、流行特征、检测方法等进行了归纳总结,希望能为研究与菌株家系有关的单增李斯特菌病提供一定参考。
1 单增李斯特菌进化家系划分
单增李斯特菌起初的“家系”相关划分源于多位点酶电泳(multilocus enzyme electrophoresis,MEE)显示不同电泳簇(electrophoretic types,ETs)结果和菌株血清型分布不一致[21],为进一步寻找分离株之间的潜在关系而引入“进化家系”的概念。“家系(lineages)”名称的正式使用是在1997年,研究人员利用核糖体分型和3 种毒力基因hly、actA和inlA将133 株单增李斯特菌划分为家系I和家系II,且对核糖体片段和16S rRNA基因序列的分析中首次确定菌株另外一种独特家系——家系III的存在[22]。基于家系III菌株所呈现的独特性质和非典型性状,Roberts等[23]采用EcoRI核糖分型和hly基因的聚合酶链式反应-限制性酶切长度多态性(polymerase chain reaction-restriction length polymorphism,PCR-RFLP)法对46 株家系III菌株进行分析,系统发育研究证明了家系III存在3 个亚系(III A、III B和III C)[24]。家系IV的正式划分是在2008年,Ward等[25]利用多位点基因分型(multilocus genotyping,MLGT)方法建立系统发育树,说明家系IV菌株独立于家系III。至此,明确了单增李斯特菌可划分为4 种不同的进化家系[26](表1)。菌株家系的划分既可以明确分离株之间的相关关系,为菌株的系统发育和致病性研究提供思路,也可以作为菌株溯源和表达菌株生态位关系的依据。

表1 单增李斯特菌的家系划分Table 1 Classification of the lineages of Listeria monocytogenes
2 单增李斯特菌进化家系的特点
2.1 单增李斯特菌进化家系表型差异
单增李斯特菌分离株遗传特性的不同导致了菌株表型差异。不同家系菌株在生长速率、毒力相关表型、生物膜形成能力、对NaCl的耐受能力[28]、产细菌素的能力[29]以及对食品的污染等方面均存在差异。这些差异可为食品加工条件的设定、菌株的生态位关系表征及初步判断菌株毒力强弱提供部分依据和基础。
不同家系菌株表型差异首先表现在菌株生长速率和对食品的污染方面,在菌株生长速率研究中,不同家系菌株在不同的培养温度和培养基中的生长速率有所不同,其中37 ℃、含有质量分数6% NaCI的BHI培养基中家系I和III菌株的生长速率明显高于家系II[20,30]。特定培养环境造成菌株生长速率改变的同时一定程度上影响着菌株对食品的污染和对动物、人类的侵袭,不同处理方法下菌株对食品的污染能力不同,在高压和温热下,家系I菌株对食品的污染能力高于家系II[31]。此外,在多种胁迫条件下家系II菌株的生长和存活能力显著高于家系I[32-33]。
菌株对细胞的污染和侵袭程度与细菌在细胞表面的生物膜形成相关[34],研究显示家系II菌株比家系I更易生成生物膜[35],同时家系II菌株生物膜胞外基质中含有更多的胞外DNA[36-37]。胞外基质对细菌的黏附和定植至关重要,发生定植而溶解目标细胞的李斯特菌溶血素(listeriolysin S,LLS)多产生于家系I而非家系II菌株[29]。借助原子力显微镜研究细菌黏附发现,家系II菌株与家系I相比,其总体黏附力较高但特异性力(氢键)和非特异性力(范德华力和静电作用力)较低,并且细胞表现出更高的杨氏模量,同时表面形成更长、更硬的生物聚合物[38-39]。
细菌成斑实验和溶脂表型实验可为菌株毒力强弱的测定提供初步依据,不同家系菌株形成的噬菌斑、空斑大小和成斑率以及溶脂性现象等毒力相关表型均表现出不同。在噬菌斑成斑实验中,家系II菌株的成斑率低于家系I和III,同时其形成的噬菌斑更小[22]。类似的,家系I和家系II菌株相较于家系III能形成更大的空斑[40]。相比于家系I和家系II的分离株,家系III菌株在卵黄琼脂平板上表现出更强的溶脂活性[40]。
2.2 单增李斯特菌进化家系基因组差异
菌株在基因组水平上的差异源于基因特异性研究,不同家系菌株的基因组差异主要体现在基因含量、基因突异、基因重组和基因表达等方面。
菌株的基因组差异首先表现在基因含量上,利用多种基因组分析工具发现家系I和家系II菌株基因含量存在差异,这种差异除前噬菌体数目、编码蛋白质的伪基因个数和菌株特异性基因外[41],还包括毒力基因、应激反应基因和代谢相关的基因。使用RPKM(reads per kilobase per million mapped)法发现家系II菌株比家系I缺少编码膜相关蛋白的167 个基因[42]。Chen Jianshun等[43]发现参与编码菌株精氨酸脱亚氨酶和胍丁胺脱亚氨酶系的部分基因簇在家系I和家系II及大部分家系IV菌株中存在,但在家系III和少部分家系IV菌株则缺乏。对于不同家系菌株的基因组差异,菌株毒素-抗毒素系统的14 个等位基因同样表现出明显的差别[44]。与毒力基因相关的差异还包括李斯特菌致病岛(Listeriapathogenicity islands,LIPI)LIPI-3和LIPI-4组成基因[45],其中LIPI-3主要存在于家系I分离株[46]。除基因含量的差异外,单核苷酸多态性(single nucleotide polymorphism,SNP)、转座因子和基因缺失[29,47]等基因突变是基因组水平上最常见的差异。Zhang Xu等[48]通过Python编程语言对菌株基因组数据挖掘后,找到多个可以区分家系I、II、III菌株的特定SNP的候选基因。在基因突变中较为罕见的李斯特菌溶素正调节蛋白(listeriolysin positive regulatory protein,prfA)的移码及错义突变使得家系I和家系II菌株的毒力降低[49]。此外,水平基因转移现象也能反映不同家系菌株在基因水平上的差异,在基因转移上,家系III菌株对于家系I和家系II是最佳的基因供体[50]。
不同家系菌株的进化形成与同源重组和正向选择密切相关[51]。菌株系统发育中的基因重组表明,家系II菌株比家系I更容易发生重组[50],这导致了家系II菌株的高遗传变异性,也使得家系II菌株更容易适应变化的生态位,进而可能影响食品及其相关生态位中家系II和家系I菌株的数量[52]。
2.3 单增李斯特菌进化家系转录组差异
转录组研究是对基因结构和基因功能的拓展研究,不同家系菌株的转录组研究显示出菌株在噬菌体基因[53]、毒力相关基因、应激调控因子[54]和细胞壁合成[41]等方面的差异。
在证明菌株基因组多样性的同时,不同家系菌株在毒力基因分布上存在差异,研究显示高毒力基因和低毒力基因分别分布在家系I和家系II菌株中[7]。在氧化剂、酸和热响应等应激反应方面的转录组研究显示,家系I比家系II的ST菌株显示出对氧化剂更高的应激抵抗力,同时家系II菌株在体积分数0.6% H2O2作用下表现更为敏感[33]。Sigma B(σB)作为菌株最主要的调节因子,其对家系I、II和III B菌株在酸和氧化应激条件下的存活起重要作用,但是对家系III A菌株效果不明显[55]。此外,作为σB的替代调节因子,PrfA也影响着菌株在压力和毒性下的差异转录,菌株对胆汁的应激抵抗研究发现,家系II菌株发生差异转录的基因要少于家系I[56]。
此外,Lee等[7]基于多位点序列分型(multilocus sequence typing,MLST)发现家系I和家系II菌株在大部分转录水平上存在差异。
2.4 单增李斯特菌进化家系蛋白质组差异
在基因组和转录组水平上的研究不足以完全体现不同家系菌株的特点,基因调控和表达的变化同样会造成不同家系菌株致病性和侵袭能力的差异[57]。不同家系菌株可在蛋白质定量表达[58]、蛋白质表达程度和蛋白质种类(核糖体蛋白种类[59]、表面蛋白)等方面体现差异。
家系I和家系II菌株在蛋白组水平上的直接差异体现在蛋白质表达量上[58]。其次,使用二维凝胶电泳显示家系II菌株的蛋白表达程度没有家系I明显[60]。建立蛋白质种类和家系之间的联系不仅可以促进家系分型,也可以为菌株致病性研究提供帮助。Ojima-Kato等[59]借助基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization-time of flight mass spectrometry,MALDI-TOF MS)发现不同家系(家系I、II、III)的3 种核糖体蛋白存在差别。对于哺乳动物所需的表面蛋白lmo0320,家系II菌株是家系I的2 倍左右[32]。与菌株毒力相关的表面蛋白在不同家系菌株中同样存在差异[61]。这些蛋白质水平上的差异研究对于菌株致病性研究和生态位关系的确定有着积极促进作用。
2.5 单增李斯特菌进化家系代谢组差异
通过对菌株细胞内源物质的动态研究发现,不同家系菌株在代谢组的差异主要分为对物质的吸收利用和分解[57]、代谢途径差异[62]和物质的分泌等方面。
不同成分碳源物质的培养基会影响菌株的生长繁殖。含D-阿洛糖的富集肉汤可以改善菌株的分离并减少非目标细菌的生长,研究发现只有家系II菌株可以利用D-阿洛糖作为生长的碳源,其余家系菌株均不能[63]。此外,家系II菌株还可以代谢蔗糖[57]。研究菌株对物质的分解发现,III B和III C亚系分离株缺乏发酵鼠李糖的能力,但亚系III A则能够利用鼠李糖和乳酸[23]。这也从侧面说明不同家系菌株在碳源利用上存在一定的差异[57]。
由于代谢组位于基因组和转录组的下游,因此不同家系菌株在基因组和转录组的差异会导致代谢组的不同。转录组学分析结果表明家系II和家系I菌株在磷酸盐代谢、脂质代谢和辅酶辅基代谢中存在不同的富集趋势[7]。基于全基因组分析菌株遗传关系时发现家系I和家系II菌株的部分基因座编码的醛糖1-表异构酶代谢途径存在差异[62],这表明不同家系菌株基因组和代谢之间存在高度保守性[57]。
2.6 单增李斯特菌进化家系致病性
李斯特菌病的高致死率促进了对单增李斯特菌致病性研究,而菌株的致病性取决于各种毒力因子[64]。目前发现的毒力因子有李斯特致病岛家族(LIPI-1、LIPI-2、LIPI-3和LIPI-4)、蛋白质(表面蛋白(Internalin A、Internalin B)和P60蛋白[65])和转录调节因子[49,66]等,其中最主要的是LIPI-1。各种毒力因子的致病机理有所差异,如转录激活因子PrfA负责调节和控制许多毒力基因的转录表达[42],inlAB操纵子编码的两个内部蛋白对于进入非吞噬细胞至关重要[66]。不同进化家系菌株的致病性差异还与毒力因子的分泌相关。作为最重要的转录调节因子,σB的存在影响着家系I、II和III B菌株对人上皮Caco-2细胞的入侵[55]。不同家系菌株中的毒力基因也影响着菌株的致病性,编码Internalin蛋白的基因inlG、inlK和inlF通常出现在家系II菌株中[66]。同样,InlA蛋白(由inlA基因编码)的存在会影响菌株穿越人肠道屏障[67],而拥有全长inlA基因和LIPI-3/4的菌株通常会导致严重的李斯特菌病[68]。Chen Yi等[69]利用全基因组测序(whole-genome sequencing,WGS)技术对即食食品分离株的inlA基因的提前终止密码子(premature stop codon,PMSC)测序,发现家系I或带有全长inlA的分离株通常比家系II或带有inlAPMSCs的菌株具有更大的毒力潜能。除毒力因子外,不同家系菌株的致病性可能和细胞壁的WTA相关[17]。
不同家系菌株致病性强弱相差较大,大多数人类李斯特菌病的暴发是由含4 种外毒素的家系I菌株引起[70],这可能和其高度克隆的特性相关[32]。菌株进化中毒力会发生变化,这与毒力基因突变和相关蛋白丢失有关,研究发现家系II菌株的毒力丧失可能与毒力基因(prfA、inlA和inlB等)的突变有关[71],表面蛋白的缺失同样会促使家系III菌株毒力发生改变[72]。菌株致病性研究往往依赖于菌株分离,而菌株的分离获得与国家地域、饮食风俗、卫生条件和采样方法相关。Chenal-Francisque等[73]对五大洲共300 份分离株进行流行病学研究,发现很少有流行性菌株存在。在一些国家的研究中发现家系II菌株引起的人类李斯特菌病要多于家系I[74]。
3 单增李斯特菌不同进化家系的分型方法
单增李斯特菌流行病学研究中,分离株的家系分型结果和菌株来源有着密切联系,对分离获得的菌株进行家系鉴别后,需要进一步研究分析不同来源分离株的关系以说明菌株的遗传特性,而这种解释往往依赖于合适的分型方法。将分型方法和生态位相结合可以为李斯特菌病防控和卫生服务建设提供参考。
菌株精确的家系分型能为菌株种内遗传变异研究提供依据,尤其是菌株致病性方面[85]。最先用于家系分型的方法包括MEE、脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)、基于限制性片段的DNA指纹分型技术和核糖体分型等,其中PFGE使用范围广、区分能力强,被认为是分型的“金标准”。Lopez-Valladares等[74]根据PFGE条带将菌株分为家系I和家系II。然而PFGE结果在不同研究之间的解释和比较上难以统一且不易准确表明疾病暴发后菌株与环境之间的关联性[77]。为此,MLST[86-87]、基于SNP的高分辨熔解(high resolution melting,HRM)技术[88]、多位点可变数目串联重复序列分析(multilocus variable number of tandem repeat analysis,MLVA)分型[89]、多位点毒力基因序列分型(multivirulence-locus sequence typing,MVLST)[90]及其他基于PCR的相关分型方法相继投入应用。Miya等[77]基于串联重复区的核苷酸序列,建立比MLST有更强区分能力的多位点串联重复序列分析(multilocus tandem repeats sequence analysis,MLTSA)分型方法,成功将菌株分为家系I和家系II。马彦宁等[82]利用LIPI-1的等位基因特异性寡核苷酸,将菌株分为家系I、家系II和家系III。Wang Yi等[81]建立多重PCR方法用于4 种家系和2 个亚系菌株的快速区分鉴定。除此之外,利用不同家系菌株的特定SNP候选基因同样实现了家系的分型[48]。这些分型方法的建立和应用一定程度上加快了进化家系的遗传发育和致病性研究。但是MLST和MLVA方法缺乏对于大量疾病暴发株的区分能力[80,91],且MLVA的区分能力略弱于PFGE[80],等位基因特异性寡核苷酸(allele-specific oligonucleotide,ASO)-PCR对单管反应确定菌株家系要求较高。为更好地进行家系菌株分型,WGS越来越多地作为开发基因分型方法的基础[92],其数据还可以用于毒力基因的检测和地理归属的确定。WGS被广泛使用在跨区域、多来源的单增李斯特菌株家系分型、遗传多样性及致病性研究[93-94]。Chen Yi等[69]通过WGS序列的核基因组MLST(core genome MLST,cgMLST)构建系统发育树对即食食品分株进行家系分型研究,结合WGS分析确认了家系I、家系II和家系III的相关分离株。比较基因组学方法不仅在致病株遗传研究和家系分型中应用普遍[95],而且在探究对入侵宿主相关基因[96]和揭示不同家系菌株侵袭力、毒力[57]变化中同样广泛使用。除上述家系分型方法外,质谱和菌株表面蛋白也被用于家系分型。Koudelka等[97]利用MALDI-TOF MS对李斯特菌病和食品分离株进行家系分型,基于自建库的分型准确率为95.7%。Zhang等[98]将菌株的表面蛋白开发为单克隆抗体的抗原靶标,特定单克隆抗体对家系II和I菌株的特异性识别率为91.3%(表2)。
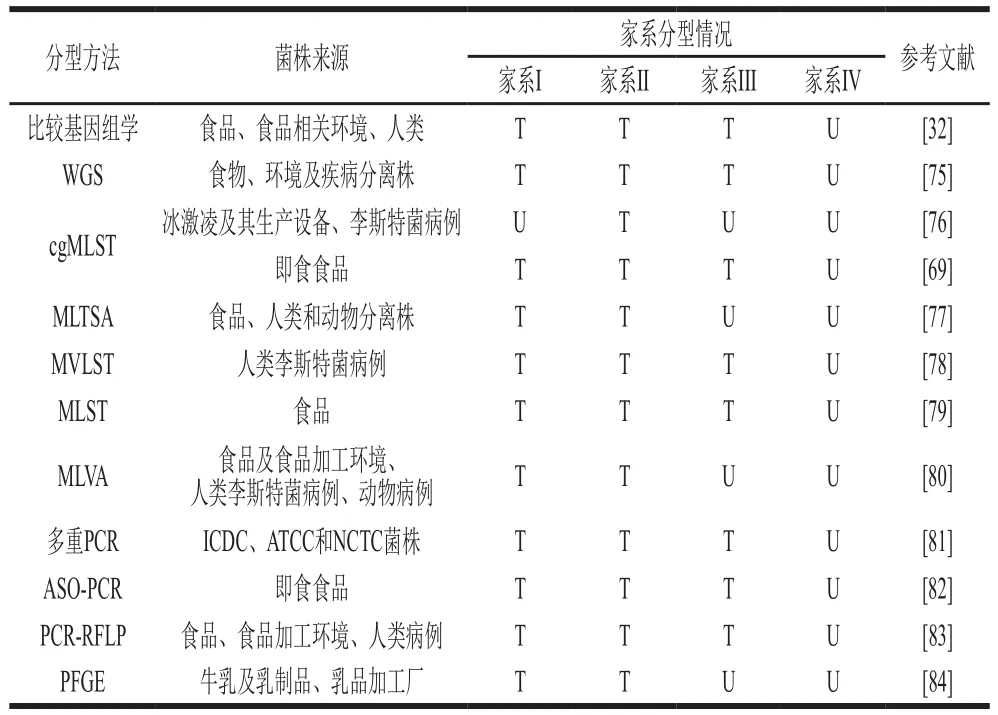
表2 单增李斯特菌典型家系分型方法Table 2 Typing methods for typical lineages of Listeria monocytogenes
基于多种家系分型结果,单增李斯特菌4 种家系之间存在重叠的生态位关系。相较而言,家系I菌株在人类和动物李斯特菌病中分离获得较多[99],家系II菌株主要分离自食品及食品加工环境[100]。家系III和家系IV菌株则较少分离获得[101],这可能和菌株的生物膜形成能力有关,加工过程产生的环境压力造成菌株数量减少,从而难以分离获得。总之,家系II和家系I菌株较常分离获得,因而常见于菌株流行病学和遗传发育研究。为更好地体现家系分型的研究意义,有必要综合考虑菌株分离来源(国家或地区、分离位点、分离基质和分离季节等)。
4 结 语
综上所述,单增李斯特菌的进化家系在表型、基因组及致病性等方面均存在差异,在食品安全领域对分离菌株进行家系分析,不仅可以对食品生产加工过程中菌株的耐受能力和膜形成能力做出预先判断,为食品加工过程中菌株的消灭提供参考;同时,也可以了解不同家系菌株在食品中的分布规律,为食品中单增李斯特菌的风险识别提供基础数据。
