升温方式对鲢鱼肌球蛋白结构和理化性质的影响
2021-12-02梁雯雯汪秋宽丛海花陈胜军
梁雯雯,杨 天,郭 建,,汪秋宽,丛海花,*,陈胜军
(1.大连海洋大学食品科学与工程学院,海洋食品精深加工关键技术省部共建协同创新中心,辽宁省水产品加工及综合利用重点实验室,辽宁省水产品分析检验及加工科技服务技术中心,辽宁 大连 116023;2.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东 广州 510300)
随着鱼糜产业的飞速发展,鱼糜需求量的上升,鲢鱼(Hypophthalmichthys molitrix)作为四大淡水鱼之一,因其产量丰富和价格低廉常用来生产淡水鱼糜,从而提高鲢鱼的附加值,并解决鱼糜原料短缺的问题。传统鱼糜热处理方式为水浴二段加热,一段式加热鱼糜在温度50~65 ℃之间发生凝胶劣化,肌原纤维蛋白降解严重,因此,为避免凝胶劣化,行业中一般先采用5~40 ℃放置一段时间再90 ℃加热一段时间进行处理[1]。热处理加工过程中,当样品中心温度要求较高时,不同处理方式加热至样品目标中心温度的升温时间差异显著[2],升温过程的不同导致产品品质不同这一结论已经得到证实,但现有报道和实际热加工生产中升温过程往往被忽略,通常默认为此阶段样品中心温度已经达到设定值,将升温时间计入保温时间。
微波加热是一种新兴的鱼糜熟化方式。二段式微波加热的鱼糜凝胶强度明显高于直接微波加热[3];闫虹[4]和Cao Hongwei[5]等发现先微波后水浴加热(微波加热代替传统水浴二段加热的低温段)产品的凝胶品质低于水浴二段加热,而先水浴加热后微波加热(微波加热代替传统水浴二段加热的高温段)在提高白鲢鱼糜凝胶特性方面,明显优于微波加热,且均显著优于传统水浴二段加热,无论是保温模式还是时间依赖模式都能明显提高鱼糜凝胶的品质。目前研究对微波辅助水浴加热的报道较少。肌球蛋白在鱼糜凝胶化过程中起关键作用,基于交变电场变化的微波快速加热更有利于肌球蛋白分子展开,促进肌球蛋白分子的聚集[6]。汪媛等[7]发现微波功率密度8 W/mL条件下,肌球蛋白分子在短时间(80 s)内变性和聚集同时发生,而在2.67 W/mL条件下,肌球蛋白分子则呈现逐渐变性而后聚集的趋势。
加热方式不同引起的升温速率差异导致鱼糜蛋白变性和聚集程度不同[8],在实际生产中传统水浴二段加热过程中往往忽略的升温过程对肌球蛋白的影响尚未有研究。本实验比较分析了在传统水浴二段加热的低温段和高温段分别采取水浴升温(water bath heating,WH)、微波升温(microwave heating,MH)或微波辅助水浴升温(microwave assisted water bath heating,MWH)对鲢鱼肌球蛋白结构和理化性质的差异,以期为快速加热方式在鱼糜加工业中的应用提供参考。
1 材料与方法
1.1 材料与试剂
鲜活白鲢购于大连熟食品交易中心,运至实验室,宰杀后去头去内脏,用4 ℃去离子水冲洗干净待用。
三磷酸腺苷(化学纯) 美国Sigma公司;溴化钾(光谱纯) 天津市大茂化学试剂厂;三(羟甲基)氨基甲烷(生化试剂) 国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DS-1高速组织捣碎机 上海标本模型厂;8807电子温度计 得力集团有限公司;HR/T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;NEXUS670型傅里叶变换红外光谱仪 美国PerkinElmer公司;Q20差示扫描量热(differential scanning calorimeter,DSC)仪美国TA公司;Epoch2型酶标仪、SynergyH1/H1M酶标仪美国伯腾仪器有限公司;F-2700荧光分光光度计 日本Hitachi公司;G80D23CSL-Q6格兰仕微波炉 佛山市顺德区格兰仕微波炉电器有限公司;UV-9000型双光束紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
根据Cao Liwei等[9]的提取方法略作修改。手工剔取白鲢背部白肉,切成肉糜状,加入10 倍体积的溶液A(0.1 mol/L KCl、0.02 mol/L Tris,pH 7.0)于4 ℃下漂洗10 min,3 000 r/min均质,3 000 r/min离心5 min;沉淀于5 倍体积溶液B(0.45 mol/L NaCl、0.2 mol/L醋酸镁、0.001 mol/L乙二胺四乙酸、0.02 mol/L Tris、0.005 mol/Lβ-巯基乙醇,pH 6.8)中悬浮,并加ATP至终浓度为0.005 mol/L,于4 ℃下放置2 h;8 000 r/min离心20 min,上清液加入3 倍体积溶液D(0.001 mol/L KHCO3)于4 ℃下放置15 min;9 000 r/min离心15 min取沉淀;沉淀加入2.5 倍体积的溶液C(0.5 mol/L KCl、0.02 mol/L Tris、0.005 mol/Lβ-巯基乙醇,pH 7.5)悬浮,于4 ℃下放置10 min后加入2.5 倍体积的溶液D稀释,并加MgCl2至终浓度为0.01 mol/L,于4 ℃下放置过夜;10 000 r/min离心15 min,沉淀用1 倍体积溶液E(0.5 mol/L KCl、0.02 mol/L Tris,pH 7.0)溶解,5 000 r/min离心10 min,取上清液,透析过夜,所得即为肌球蛋白。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测肌球蛋白纯度。
1.3.2 肌球蛋白质量浓度的测定
采用双缩脲法[10],使用Epoch2型酶标仪在540 nm波长处测定吸光度,以牛血清白蛋白(bovine serum albumin,BSA)的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。准确吸取1 mL鲢鱼肌球蛋白溶液,加入4 mL双缩脲试剂并混合均匀,避光静置30 min后测定540 nm波长处的吸光度,按照标准曲线求出相应的肌球蛋白质量浓度。
1.3.3 升温方式
将提取的肌球蛋白用含0.5 mol/L KCl的20 mmol/L Tris-HCl(pH 7.5)缓冲液稀释成10 mg/mL,分别取稀释后的肌球蛋白溶液25 mL于50 mL离心管中,按表1进行加热(温度使用手持式电子温度计测得)。WH:将离心管置于40 ℃或90 ℃的水浴锅中,待样品中心温度升至40 ℃或90 ℃时停止加热。MH:将离心管置于微波炉转盘中心,微波间歇加热(加热10 s停10 s),待样品中心温度至40 ℃或90 ℃时停止加热。MWH:将离心管放在装有200 mL去离子水(20±2)℃的250 mL烧杯中,置于微波炉转盘中心,微波间歇加热(加热10 s停10 s),待样品中心温度至40 ℃或90 ℃时停止加热。

表1 肌球蛋白不同升温方式Table 1 Different heating methods designed in this study
1.3.4 肌球蛋白理化性质的测定
1.3.4.1 总巯基含量的测定
根据朱东宏等[11]的方法略作修改。取10 mg/mL肌球蛋白样液0.5 mL,加入4.5 mL的Tris-HCl(0.2 mol/L Tris、8 mol/L尿素、质量分数2% SDS,10 mmol/L乙二胺四乙酸,pH 6.8)缓冲液,混匀后取混合液4 mL,加入0.4 mL的2-硝基苯甲酸(质量分数0.1%)溶液,40 ℃保温25 min,于412 nm波长处测定吸光度。按下式计算总巯基含量。
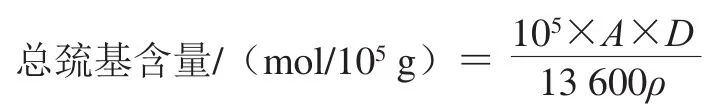
式中:A为412 nm波长处的吸光度;D为稀释倍数;ρ为蛋白质量浓度/(mg/mL)。
1.3.4.2 表面疏水性的测定
根据Benjakul等[12]的方法略作修改。将10 mg/mL样品稀释成0.1~0.5 mg/mL,然后取各质量浓度肌球蛋白溶液2 mL加入10 μL 8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(10 mmol/L ANS、20 mmol/L Tris,pH 7.5),混匀避光静置10 min。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测肌球蛋白纯度,使用Image J软件分析计算。使用SynergyH1/H1M酶标仪设置激发波长303 nm、发射波长485 nm、增益50。以荧光强度对肌球蛋白各质量浓度作图,所得直线斜率即为肌球蛋白表面疏水性系数(ANS-S0),以此表示表面疏水性。
1.3.4.3 浊度的测定
根据Liu Ru等[13]的方法略作修改。将肌球蛋白样液稀释成1 mg/mL,充分混匀后静置20 min,于320 nm波长处测其吸光度,以吸光度表示蛋白浊度。
1.3.4.4 溶解度的测定
根据周建中等[14]的方法略作修改。将肌球蛋白样液稀释成3 mg/mL,4 ℃放置30 min后10 000 r/min(4 ℃)离心10 min,双缩脲法测上清液蛋白质量浓度,用上清液蛋白质量浓度与原始蛋白质量浓度的百分比表示溶解度。
1.3.4.5 色氨酸荧光光谱分析
根据Li Yue等[15]的方法略作修改。将肌球蛋白样液稀释成1 mg/mL。使用荧光分光光度计进行测定,设定激发光的起始波长300 nm,荧光发射波长280 nm,激发光的终止波长450 nm,该条件下荧光强度为荧光图谱中的峰值。
1.3.4.6 紫外吸收光谱分析
根据康怀彬等[16]的方法略作修改。将肌球蛋白样液稀释成0.5 mg/mL,以Tris-HCl缓冲液作为空白,进行紫外吸收光谱扫描,扫描速率10 nm/s,扫描波长范围190~600 nm。利用Origin软件对紫外吸收光谱数据进行二阶导数计算,并绘制二阶导数图谱。
1.3.4.7 傅里叶变换红外光谱分析
根据Liu Jianhua等[17]的方法略作修改。将热处理后的肌球蛋白冷冻干燥并粉碎,取冻干后的肌球蛋白粉末与溴化钾按质量比1∶50充分混合,在约18 MPa的压力下加压2 min,扫描范围为450~4 000 cm-1。利用Peakfit 4.12软件在1 600~1 700 cm-1进行基线校正,在二阶导数谱基础上采用Gauss分峰拟合,根据积分面积计算各二级结构组分的相对含量[18]。本实验仅对凝胶化过程中涉及的主要结构α-螺旋和β-折叠二级结构组分进行定量分析,各子峰与二级结构对应关系:1 610~1 639 cm-1被认为是β-折叠结构,1 661~1 680 cm-1被认为是α-螺旋结构[19]。
1.3.4.8 热稳定性分析
根据Dergez等[20]的方法略作修改。称量热处理后的肌球蛋白样液(15±1)mg于铝坩埚中密封。以空铝坩埚作为空白,扫描温度为0~150 ℃,升温速率为5 ℃/min。
1.4 数据处理与分析
数据采用Microsoft Excel 2010软件整理,采用Origin 2018软件进行绘图。采用SPSS Statistics 21.0软件对数据进行Duncan’s显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 SDS-PAGE分析结果
如图1所示,提取的肌球蛋白主要由分子质量约为220 kDa的肌球蛋白重链亚基谱带和15~25 kDa的肌球蛋白轻链亚基谱带以及43 kDa的肌动蛋白条带组成,测定肌球蛋白纯度为87.8%。
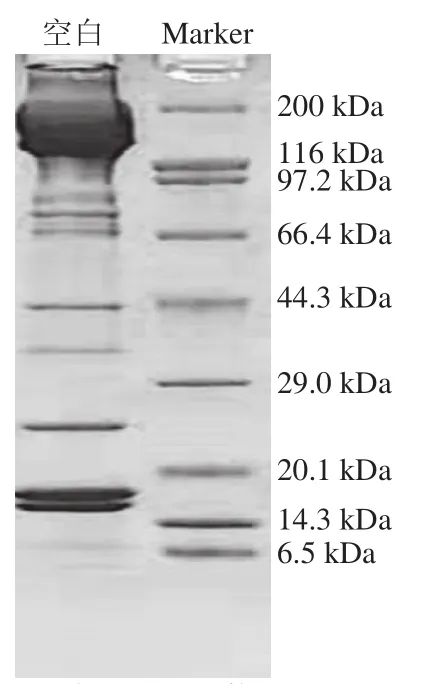
图1 鲢鱼肌球蛋白的SDS-PAGE图谱Fig. 1 SDS-PAGE patterns of myosin extracted from silver carp
2.2 升温方式对肌球蛋白总巯基含量的影响
巯基含量的变化可作为肌球蛋白性质变化的一个重要指标。从图2可以看出,低温段和高温段3 种升温方式的总巯基含量C处理组>A处理组>B处理组,且C处理组显著高于A与B处理组(A和B处理组之间无显著差异)。与Cao Hongwei等[6]发现肌球蛋白总巯基含量在40 ℃时微波加热比水浴加热略有下降的研究结果一致,微波加热的肌球蛋白分子之间形成二硫键,更容易导致总巯基的数量逐渐减少,由于微波与水浴加热机制不同,微波加热时极性分子随着电磁场的变化而不断变化,导致介质温度快速升高,引起水分分布、蛋白质分子聚集方式和空间结构的改变[21]。加热导致肌球蛋白凝胶化的其中一种条件是反应发生在较低的温度,如40 ℃时改变肌球蛋白分子的重链形态,导致轻链脱落,暴露了肌球蛋白头部许多部位的疏水区域,使得肌球蛋白分子形成分子间头对头聚集[22]。升温至90 ℃时,微波快速加热会使巯基转化为二硫键,二硫键含量一定程度的提高为获得更高的凝胶强度、促进蛋白质分子交联提供基础[23]。二硫键的形成导致大分子聚集从而使一些暴露的巯基重新被掩埋,肌球蛋白尾部缠绕形成稳定的三维网络结构。
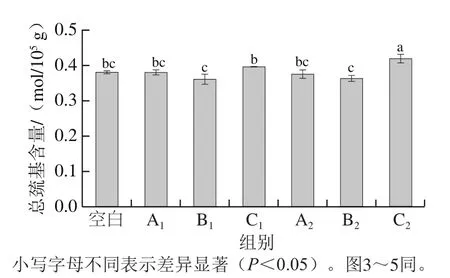
图2 肌球蛋白总巯基含量Fig. 2 Effect of different heating methods on total sulfhydryl group content of myosin
2.3 升温方式对肌球蛋白表面疏水性的影响
肌球蛋白受热变性导致空间结构发生改变,双螺旋结构解开使更多的疏水性氨基酸残基暴露出来,增加了蛋白质表面疏水性[24]。从图3可以看出,低温段与高温段C处理组的表面疏水性显著低于A与B处理组(A和B处理组之间无显著差异),当样品升温时间长,整体受热多时,促进肌球蛋白结构的展开导致更多的疏水基团暴露出来,暴露的疏水基团直接参与肌球蛋白凝胶网络的形成[6];也可能是肌球蛋白展开但交联程度不同所致,微波加热时二硫键不易形成与聚集,不易导致表面疏水性降低[25],这与图2结果相互印证。在90 ℃时MH和MWH样品的肌球蛋白聚集时间不充分,肌球蛋白分子缺少有效的时间重新排列,参与凝胶网络形成与加强的疏水基团少,也可能是MH和MWH样品形成的肌球蛋白聚集体没有造成大量疏水基团被包埋[6]。不排除表面疏水性检测过程中实验操作或者误差导致C处理组数据显著降低。加热后,肌球蛋白分子运动增强,巯基转化成二硫键导致肌球蛋白构象发生变化,肌球蛋白分子内外共价键等断裂使分子伸长,疏水区域暴露,一些疏水基团暴露在表面,变性的肌球蛋白分子参与分子间或分子内的氢键和二硫键以及静电和疏水相互作用,导致聚集[26-28]。
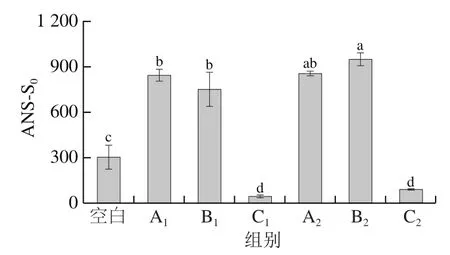
图3 肌球蛋白表面疏水性Fig. 3 Effect of different heating methods on surface hydrophobicity of myosin
2.4 升温方式对肌球蛋白浊度的影响
浊度反映了溶液中悬浮颗粒的数量和大小,可以用来表征蛋白质聚集的程度,蛋白质聚集后溶液中悬浮颗粒的直径增加,聚集到一定程度时可能导致光散射,阻碍光的传播[29]。低温段3 种升温方式的浊度差异显著(P<0.05),且C1处理组>B1处理组>A1处理组(图4),表明不同升温方式的肌球蛋白在低温条件发生了不同程度的交联。高温段3 种升温方式,C2处理组的浊度显著高于A2和B2处理组(P<0.05),但A2和B2处理组的浊度无显著差异(P>0.05),不同升温速率导致肌球蛋白变性和聚集的相对速率不同,使得肌球蛋白分子展开和分子间聚集的程度不同[30],WH样品的浊度最大,表明肌球蛋白发生了一定的构象变化,形成的聚集体越大,变性程度越大,而MH降低了与肌球蛋白聚集相关的浊度[6]。肌球蛋白的变性和聚集过程实际上反映了鱼糜凝胶的形成过程。在微波加热过程中,交变电场会改变蛋白质分子内部的电荷场和电场分布,从而破坏蛋白质之间的静电相互作用,肌球蛋白分子通过疏水相互作用和其他分子间作用力聚集[31]。

图4 肌球蛋白浊度Fig. 4 Effect of different heating methods on turbidity of myosin
2.5 升温方式对肌球蛋白溶解度的影响
溶解度是反映蛋白质变性程度的指标之一。从图5可以看出,低温段、高温段3 种升温方式的肌球蛋白溶解度均差异显著(P<0.05),A处理组>B处理组>C处理组。A1处理组溶解度高与Nguyen等[32]研究微波处理所得酶解水产副产物在pH值为7条件下水解比水浴处理具有较高的溶解性的结果一致,适当的微波处理有助于蛋白质的展开,在这种情况下内部的亲水性氨基酸可能更多的接触水分子[33]。溶解度变化与浊度变化呈负相关关系,尤其是低温段,反映出肌球蛋白变性聚集过程,微波加热除了有热效应还有场效应,会引起肌球蛋白之间的相互作用减弱[34]。溶解度的降低表明蛋白分子间的静电和疏水相互作用不平衡,肌动球蛋白快速变性和聚集;溶解度升高表明分子间的静电排斥作用大于疏水相互作用[35]。
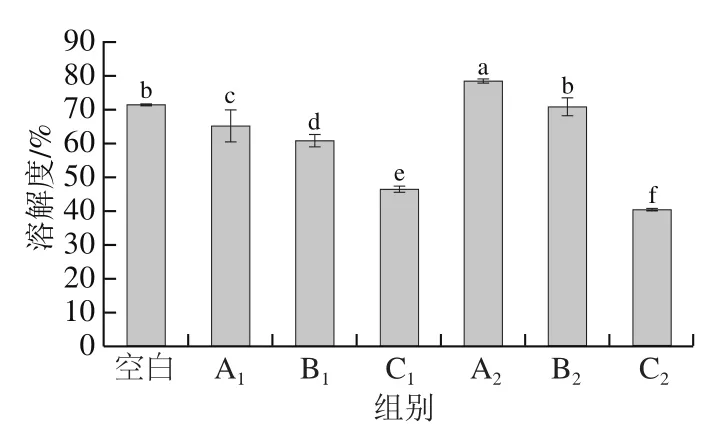
图5 肌球蛋白溶解度Fig. 5 Effect of different heating methods on solubility of myosin
2.6 不同升温方式的肌球蛋白色氨酸荧光光谱
肌球蛋白的球状头部和棒状尾部含有大量的色氨酸残基,色氨酸残基的暴露情况可以反映蛋白质的三级结构变化,可以通过检测肌球蛋白的色氨酸荧光强度来反映构象变化[36]。从图6可以看出,鲢鱼肌球蛋白的荧光峰在340 nm波长处左右。3 种升温方式色氨酸荧光强度A处理组>B处理组>C处理组,荧光强度越高说明肌球蛋白越容易变性展开,对三级结构的影响越大,MH样品暴露的色氨酸残基多,MH样品的光谱蓝移程度高于MWH样品,表明发射基团位于更为疏水的微环境。升温至相同温度,MH和MWH样品的肌球蛋白的变性程度小于WH样品,说明微波有效地抑制了加热过程中蛋白质结构的变化,这表明可能存在由微波辐射产生非热效应[37],有待进一步实验验证。
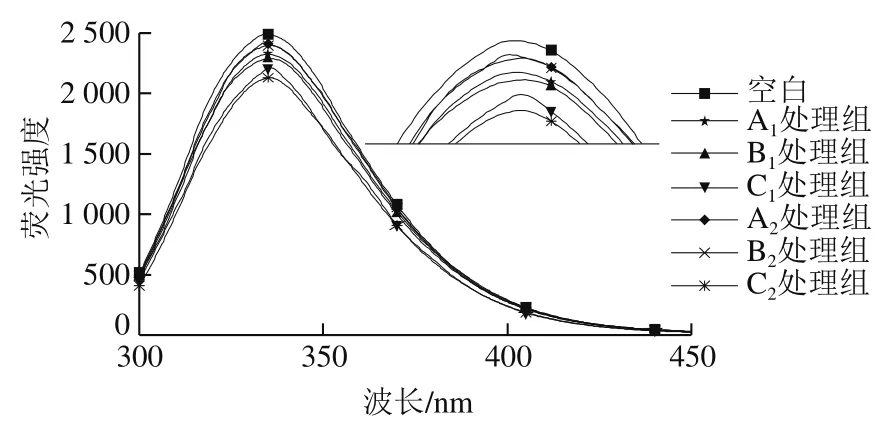
图6 不同升温方式的肌球蛋白色氨酸荧光光谱Fig. 6 Tryptophan fluorescence spectra of myosin subjected to different heating methods
2.7 不同升温方式肌球蛋白紫外吸收光谱的变化
色氨酸(tryptophane,Trp)或酪氨酸(tyrosine,Tyr)等残基的微环境的变化在一定程度上能够反映蛋白质的三级结构变化。当所处的微环境疏水时,特征谱峰会发生蓝移,芳香族残基暴露于肌球蛋白分子表面。从图7可以看出,不同升温方式的肌球蛋白的紫外吸收光谱的峰位置基本一致,在波长280 nm左右出现吸收峰,波长未发生迁移,这一现象表明肌球蛋白中酪氨酸和色氨酸的微环境变化不明显。低温段和高温段3 种升温方式的紫外吸收峰强度MH和MWH均高于WH,表明微波导致色氨酸和酪氨酸的吸收较强,这种升温方式可能改变了蛋白质的结构,促进色氨酸和酪氨酸转移到表面,导致紫外吸收更强。
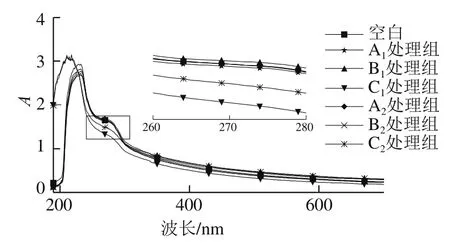
图7 肌球蛋白在不同升温方式紫外吸收光谱Fig. 7 UV absorption spectra of myosin subjected to different heating methods
为了进一步研究不同升温方式的肌球蛋白构象的细微差异,得到的紫外吸收二阶导数光谱在289 nm和296 nm波长处附近有两个正吸收峰,在285 nm和291 nm波长处附近有两个负吸收峰。r取决于Trp和Tyr的相对含量和暴露于水相的量,即r=a/b(a和b分别为第一次和第二次正吸收峰与负吸收峰的差值),r越高,表明Tyr残基的表面暴露量越大[38]。C1和C2处理组在289 nm波长处的吸收峰红移程度较其他升温方式大,表明极性环境减弱,会导致表面疏水性降低,与图3表面疏水性结果一致。如表2所示,低温段3 种升温方式r由大到小依次为C1处理组>B1处理组>A1处理组,表明WH暴露的Tyr残基更多,MH和MWH对三级结构的影响更小。高温段3 种升温方式r由大到小依次为B2处理组>A2处理组>C2处理组,表明升温到高温段的肌球蛋白三级结构对微波更敏感,在90 ℃时更有利于肌球蛋白分子展开,肌球蛋白分子内的疏水残基更容易暴露[6],与酪氨酸荧光光谱高温段分析结果一致。

表2 285 nm/289 nm和291 nm/296 nm正吸收峰与负吸收峰的峰谷值比Table 2 Peak-to-trough ratios of positive and negative absorption peaks at 285 nm/289 nm and 291 nm/296 nm
2.8 不同升温方式肌球蛋白傅里叶变换红外光谱
傅里叶变换红外光谱可以用来研究肌球蛋白的二级结构,酰胺I带(1 600~1 700 cm-1)是蛋白质二级结构较为主要的研究内容,1 664 cm-1处的特征吸收峰归属于酰胺I带C=O的伸缩振动。从图8中可以看出,不同升温方式的鲢鱼肌球蛋白的傅里叶变换红外光谱峰型基本一致,峰位置也基本一致。低温段3 种升温方式下,α-螺旋相对含量C1处理组>A1处理组>B1处理组,β-折叠相对含量B1处理组>C1处理组>A1处理组,MH的-β折叠相对含量比MWH的低。Liu Ru等[39]发现α-螺旋的展开和β-折叠含量的增加有利于猪肌球蛋白的凝胶化,在热诱导肌球蛋白凝胶形成过程中普遍存在α-螺旋含量减少、β-折叠片段含量增多的现象,其中α-螺旋含量的减少与肌球蛋白的展开有紧密的关系[29],说明WH样品的肌球蛋白变性程度高,MWH促进肌球蛋白展开。α-螺旋结构的稳定性主要来源于羰基(C=O)和氨基(—NH2)之间的氢键,当温度超过35 ℃时,氢键逐渐被破坏,导致α-螺旋结构含量减少[40]。高温段3 种升温方式下,α-螺旋相对含量A2处理组>B2处理组>C2处理组,β-折叠相对含量C2处理组>B2处理组>A2处理组,在加热条件下α-螺旋含量降低代表蛋白质分子展开程度增加,而β-折叠含量增加代表蛋白质分子间聚集程度增加[41],与图4高温段浊度结果一致。不论低温段还是高温段升温,MH样品的β-折叠相对含量低于MWH样品,MH样品的α-螺旋相对含量高于MWH,说明MH样品的肌球蛋白变性程度高,肌球蛋白展开程度低,β-折叠相对含量结果也与表3中β-折叠/(α-螺旋+β-折叠)比值增加的结果一致。微波加热和微波辅助加热升温方式在较低温度更容易破坏肌球蛋白分子内的α-螺旋结构,导致结构逐渐消失,但在较高温度时比传统水浴加热升温方式,更多地保留了α-螺旋结构。
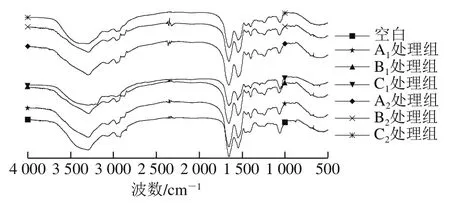
图8 不同升温方式肌球蛋白傅里叶变换红外光谱Fig. 8 FTIR spectra of sliver carp myosin subjected to different heating methods
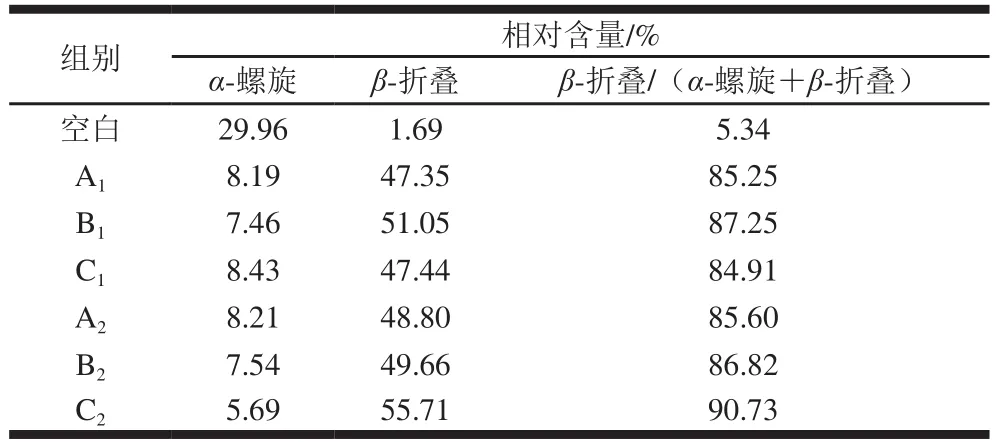
表3 不同升温方式下肌球蛋白α-螺旋和β-折叠的比例Table 3 Percentages of α-helix and β-sheet structures in silver carp myosin subjected to different heating methods
2.9 不同升温方式下肌球蛋白热稳定性
DSC能够直观地反映肌球蛋白在变性时吸收的热量值,根据峰值和峰面积可以分别确定肌球蛋白的热转变温度Td和热焓值ΔH,不同升温方式的肌球蛋白DSC图谱如图9所示,热转变温度和热焓值结果如表4所示。肌球蛋白受温度改变而发生变性,不同升温方式的鲢鱼肌球蛋白变性温度为46.56~54.78 ℃,结果与Rahbari等[42]的报道差异不大,不同升温方式的肌球蛋白吸收峰未完全消失,表明肌球蛋白的三级结构未完全变性。低温段3 种升温方式下,A1和C1处理组表现出非常小的热焓值,然而,B1处理组的肌球蛋白热焓值较高,同时B1处理组的热转变温度高,表明肌球蛋白越不容易变性或部分肌球蛋白没有变性,MWH能够改变肌球蛋白的热稳定性,C1处理组的肌球蛋白热转变温度最低,说明该方式的肌球蛋白热稳定性低,变性程度大,抗变性能力弱。高温段3 种升温方式下,A2处理组的肌球蛋白热焓值明显高于其他升温方式,热转变温度较低,而B2处理组的热转变温度高,表明MWH的肌球蛋白的空间结构是稳定的,因此在加热时不易聚集,与图3高温段浊度加热结果一致。
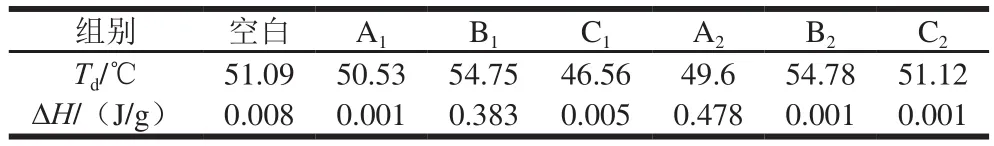
表4 不同升温方式肌球蛋白热稳定性Table 4 Thermal stability of myosin under different heating methods
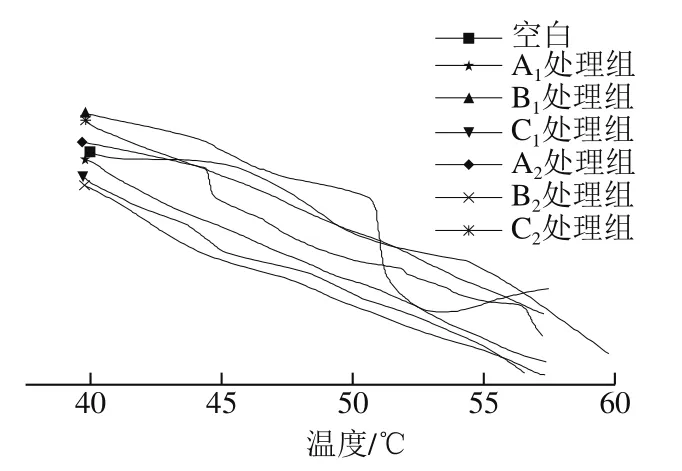
图9 不同升温方式肌球蛋白DSC图谱Fig. 9 DSC spectra of sliver carp myosin subjected to different heating methods
3 结 论
升温方式不同导致鲢鱼肌球蛋白结构和性质出现差异。MH和MWH与WH相比明显缩短了升温时间,大大提高了效率。低温段MH和MWH促进肌球蛋白交联,MWH促进肌球蛋白展开,有利于肌球蛋白的凝胶化。高温段WH样品的肌球蛋白聚集程度高于MH和MWH样品,MH对肌球蛋白三级结构影响较大,暴露出更多的氨基酸残基。在生产加工过程中不能忽略升温过程,MWH促进蛋白凝胶化效果优于MH,在实际生产中生产效率明显高于WH。推测可能存在一定的非热效应,后续实验需采取能精准控温的计算机模拟方法对实验结果进一步验证。
猜你喜欢
杂志排行
食品科学的其它文章
- 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展
- 茶多酚对小麦淀粉理化特性和面包品质的影响及机理
- 运动对苏尼特羊脂肪代谢和肉品质的影响
- Thermal Unfolding and Aggregation Process of Recombinant Staphylococcal Enterotoxin M (rSEM) Associated with Potential Toxin Responsible for Staphylococcal Food Poisoning
- 小米麸皮水溶性膳食纤维-Cr(III)配合物的合成、表征及其体外抗氧化活性
- 基于氨基功能化离子液体萃取番茄中超氧化物歧化酶
